Gezielte Therapien bei axSpA – und wie aus ihnen zu wählen ist
Bericht: Ines Schulz-Hanke
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nachdem 2003 der erste TNF-Blocker zugelassen wurde, existiert heute für die röntgenologische (r-axSpA) und die nichtröntgenologische axiale Spondyloarthritis (nr-axSpA) eine ganze Reihe von Therapieoptionen. Sie reichen von IL-17- und JAK-Inhibitoren bis hin zuIL-17A/F-Inhibitoren. In der klinischen Praxis sollten Wirksamkeit, radiografische Progression, Manifestationen und Leitlinien sowie einige weitere Aspekte die Therapiewahl leiten.
Keypoints
Bei der Therapiewahl zu berücksichtigen sind:
-
Wirksamkeit auf die Haupt- und Nebenmanifestationen axial und peripher (Psoriasis, CED, Uveitis),
-
etwaige Komorbiditäten und Nebenwirkungen sowie individuelle Patient:innenwünsche und -pläne wie Applikationsform und Schwangerschaft,
-
eine möglichst langfristige Strategie mit hoher Patienten-Compliance und geringer radiologischer Progression sowie
-
Wirtschaftlichkeit und zukünftig gegebenenfalls Biomarker.
Aktuell zugelassen seien für die nr-axSpA etwas weniger Medikamente als für die r-axSpA, da hier zum Teil die Wirksamkeit in den Zulassungsstudien nicht gezeigt worden sei, berichtete Dr. David Kiefer, Herne.1–17 Die Vorgehensweise bei der Therapieentscheidung demonstrierte er am hypothetischen Fall einer 32-jährigen Patientin mit diagnostizierter ankylosierender Spondylitis und
-
seit 6 Monaten bestehenden entzündlichen Rückenschmerzen,
-
einer Schmerzintensität von 7–10 auf der numerischen Rating-Skala (NRS) unter NSAR,
-
erhöhtem C-reaktivem Protein (CRP 2,5mg/dl) und
-
einer hohen Krankheitsaktivität (HDA) mit einem ASDAS (Ankylosing Spondylitis Disease Activity Score) von 3,2.
Wirksamkeit: bisher keine Head-to-Head-Studien
In klinischen Studien werde die Wirksamkeit in Form der ASAS40 (Assessment-in-SpondyloArthritis-international-Society-40%) gemessen, erklärte Kiefer. Sie sei definiert als Verbesserung um ≥40% oder ≥20 Punkte auf der Skala von 0–100 Punkten, und zwar in mindestens 3 der folgenden 4 Bereiche:
-
Rückenschmerz auf der visuellen Analogskala (VAS)
-
globale Beurteilung der Krankheitsaktivität durch die Patientin/den Patienten (VAS)
-
körperliche Funktionsfähigkeit im Bath Ankylosing Spondylitis Functional Index (BASFI; Skala 0–100)
-
Entzündung (Mittelwert der Punkte 5 und 6 [Morgensteifigkeit] des BASDAI, beide auf der 10-cm-VAS). Hier soll keinerlei Verschlechterung eintreten.
Als Wirkmechanismen stünden die Inhibition von TNF, IL-17, IL-17A/F sowie der JAK zur Verfügung. Bisher gebe es keine Head-to-Head-Studien. Jedoch sei eine „Matching adjusted indirect comparison“(MAIC)-Analyse zur vergleichenden Wirksamkeit fortschrittlicher Therapien bei TNF-naiven Patientinnen und Patienten durchgeführt worden sowie eine Network-Metaanalyse (NMA) zur Wirksamkeit bei TNF-Behandelten mit unzureichendem oder fehlendem Ansprechen.
Die Autor:innen dieser Studie kamen zu dem Schluss, dass Upadacitinib gemessen an einer niedrigen Krankheitsaktivität (LDA) gemäß ASDAS am wirksamsten war, und zwar sowohl in der TNFi-naiven als auch in der vorbehandelten Population. Sie mahnten jedoch Head-to-Head- und Real-World-Daten zur Validierung an.
Radiografische Progression aufhalten?
Ergäbe im vorgestellten hypothetischen Fall das MRT ein Knochenmarködem mit einer floriden Sakroiliitis und einer Spondylitis anterior, also auch in der Bildgebung eine Entzündung, müsste man mit der Patientin besprechen, wie sich die Progression und eine zukünftige Einschränkung in der körperlichen Konstitution aufhalten lässt.
Tatsächlich sei die radiografische Progression unter JAK und Biologika gering, führte Kiefer aus. Hierzu gebe es 10-Jahres-Daten für TNFα, 1- bis 4-Jahres-Daten für IL-17i (Secukinumab, Ixekizumab) und 2-Jahres-Daten für IL-17A/Fi (Bimekizumab) und JAKi.19–23 Auch der Head-to-Head-Vergleich zwischen dem TNFαi Adalimumab und dem IL-17i Secukinumab habe in der SURPASS-Studie über 2 Jahre eine niedrige Progressionsrate ohne signifikante Unterschiede zwischen den Studienarmen gezeigt.24 Zudem seien niedrige Progressionsraten unter Upadacitinib in einem Zeitraum von 2 Jahren beobachtet worden.25
Geduld gegen Progression: kontinuierliche Therapie mit biologischen DMARDs
Man habe zeigen können, dass eine kontinuierliche Behandlung mit biologischen DMARDs die radiologische Progression günstig beeinflusst. Dazu habe man eine Gruppe, die in den 2 Jahren vor Studienbeginn über mindestens 12 Monate einen TNFi erhalten habe, mit einer zweiten verglichen, für die das nicht gegolten hatte. Bei den Vorbehandelten sei die radiologische Progression signifikant geringer gewesen. Dies habe sich zwischen dem 2. und 4. Behandlungsjahr abgezeichnet.23 Man müsse also längerfristig kontinuierlich behandeln, um die radiografische Progression zu beeinflussen, betonte Kiefer.
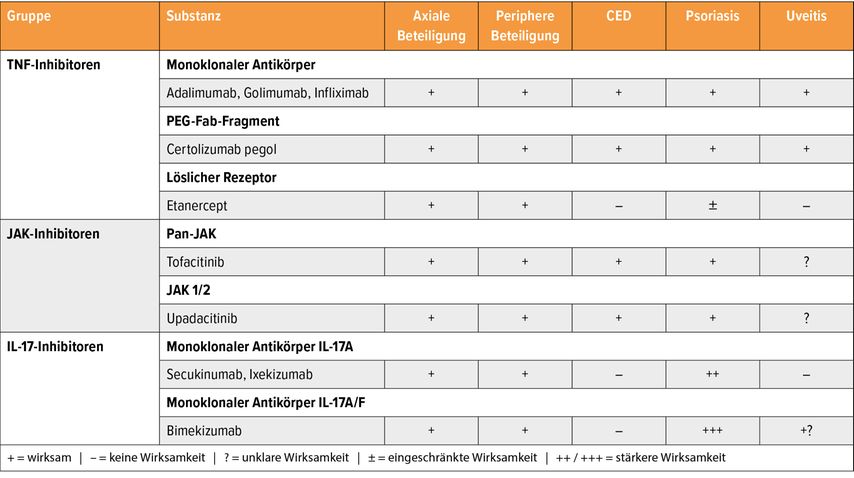
Therapie bei peripheren und extraartikulären Manifestationen
Je nachdem, ob eine periphere Arthritis, Daktylitis, Enthesitis, Uveitis oder chronisch-entzündliche Darmerkrankungen (CED) vorliegen, Haut und Nägel betroffen sind, seien verschiedene Wirkstoffe sinnvoll, so Kiefer. Er zeigte eine anlässlich des EULAR 2023 präsentierte, jetzt aktualisierte Übersicht (Tab. 1).26 Tatsächlich sei die Inzidenz der anterioren Uveitis bei Menschen mit axSpA in einer aktuellen Network-Metaanalyse unter allen b- und ts-DMARDs geringer gewesen als unter Placebo, möglicherweise mit einem leichten Vorteil für die TNF-Antikörper.27
Tab. 1: Wirksamkeit verschiedener TNF-, JAK- und IL-17-Inhibitoren auf periphere und extraartikuläre axSpA-Manifestationen. Modifiziert nach van der Heijde, EULAR 202327, 28, 30
Leitliniengerechter Therapieeinstieg
Wenn in der rheumatologischen Praxis ein ASDAS-Wert ≥2,1 gemessen und einer Therapie zugestimmt werde, könne man die Patientin oder den Patienten mit einem TNF-, IL-17- oder JAK-Inhibitor behandeln, ein TNFi oder IL-17i seien der übliche Einstieg, führte Kiefer weiter aus. Falls eine signifikante Schuppenflechte im Vordergrund stehe, sei möglicherweise ein IL-17i vorzuziehen, bei Uveitis oder einer aktiven entzündlichen Darmerkrankung ein monoklonaler TNFα-Antikörper.28
Komorbiditäten schließen manche Therapien aus
Je nach bestehender Komorbidität seien einzelne Wirkstoffe möglicherweise weniger empfehlenswert, warnte Kiefer und präzisierte für:
-
Tuberkulose: eher kein TNFi oder JAKi, möglicherweise IL-17i, jedoch nicht über TH1
-
Kardiovaskuläre Erkrankungen: eher kein JAKi, möglicherweise TNFi
-
Maligne Erkrankungen: eher kein JAKi
-
Pilzinfektionen (Candida): eher kein IL-17i
-
Herpes-zoster-Infektionen: eher kein JAKi
-
Demyelinisierende Erkrankungen: eher kein TNFi
Am Ball bleiben: Drug-Survival-Raten
In einer axSpA-Real-World-Kohorte habe das mittlere Drug Survival bei 31 vs. 25 vs. 18 Monate für TNFi, IL-17i und JAKi gelegen, die entsprechenden 2-Jahres-Drug-Survival-Raten bei 79,6 vs. 72,6 vs. 62,8%. Sie schienen einen möglichen Vorteil für TNFi auszuweisen, so Kiefer. Tatsächlich sei jedoch TNFi offenbar häufiger als Erstlinientherapie und bei Menschen mit einer geringeren Krankheitsaktivität eingesetzt worden.29 Auch die Wirksamkeit der TNFi-Zweit- und Drittlinientherapie und die Gründe für eine Beendigung seien untersucht worden. Die Daten aus 12 europäischen Datenbanken hätten gezeigt, dass die 12-Monats-Retentionsraten für TNFi-Zweit- und Drittlinientherapien vergleichbar waren (71%). Eine inaktive Erkrankung (ID: ASDAS <1,3) über 6 Monate hätten 23% in der Zweit- und 16% in der Drittlinientherapie erzielt. Eine ID sei häufiger erreicht worden, wenn die vorherige TNFi-Therapie aufgrund von Nebenwirkungen und nicht wegen eines Wirkverlusts abgebrochen worden war.30
Wie sich ein TNFi-Tapering auswirkt, wurde bei axSpA-Erkrankten unter Certolizumab untersucht, berichtete Kiefer. In der Erhaltungsphase der Studie hätten Teilnehmende mit ausreichend langer Remission entweder Certolizumab in der ursprünglichen Dosis (200mg Q2W), in der halbierten Dosis (200mg Q4W) oder Placebo erhalten. Beide Verumgruppen hätten ein signifikant längeres schubfreies Intervall gehabt als die Placebogruppe, und zwar sowohl bei r-axSpA (84/82/18%) als auch bei nr-axSpA (83/76/23%). Die Odds Ratio für das Ausbleiben eines Schubs gegenüber Placebo lag zwischen 22 und 10.31 Die Therapie (reduziert) weiterzuführen, senke also signifikant die Gefahr eines Schubs, der in der Studie als ASDAS-Wert ≥2,1 in 2 konsekutiven Visiten oder ≥3,5 bei einer Visite definiert war.32
Abb. 1: Applikationsformen und Halbwertszeiten. Erhaltungsdosierung nach ggf. notwendiger Aufsättigungsphase
Individuelle Parameter: Spritzenangst und Schwangerschaft
Läge eine Angst vor Spritzen vor, könnten alternative Applikationsformen oder -schemata mit höheren Halbwertszeiten Erleichterung schaffen. Zur Behandlung schwangerer axSpA-Patientinnen seien im Rahmen des EULAR-Kongresses 2024 folgende Erkenntnisse präsentiert worden:
-
Sulfasalazin werde weithin als mit einer Schwangerschaft kompatibel beurteilt.
-
NSAR sollten nach der 28. Schwangerschaftswoche abgesetzt werden.
-
Alle TNFi-bDMARDs könnten während der Schwangerschaft eingesetzt werden.
-
IL-17Ai (Ixekizumab, Secukinumab) dürften eingesetzt werden, falls notwendig.
-
JAKi sollten vermieden werden.33
Quelle:
„Targeted therapies 2024 in der axSpA“, Vortrag von Dr. David Kiefer, Herne, im Rahmen der Session „Axiale Spondyloarthritis – offene Fragen in Diagnostik, Klassifikation und Therapie“ anlässlich des Deutschen Rheumatologie-Kongresses am 19. September 2024 in Düsseldorf
Literatur:
1 Braun J et al.: Treatment of active ankylosing spondylitis with infliximab: a randomised controlled multicentre trial. Lancet 2002; 359(9313): 1187-93 2 Davis JC Jr et al.: Recombinant human tumor necrosis factor receptor (etanercept) for treating ankylosing spondylitis: a randomized, controlled trial. Arthritis Rheum 2003; 48(11): 3230-6 3 van der Heijde D et al.: Efficacy and safety of adalimumab in patients with ankylosing spondylitis: results of a multicenter, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2006; 54(7): 2136-46 4 Landewé R et al.: Efficacy of certolizumab pegol on signs and symptoms of axial spondyloarthritis including ankylosing spondylitis: 24-week results of a double-blind randomised placebo-controlled Phase 3 study. Ann Rheum Dis 2014; 73(1): 39-47 5 Inman RD et al.: Efficacy and safety of golimumab in patients with ankylosing spondylitis: results of a randomized, double-blind, placebo-controlled, phase III trial. Arthritis Rheum 2008; 58(11): 3402-12 6 Baeten D et al.: Secukinumab, an interleukin-17A inhibitor, in ankylosing spondylitis. N Engl J Med 2015; 373(26): 2534-48 7 Dougados M et al.: Efficacy and safety of ixekizumab through 52 weeks in two phase 3, randomised, controlled clinical trials in patients with active radiographic axial spondyloarthritis (COAST-V and COAST-W). Ann Rheum Dis 2020; 79(2): 176-85 8 van der Heijde D et al.: Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT-AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. Lancet 2019; 394(10124): 2108-17 9 van der Heijde D et al.: Tofacitinib in patients with ankylosing spondylitis: aphase II, 16-week, randomised, placebo-controlled, dose-ranging study. Ann Rheum Dis 2017; 76(8): 1340-7 10 Baraliakos X et al.: Bimekizumab treatment in patients with active axial spondyloarthritis: 52-week efficacy and safety from the randomised parallel phase 3 BE MOBILE 1 and BE MOBILE 2 studies. Ann Rheum Dis 2024; 83(2): 199-213 11 Dougados M et al.: Arthritis Rheumatol 2014; 66: 2091-102 12 Sieper J et al.: Ann Rheum Dis 2013; 72: 815-822 13 van der Heijde D et al.: Symptomatic efficacy of etanercept and its effects on objective signs of inflammation in early nonradiographic axial spondyloarthritis: a multicenter, randomized, double-blind, placebo-controlled trial. Rheumatology (Oxford) 2017; 56: 1498-509 14 Sieper J et al.: A randomized, double-blind, placebo-controlled, sixteen-week study of subcutaneous golimumab in patients with active nonradiographic axial spondyloarthritis. Arthritis Rheumatol 2015; 67(10): 2702-12 15 Deodhar A et al.: Ixekizumab for patients with non-radiographic axial spondyloarthritis (COAST-X): a randomised, placebo-controlled trial. Lancet 2020; 395(10217): 53-64 16 Braun J et al.: Secukinumab in non-radiographic axial spondyloarthritis: subgroup analysis based on key baseline characteristics from a randomized phase III study, PREVENT. Arthritis Res Ther 2021; 23(1): 231 17 Deodhar A et al.: Upadacitinib for the treatment of active non-radiographic axial spondyloarthritis (SELECT-AXIS 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2022; 400(10349): 369-79 18 Baraliakos X et al.: Comparative efficacy of advanced therapies in the treatment of radiographic axial spondyloarthritis or ankylosing spondylitis as evaluated by the ASDAS low disease activity criteria. Rheumatol Ther 2024; 11(4): 989-99 19 Braun J et al.: Secukinumab shows sustained efficacy and low structural progression in ankylosing spondylitis: 4-year results from the MEASURE 1 study. Rheumatology (Oxford) 2019; 58(5): 859-68 20 van der Heijde D et al.: Spinal radiographic progression and predictors of progression in patients with radiographic axial spondyloarthritis receiving ixekizumab over 2 years. J Rheumatol 2022; 49(3): 265-73 21 Smolen JS et al.: Treating spondyloarthritis, including ankylosing spondylitis and psoriatic arthritis, to target: recommendations of an international task force. Ann Rheum Dis 2014; 73(1): 6-16 22 Baraliakos X et al.: EULAR 2024; Abstr. #LBA000323 Torgutalp M et al.: Treatment with tumour necrosis factor inhibitors is associated with a time-shifted retardation of radiographic spinal progression in patients with axial spondyloarthritis. Ann Rheum Dis 2022; 81: 1252-9 24 Baraliakos X et al.: Effect of secukinumab versus adalimumab biosimilar on radiographic progression in patients with radiographic axial spondyloarthritis: results from a head-to-head randomized phase IIIb study. Arthritis Rheumatol 2024; 76: 1278-87 25 van der Heijde D et al.: Arthritis Rheumatol 2021; 73(Suppl 9): ACR convergence 2021 abstract supplement. Abstr 0924 26 van der Heijde D: Management of axial and peripheral spondyloarthritis in 2023. Vortrag anlässlich des EULAR 2023 27 Bechman K et al.: Incidence of uveitis in patients with axial spondylarthritis treated with biologics or targeted synthetics: a systematic review and network meta-analysis. Arthritis Rheum 2024; 76: 704-14 28 Ramiro S et al.: ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis 2023; 82(1): 19-34 29 Strunz PP et al.: Analysis of the shorter drug survival times for Janus kinase inhibitors and interleukin-17 inhibitors compared with tumor necrosis factor inhibitors in a real-world cohort of axial spondyloarthritis patients - a retrospective analysis from the RHADAR network. Rheumatol Int 2024; 44: 2057-66 30 Linde L et al.: Second and third TNF inhibitors in European patients with axial spondyloarthritis: effectiveness and impact of the reason for switching. Rheumatology (Oxford) 2024; 63(7): 1882-92 31 Landewé R et al.: Maintenance of clinical remission in early axial spondyloarthritis following certolizumab pegol dose reduction. Ann Rheum Dis 2020; 79(7): 920-8 32 Förger F et al.: AB1439. Ann Rheum Dis 2024; 83: 2075-6 33 Webers C et al.: Efficacy and safety of biological DMARDs: a systematic literature review informing the 2022 update of the ASAS-EULAR recommendations for the management of axial spondyloarthritis. Ann Rheum Dis 2023; 82: 130-41
Das könnte Sie auch interessieren:
Neutralisierende Antikörper: wenn Biologika aus dem Plasma verschwinden
Unter Therapie mit Biologika kommt es häufig zur Bildung sogenannter neutralisierender Antikörper, die an die therapeutischen Antikörper binden und deren Wirkung vollständig ...
Vermehrt auch in Österreich: genetische Hämoglobinopathien
Angesichts der aktuellen Migrationsbewegungen in und um Europa besteht vermehrt die Möglichkeit, im klinischen Alltag mit in Mitteleuropa bisher sehr seltenen genetischen Erkrankungen ...
ACR 2024: klinische Studien und das Placeborätsel
Zwischen 15. und 19. November fand in Washington die jährliche Convergence des American College of Rheumatology (ACR) statt. Im Rahmen der Jahrestagung der Österreichischen Gesellschaft ...