Das Insulinom: ein neurologisches Chamäleon
Autor:innen:
Dr. med. Svenja Leibnitz
Prof. Dr. med. Emanuel Christ
Klinik für Endokrinologie, Diabetologie & Metabolismus
Universitätsspital Basel
E-Mail: svenja.leibnitz@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Durch seine Seltenheit und die Vielzahl unspezifischer Symptome gestaltet sich die Diagnose eines Insulinoms als besonders herausfordernd. Trotz des hohen Aufwands und der Belastung für die Patienten bleibt der 72h-Fastentest nach wie vor der diagnostische Goldstandard. In den letzten Jahren wurden jedoch vielversprechende Fortschritte in der Lokalisationsdiagnostik benigner sowie in der Therapie fortgeschrittener maligner Insulinome erzielt.
Keypoints
-
Bei Verdacht auf ein Insulinom bleibt der 72-Stunden-Fastentest der diagnostische Goldstandard. Bei einer symptomatischen Hypoglykämie (BZ <2,5mmol/l) sind folgende biochemische Abklärungen erforderlich: Insulin, C-Peptid, Pro-Insulin, β-Hydroxybutyrat und Sulfonylharnstoff-Screening.
-
GLP-1-Rezeptoren sind bei 93% der lokalisierten Insulinome überexprimiert, wodurch die GLP-1R-PET/CT anderen Bildgebungsverfahren überlegen ist und eine hochsensitive sowie spezifische Lokalisation kleiner benigner Insulinome ermöglicht.
-
Die chirurgische Resektion stellt den Goldstandard in der Behandlung lokalisierter Insulinome dar. Bei malignen Insulinomen mit refraktären Hypoglykämien zeigen sowohl die Peptidrezeptor-Radionuklidtherapie (PRRT) mit 177Lu-DOTATATE als auch der monoklonale Insulinrezeptor-Antikörper RZ358 vielversprechende Ergebnisse.
Bei Menschen mit Diabetes gilt ein Blutzuckerwert von <4mmol/l als Grenze für eine Hypoglykämie. Für solche ohne Diabetes hingegen existiert keine einheitliche Definition. Die ENETS-Leitlinien (2023) empfehlen während eines 72-Stunden-Fastentests einen Grenzwert von 2,5mmol/l, während die klinischen Praxisleitlinien der Endocrine Society die Schwelle bei <3mmol/l ansetzen. In der klinischen Routine wird häufig ein Grenzwert von 2,8mmol/l angewendet.1 Diese Unterschiede verdeutlichen, wie herausfordernd es ist, eine Hypoglykämie bei Menschen ohne Diabetes präzise zu definieren, und unterstreichen die Notwendigkeit, sie stets im klinischen Kontext zu beurteilen.
Whipple-Trias: Eckpfeiler der Hypoglykämie-Abklärung
Keine Abklärung einer Hypoglykämie ist vollständig ohne die Whipple-Trias. Diese umfasst drei wesentliche Kriterien:
-
Symptome, die mit einer Hypoglykämie vereinbar sind,
-
dokumentierte niedrige Blutglukosewerte,
-
Besserung der Symptome nach Kohlenhydratzufuhr.
Liegt die Whipple-Trias vor, sollten die Umstände der Symptome zunächst genauer betrachtet werden: Treten sie im Fastenzustand (v.a. nachts und frühmorgens) oder nach Mahlzeiten auf? Auch eine Überprüfung von Medikamenteneinnahmen und Alkoholkonsum ist essenziell. Medikamente wie Insulin, Glinide und Sulfonylharnstoffe, aber auch weniger bekannte Substanzen wie Antimalariamittel, nichtselektive Betablocker oder Lithium, können Hypoglykämien auslösen. Weitere Ursachen wie postbariatrische Zustände oder autoimmune Erkrankungen wie das Hirata-Syndrom sollten ebenfalls berücksichtigt werden. Während für die erstgenannten Ursachen eine ausführliche Anamnese entscheidend ist, sind bei Autoimmunerkrankungen die Bestimmung der Insulinspiegel (sehr hohe Konzentrationen) sowie die Messung von Insulin-Antikörpern hilfreich. Zudem ist es wichtig, andere mögliche Erkrankungen wie Nebenniereninsuffizienz, Leber- oder Nierenversagen sowie konsumierende Erkrankungen auszuschliessen.
Das «neurologische Chamäleon»
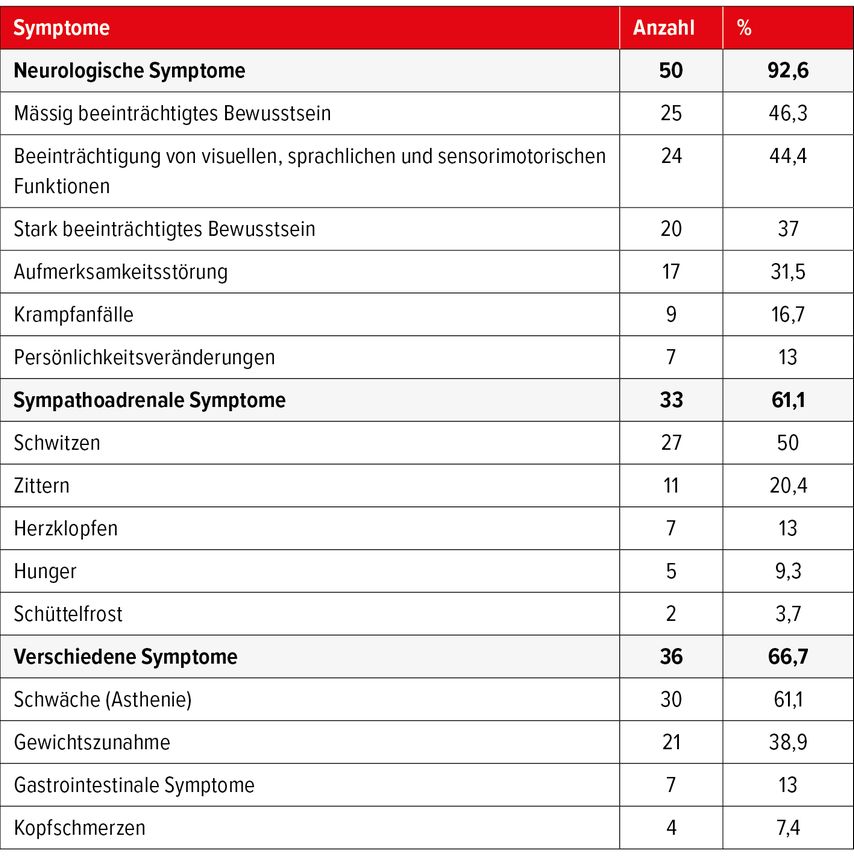
Aufgrund der Vielfältigkeit autonomer und neuroglykopenischer Symptome wird die Hypoglykämie als das «neurologische Chamäleon» bezeichnet. Eine Beobachtungsstudie aus Basel (2018) mit 54 Patienten mit bestätigter endogener hyperinsulinämischer Hypoglykämie konnte zeigen, dass fast 93% der Betroffenen neurologische Symptome erlebten (Tab. 1).2 Zu den häufigsten zählten moderate Bewusstseinseinschränkungen sowie Seh- und Sprachstörungen. Symptome des sympathoadrenalen Systems traten bei 61,1% der Patienten auf, wobei Schwitzen am häufigsten berichtet wurde. Mehr als die Hälfte der Patienten gab zudem eine deutliche Gewichtszunahme in den letzten Jahren an.2 Diese breite Symptomatik führt dazu, dass es im Durchschnitt mindestens 12 Monate, oft sogar länger, bis zur endgültigen Diagnosestellung dauert. Während dieser Zeit können autonome Symptome durch eine zunehmende Unempfindlichkeit gegenüber Hypoglykämien sogar verschwinden.
Tab. 1: Übersicht der Hauptsymptome von 54 Patienten mit bestätigter endogener hyperinsulinämischer Hypoglykämie (übersetzt nach Valente et al. 2018)2
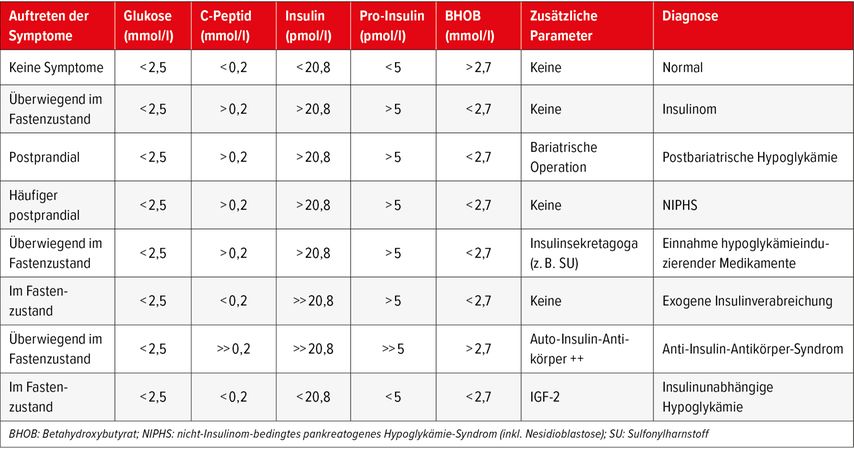
Treten die Symptome während des Fastens auf, gilt der 72-Stunden-Fastentest als diagnostischer Goldstandard. Studien zeigen, dass bei 95% der betroffenen Patienten eine signifikante Hypoglykämie bereits nach 48 Stunden auftritt.3 Dennoch ist ein vollständiger 72-Stunden-Test notwendig, um eine endogene Insulinsekretion sicher auszuschliessen. Während des überwachten Fastentests werden in regelmässigen Abständen Blutproben entnommen, bis eine symptomatische Hypoglykämie nachweisbar ist. In der Regel wird ein Glukosewert unter 2,5mmol/l angestrebt.4 Bei Auftreten einer Hypoglykämie sind folgende biochemische Parameter für die Diagnose erforderlich: Insulin, C-Peptid sowie, wenn möglich, Proinsulin und β-Hydroxybutyrat (BHOB) (Tab. 2). Bei Verdacht auf eine selbst herbeigeführte Hypoglykämie wird empfohlen, auf orale Antidiabetika wie Sulfonylharnstoffe und Glinide zu testen. Zur Beurteilung von kognitiven Funktionsstörungen hat sich der Mini-Mental-Status-Test (MMST) in regelmässigen Abständen als nützlich erwiesen, um die Neurokognition standardisiert zu erfassen.
Tab. 2: Klinische und biochemische Kriterien bei Patienten mit nichtdiabetischer Hypoglykämie (übersetzt und adaptiert nach Hofland et al. 2023)4
GLP-1R-PET in der Diagnostik benigner Insulinome
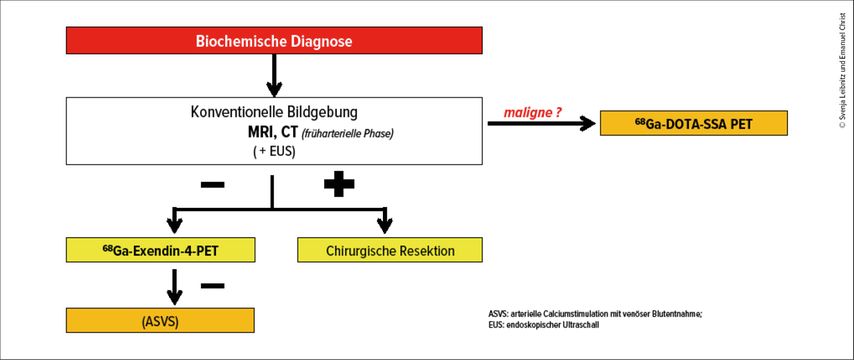
Nach biochemischer Bestätigung eines Insulinoms erfolgt die Lokalisationsdiagnostik. Der diagnostische Algorithmus beginnt in der Regel mit konventioneller Bildgebung wie MRI oder multiphasischer CT mit früharterieller Phase, um die typischerweise hypervaskularisierten Läsionen gut zu erkennen. Ergänzend dazu bietet der endoskopische Ultraschall (EUS) eine hohe Sensitivität, da er Läsionen ab 2–5mm Grösse aufspüren kann. Allerdings ist der EUS untersucherabhängig, invasiv und bietet keine vollständige Darstellung des Pankreasschwanzes. Leider werden mit der konventionellen Bildgebung nur circa zwei Drittel der benignen Läsionen diagnostiziert, da diese üblicherweise nur zwischen 5–10mm gross sind.5
Wenn diese Methoden keine eindeutige Lokalisierung ermöglichen, wird die GLP-1R-Bildgebung empfohlen (Abb. 1). Die Glucagon-like-Peptide-1-Rezeptoren sind bei 93% der lokalisierten Insulinome überexprimiert, was die GLP-1R-PET/CT anderen Bildgebungsverfahren deutlich überlegen macht.5 Dabei wird ein spezifischer Ligand wie Exendin-4 verwendet, der mit einem Radionuklid markiert ist, beispielsweise 68Ga für die PET oder 111In für die SPECT. Bei Patienten mit negativer konventioneller Bildgebung zeigt die 68Ga-Exendin-4-PET eine Detektionsrate von 74%, was in dieser besonders schwierigen Patientengruppe sehr erfolgversprechend ist. Falls die GLP-1R-Bildgebung nicht verfügbar ist, können alternative Verfahren wie die 68Ga-DOTA-SSA- oder 18F-DOPA-PET eingesetzt werden. In seltenen Fällen, in denen ein Insulinom biochemisch bestätigt wurde, aber auch die funktionelle Bildgebung keine Lokalisation erlaubt, kann der arterielle Kalziumstimulationstest durchgeführt werden. Dabei wird jedoch nur das Versorgungsgebiet der entsprechenden Arterie identifiziert, nicht aber die exakte Position des Tumors.
Für die Diagnostik metastasierter Insulinome, die etwa 10% aller Fälle ausmachen, ist die GLP-1R-Bildgebung weniger geeignet, da diese Tumoren häufig keine GLP-1-Rezeptoren exprimieren – nur bei 36% der Patienten sind sie nachweisbar.5 Stattdessen exprimieren metastasierte Insulinome häufig Somatostatinrezeptoren (SSTR2), was die SSTR-Bildgebung zu einer wichtigen Alternative macht.5 Diese Methode ermöglicht nicht nur die Lokalisation der Tumoren, sondern bildet auch die Grundlage für eine Peptidrezeptor-Radionuklidtherapie (PRRT) mit 177Lu-DOTATOC oder 177Lu-DOTATATE.
Neue Therapieoptionen bei malignen Insulinomen
Die chirurgische Resektion bleibt der Goldstandard zur Behandlung lokalisierter Insulinome. Bei Patienten mit fortgeschrittenen Erkrankungen, wie inoperablen oder metastasierten Insulinomen, ist jedoch ein multimodaler Therapieansatz erforderlich. Neben der Monitorisierung mittels kontinuierlicher subkutaner Blutzuckermessung (CGMS) wird therapeutisch zunächst eine spezielle Diät mit komplexen Kohlenhydraten empfohlen, während bei akuten hypoglykämischen Episoden die orale oder intravenöse Zufuhr von Glukose essenziell ist.
Als Erstlinientherapie bei fortgeschrittenen Insulinomen wird Diazoxid (50–600mg täglich) eingesetzt, welches die Insulinsekretion durch Blockade ATP-abhängiger Kaliumkanäle in den β-Zellen des Pankreas hemmt. Obwohl diese Therapie häufig effektiv ist, treten bei bis zu 80% der Patienten dosislimitierende Nebenwirkungen wie Hirsutismus bei Frauen, Flüssigkeitsretention und Ödeme auf.4 Alternativ oder ergänzend können Somatostatin-Analoga (SSA) der ersten Generation verwendet werden. Diese binden mit hoher Affinität an die Somatostatin-Rezeptoren 2 und 5, hemmen die Insulinsekretion und haben zudem antiproliferative Eigenschaften. Allerdings besteht bei Insulinomen ohne SSTR2-Expression das Risiko für eine paradoxe Hypoglykämie durch gleichzeitige Inhibition des Glukagons durch SSA.4
Bei fortgeschrittenen Krankheitsstadien, insbesondere bei SSA-refraktärer Symptomatik und Tumorprogression, zeigen die Peptidrezeptor-Radionuklidtherapie (PRRT) mit 177Lu-DOTATATE sowie der mTOR-Inhibitor Everolimus vielversprechende Ergebnisse. Die PRRT richtet sich gezielt gegen Tumorzellen mit SSTR2-Expression und kann die Symptomatik hypoglykämischer Patienten signifikant verbessern. Die Effektivität der PRRT wurde in einer retrospektiven Langzeitstudie mit 26 Patienten untersucht, die an Insulinom-assoziierter Hypoglykämie litten. Bei 81% der Patienten konnte eine signifikante Reduktion des Hypoglykämie-Scores erzielt werden. Darüber hinaus ermöglichte die Therapie bei 58% der Patienten eine Reduktion der antihypoglykämischen Medikation.6
Ein innovativer Ansatz zur Behandlung refraktärer Hypoglykämien wurde kürzlich im New England Journal of Medicine (August 2023) beschrieben.7 Die Studie stellt den Einsatz von RZ358 vor, einem humanisierten monoklonalen Antikörper, der gezielt den Insulinrezeptor moduliert. In einem Fallbericht wurde ein 55-jähriger Patient mit metastasiertem Insulinom und einer MEN1-Mutation behandelt, der trotz intensiver Therapien, einschliesslich PRRT, weiterhin unter lebensbedrohlichen Hypoglykämien litt. RZ358 wirkt, indem es die Bindung und Signalübertragung von Insulin reduziert, was zu einer signifikanten Verbesserung der Blutzuckerkontrolle führt. Bereits nach zwei Infusionen waren die Blutzuckerwerte des Patienten stabil, und in den darauffolgenden neun Monaten traten keine schweren Hypoglykämien mehr auf. Dieser Fall verdeutlicht das Potenzial von RZ358 als vielversprechende Therapieoption für refraktäre Hypoglykämien, insbesondere bei malignen Insulinomen.
Literatur:
1 Munir A: Approach to the Patient with Hypoglycemia. In: Endocrine Society (ed.) Endocrine Case Management: Meet The Professor 2024. Endocrine Society 2024: 209-18 2 Valente L et al.: Clinical presentation of 54 patients with endogenous hyperinsulinaemic hypoglycaemia: A neurological chameleon (observational study). Swiss Med Wkly 2018; 148: 1-5 3 Service FJ, Natt N: The prolonged fast. J Clin Endocrinol Metab 2000; 85: 3973-4 4 Hofland J et al.: European Neuroendocrine Tumor Society 2023 guidance paper for functioning pancreatic neuroendocrine tumour syndromes. J Neuroendocrinol. 2023; 35: 1-19 5 Christ E et al.: Innovative imaging of insulinoma: The end of sampling? A review. Endocr Relat Cancer 2020; 27: R79-92 6 Friebe L et al.: Peptide receptor radionuclide therapy is effective for clinical control of symptomatic metastatic insulinoma: A long-term retrospective analysis. J Nucl Med 2024; 65: 228-35 7 Osataphan S et al.: Anti–insulin receptor antibody for malignant insulinoma and refractory hypoglycemia. N Engl J Med 2023; 389: 767-9
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...