Gastroduodenale Ulkuskrankheit
Autoren:
Dr. med. Matthias Sauter
Leiter Gastroenterologie, Leitender Arzt
med. pract. Anne Rospert
Oberärztin mbF
Klinik für Innere Medizin
Spital Zollikerberg
8125 Zollikerberg
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die gastroduodenale Ulkuskrankheit gehört zu den häufigsten Krankheitsbildern in der Gastroenterologie; Ulzera gehören mit 30–70% auch zu den häufigsten Ursachen einer oberen gastro-intestinalen (GI) Blutung. Die Risikofaktoren für die Entstehung von Ulzera sind in der Gesellschaft weit verbreitet. Die Leitlinien der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselerkrankungen (DGVS) für die Ulkuskrankheit wurden 2022 aktualisiert.1 Die vorliegende Übersichtsarbeit orientiert sich in grossen Teilen daran. Für das Management der akuten Ulkusblutung stehen ebenfalls verschiedene Leitlinien zur Verfügung, u.a. die aktuellen Guidelines der European Society of Gastrointestinal Endoscopy (ESGE) von 2021.2
Keypoints
-
Ulzera des Magens und Dünndarms stellen die häufigste Ursache für eine obere gastrointestinale Blutung dar.
-
Die meisten Ulzera sind durch eine Infektion mit Helicobacter pylori (HP) oder NSAR-Einnahme bedingt. Andere Ursachen sind selten.
-
Es stehen verschiedene Methoden der endoskopischen mechanischen Blutstillung und auch Rescue-Therapien zur Verfügung.
-
Die neuen deutschen Guidelines empfehlen als Erstlinientherapie für die HP-Eradikation eine Bismut-haltige Quadrupeltherapie. Nach dem ersten Therapieversagen soll direkt eine Resistenzprüfung durchgeführt werden.
-
In einigen Fällen ist eine prophylaktische Suche nach einer HP-Infektion oder auch eine prophylaktische Säuresuppression mit PPI sinnvoll. Dies sollte gut mit dem Patienten diskutiert werden.
Die häufigsten Ursachen von Ulzera des Magens und Duodenums sind weiterhin die Infektion mit Helicobacter pylori (HP) und die NSAR-Einnahme. Die Inzidenz und Prävalenz der Ulkuskrankheit korrelieren auch stark mit der Helicobacter-Prävalenz in der Bevölkerung des Landes. So liegt das Risiko für das Auftreten eines Ulkus des Magens oder Duodenums bei HP-positiven Menschen bei circa 1% pro Jahr, was 5- bis 10-mal höher ist als bei HP-negativen. Insgesamt sind Ulkuserkrankungen seltener geworden, analog dem Rückgang der HP-Prävalenz, wobei es gleichzeitig zu einer Zunahme von NSAR-assoziierten Ulzera gekommen ist (durch vermehrte NSAR-Einnahme und das zunehmende Alter der Bevölkerung). Die HP-Prävalenz ist in Europa sehr unterschiedlich ausgeprägt, in Portugal ist sie beispielsweise sehr hoch (85%), in Deutschland (35%) oder der Schweiz (19%) deutlich niedriger. Zudem hängt die Häufigkeit auch von der ethnischen Herkunft, dem sozioökonomischen Status und den Hygienebedingungen ab.
Weitere Ursachen für das Auftreten eines Ulkus bzw. einer Ulkuskomplikation sind in Tabelle 1 zusammengefasst. Wichtig sind:
-
Medikamente wie Kortikosteroide, Thrombozytenaggregationshemmer (z.B. Clopidogrel) und orale Antikoagulanzien (OAK), wobei das Risiko hier v.a. in Zusammenhang mit NSAR besteht bzw. dadurch vervielfacht wird. Ein weitere Substanzklasse, bei der in den letzten Jahren ein Zusammenhang mit GI Blutungen festgestellt wurde, sind SSRI (selektive Serotonin-Wiederaufnahme-Hemmer).
-
Komorbiditäten wie Niereninsuffizienz/Lebererkrankung oder eine akute schwere Erkrankung mit Betreuung auf einer Intensivstation oder andere Risikofaktoren wie Rauchen und Alkoholkonsum.
Klinik
Man unterscheidet unkomplizierte von komplizierten Ulzera, d.h. solchen mit Auftreten einer Blutung, einer Perforation (offen oder gedeckt), einer Fistulierung zu anderen Hohlorganen oder einer Stenose. Die Inzidenz von komplizierten Ulzera ist in den letzten Jahren rückläufig (wohl analog zum Rückgang der HP-Prävalenz).
Schätzungsweise 50–70% der Patienten mit Ulzera sind asymptomatisch, wobei im weiteren Verlauf Beschwerden oder Komplikationen wie Blutungen oder Perforationen auftreten können. 40–80% der Patienten mit einer Ulkusblutung hatten vor dem akuten Ereignis keine dyspeptischen Beschwerden oder andere Symptome, die ein Ulkus angekündigt hätten.
Epigastrische Schmerzen oder epigastrisches Unwohlsein ist das häufigste Symptom, gelegentlich mit Ausstrahlung in den linken Oberbauch oder seltener auch in den Rücken. Die klassische Ulkussymptomatik (die im Alltag aber oft nicht so typisch vorhanden ist) besteht beim Duodenalulkus aus Schmerzen 5–7h postprandial mit einer Besserung nach Nahrungseinnahme, beim Magenulkus aus Schmerzen vor allem während und kurz nach der Mahlzeit. Dazu können weitere Symptome wie Völlegefühl, Übelkeit, frühes Sättigungsgefühl vorkommen.
Ulkusblutung: Die Ulkusblutung ist die häufigste Komplikation des Ulkus und präsentiert sich mit Meläna/Teerstuhl, Abdominalschmerzen, Übelkeit und in 20% mit Hämatemesis/Kaffeesatzerbrechen (v.a. beim Magenulkus; seltener auch beim Duodenalulkus möglich). Bei starken Blutungen kann auch eine Hämatochezie auftreten (einem Frischblutabgang ab ano muss also nicht zwingend eine Blutungsquelle im unteren GI-Trakt zugrunde liegen). Bei geringer Blutungsmenge kann sich eine Ulkusblutung auch nur durch eine Eisenmangelanämie manifestieren.
Gastroduodenale Obstruktion: Das Auftreten eines Ulkus in der Pylorusregion oder im Duodenum kann zu einer Stenose mit entsprechendem Völlegefühl und postprandialem Erbrechen führen.
Diagnostik
Der diagnostische Goldstandard ist weiterhin die Endoskopie, welche in Studien eine Sensitivität von ca. 90% hat und abhängig von der Lokalisation der Läsion und der Erfahrung des Endoskopeurs ist.
Die Differenzialdiagnose von Oberbauchschmerzen ist breit. Die genaue Anamnese und das Vorliegen von Alarmsymptomen entscheiden, ob primär eine Endoskopie oder primär eine probatorische Therapie oder eine andere Diagnostik durchgeführt wird. Die generelle Abklärung von Oberbauchschmerzen/Dyspepsie ist nicht Teil dieses Artikels und wird deshalb nur am Rande erwähnt (ein Update zu Refluxerkrankung und Barrett-Ösophagus ist in der Ausgabe 6/2022 dieser Zeitschrift oder unter www.universimed.com zu finden3).
Endoskopie
Wird eine obere Panendoskopie durchgeführt und wird ein Ulkus im Magen entdeckt, wird es nach der sogenannten Forrest-Klassifikation beurteilt (Abb. 1). Anhand des Stadiums kann das Risiko einer (Re-)Blutung abgeschätzt werden. Analog können formal auch Ulzera im Duodenum nach Forrest klassifiziert werden. Zudem wird einerseits nach Helicobacter pylori gesucht (mittels Biopsien aus dem Magen mit Histologie/HP-Schnelltest). Dies sollte auch dann erfolgen, wenn andere Risikofaktoren wie z.B. eine NSAR-Therapie in der Anamnese bestehen. Andererseits muss beurteilt werden, ob es sich um ein malignes Ulkus handeln könnte (für Beispiele von Ulzera siehe Abb. 2). Es werden ggf. Biopsien vom Ulkusrand entnommen, zudem sollte ein Ulkus im Magen prinzipiell eine endoskopische Abheilungskontrolle nach 4–8 Wochen nach sich ziehen, um eine Malignität definitiv auszuschliessen. Ulzera im Duodenum sind sehr selten maligne, hier wird individuell entschieden, ob eine Biopsie und eine endoskopische Nachkontrolle sinnvoll sind.
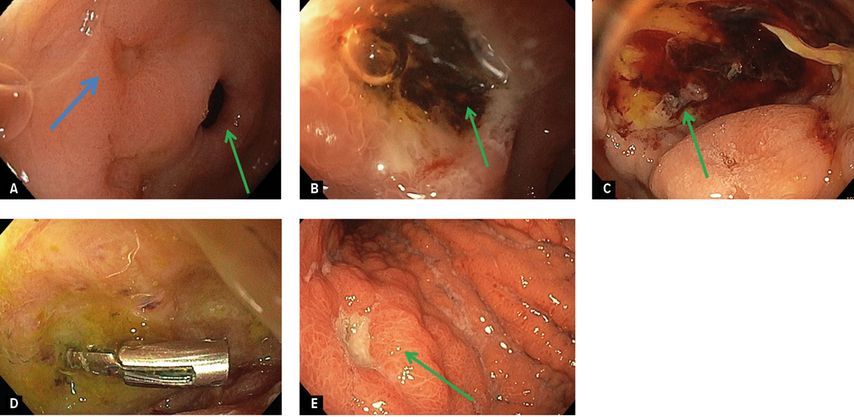
Abb. 2: Verschiedene Arten von Ulzera. A) Patient mit Dyspepsie. Kleines unkompliziertes Magenulkus fibrinbelegt (ForrestIII) präpylorisch auf der Seite der kleinen Kurvatur (blauer Pfeil Ulkus, grüner Pfeil Pylorus); B) Patient mit Meläna. Ulkus in der proximalen Pars II duodeni mit grossem Hämatinfleck (grüner Pfeil; formal ForrestIIc); C) Patient mit hämodynamisch relevanter GI Blutung mit Hämatochezie. Grosses Ulkus im Bulbus duodeni mit Koagel und kleinem Gefässstumpf (grüner Pfeil; formal Forrest IIa/b); D) gleiches Ulkus wie Bild C nach 48h mit Hämoclip in situ; E) Patient mit Eisenmangelanämie. Grosses Ulkus im Magenkorpus ventral liegend, mit erhöhtem Randwall und umliegend vergröberter Magenschleimhaut, Histologie von Ulkusrand und umgebender Magenschleimhaut mit Nachweis eines ulzerierten teils tubulär, teil wenig kohäsiv gewachsenem Adenokarzinom mit Siegelringzellen (gemischter Typ nach Laurén)
Akute Ulkusblutung/endoskopische Blutstillung
Tab. 2: «Glasgow-Blatchford bleeding score» zur Abschätzung des Mortalitätsrisikos; ein Score von 0 Punkten klassifiziert als «low risk», ≥1 Punkt als «high risk», mit zunehmendem Risiko je höher die Punktzahl ist4 ( https://www.mdcalc.com/calc/518/glasgow-blatchford-bleeding-score-gbs#evidence )
Im Falle einer akuten GI Blutung können verschiedene Scores angewendet werden, um die Mortalität abzuschätzen, z.B. der «Glasgow-Blatchford bleeding score» (Tab. 2), bei welchem ein Score von 0 ein sehr niedriges Risiko einer 30-Tages-Mortalität darstellt, sodass Patienten mit einem Score von 0 Kandidaten für ein ambulantes Management sind.4
Im Falle einer aktiven Ulkusblutung wird als endoskopische Therapie eine Injektion von verdünntem Adrenalin in Kombination mit einer mechanischen Blutstillung durchgeführt.2 Zur mechanischen Blutstillung stehen verschiedene Methoden inklusive Hämoclips, Katheter mit bipolarer Elektrokoagulation (Gold Probe®) oder grosse Over-the-scope-Clips (OTSC®) zur Verfügung. Kann die Blutung damit nicht gestillt werden, können neuartige Pulversprays (Hemospray®) oder Gels (Purastat®) eingesetzt werden. Rescue-Therapien beinhalten angiografische Embolisationen und die Chirurgie.
Zusätzlich wird vor oder spätestens nach der Endoskopie eine Therapie mit Protonenpumpenhemmern (PPI) begonnen, entweder mittels Perfusor über 72h oder als Bolus i.v. mit anschliessender Umstellung auf eine orale Therapie je nach Verlauf. Gerinnungsaktive Substanzen werden je nach medizinischer Indikation und Schwere der Blutung pausiert oder bei hämodynamisch anhaltend instabilen Patienten falls möglich auch antagonisiert. Eine Aspirin-Therapie in sekundärpräventiver kardiovaskulärer Indikation sollte jedoch fortgesetzt werden.
Medikamentöse Therapie
Therapie bei Helicobacter pylori
Die Therapie eines HP-induzierten Ulkus besteht aus einer Kombination aus PPI und Antibiotika. Die Eradikationsrate beträgt auch im besten Fall mit guter Compliance leider nur circa 90%; zudem sind Resistenzen auf regelmässig eingesetzte Antibiotika häufig. Frühere Empfehlungen zur Erstlinientherapie richteten sich vor allem nach der Prävalenz der Clarithromycin-Resistenzrate in der Bevölkerung (> oder <20%). Das Vorliegen einer Clarithromycin-Resistenz reduziert den Eradikationserfolg einer Behandlung mit dieser Substanz um 30–60%. Faktoren, die den Eradikationserfolg zusätzlich beeinflussen, sind die Compliance (Weglassen von 10% der Tabletten reduziert den Therapieerfolg um 20–30%) und Nikotinkonsum.
Die neuen Guidelines der DGVS empfehlen als erste Therapie eine Bismut-haltige Quadrupeltherapie (Bismut, PPI plus zwei Antibiotika) für mindestens 10 Tage, mit der Argumentation, dass nur ungenügende Daten über die Clarithromycin-Resistenz bestehen.1 In der Schweiz entspricht dies einer Therapie mit Pylera®, welches neben Bismut auch Metronidazol und Tetracyclin enthält.
Es steht eine Vielzahl an alternativen Regimes (inkl. italienischer Tripeltherapie aus PPI, Metronidazol, Clarithromycin und französischer Tripeltherapie aus PPI, Amoxicillin, Clarithromycin) zur Verfügung.5
Ein relevanter Faktor, der die Therapieadhärenz der Eradikation reduziert, sind Antibiotika-assoziierte Nebenwirkungen wie Diarrhö. Es gibt einige Studien, die einen positiven Effekt einer gleichzeitigen (Off-Label-)Therapie z.B. mit Saccharomyces (Perenterol®) auf die Diarrhö zeigen, vor allem bei Kindern.
Eradikationskontrolle: Nach der antibiotischen Therapie eines HP-assoziierten Ulkus sollte eine Eradikationskontrolle durchgeführt werden.1 Wenn eine endoskopische Kontrolle notwendig ist, kann die Eradikationskontrolle während dieser Gastroskopie erfolgen. Alternativ kann sie auch nicht invasiv mittels Stuhlantigentest oder 13C-Atemtest durchgeführt werden. Diese Tests sind ähnlich sensitiv/spezifisch. Wichtig ist, den Test erst 4 Wochen nach beendeter Antibiotikatherapie und 2 Wochen nach Pausieren/Absetzen der PPI-Therapie durchzuführen, um eine optimale Treffsicherheit zu bekommen. Die Serologie im Blut ist zur Diagnostik nicht geeignet, da sie nach erfolgter Eradikation positiv bleiben kann.
Bei einem ersten Therapieversagen wird neuerdings direkt eine HP-Resistenztestung empfohlen mit anschliessender resistenzgerechter Therapie. Nach erfolgreicher Therapie ist die Reinfektionsrate in Industrieländern sehr niedrig. Die spontane Eradikation ohne Therapie wird bei Säuglingen und Kleinkindern beobachtet, ist danach aber sehr selten.
Idiopathische Ulzera
Bei einem HP-negativen Ulkus ohne NSAR-Anamnese sollte zuerst nochmals sorgfältig nach HP und ulzerogenen Medikamenten gesucht werden (unter Berücksichtigung der ggf. reduzierten Sensitivität der HP-Diagnostik, s.o.).6
Viele initial als idiopathisch beurteilte Ulzera können doch einer der beiden häufigsten Ursachen zugeordnet werden. Andernfalls sollte endoskopisch mittels Biopsien nach seltenen Infektionen (v.a. bei immunkompromittierten Patienten, s. auch Tab. 1), Malignität (Lymphom, Karzinom, GIST) und M. Crohn gesucht werden. Bei Ausschluss dieser Ursachen wird je nach Ausmass der Befunde ggf. auch nach anderen seltenen Ätiologien inkl. Gastrinom gesucht.
Bleibt das Ulkus idiopathisch und liegt eine Ulkuskomplikation vor, wird in der Regel eine PPI-Dauertherapie empfohlen.
Ulkusprophylaxe
Da die erwähnten Risikofaktoren für das Auftreten eines Ulkus bzw. einer Ulkuskomplikation in der Gesellschaft weit verbreitet sind, stellt sich die Frage nach einer Ulkusprophylaxe. Der Nutzen einer Prophylaxe muss gegen die potenziellen (Langzeit-)Nebenwirkungen von PPI abgewogen und mit dem Patienten diskutiert werden (vergleiche Artikel zur Refluxerkrankung in Leading Opinions Innere Medizin 6/2022).3
Eine mögliche Prophylaxe besteht einerseits in der Suche nach HP (und bei Nachweis der Eradikation) und andererseits in einer prophylaktischen PPI-Therapie.
Die neuen DGVS-Guidelines empfehlen die HP-Suche bei Patienten, bei denen sowohl ein Risikofaktor (positive Ulkusanamnese oder andere Komorbiditäten, s. Tab.1) als auch eine der folgenden Konstellationen vorliegen:
-
geplante Dauermedikation mit Aspirin, NSAR oder OAK
-
geplante Dauermedikation mit SSRI («Kann»-Empfehlung)
-
geplante PPI-Dauermedikation (s.u.)
Eine PPI-Dauertherapie kann bei HP-Positivität zu atrophischen Veränderungen der Magenkorpusschleimhaut und zu einer Korpus-dominanten HP-Gastritis führen, die ein Risikofaktor für ein Magenkarzinom darstellt. Wichtig ist, dass bei diesen Entscheidungen das Alter alleinnicht als Risikofaktor für ein Ulkus gewertet wird.
Prophylaktische PPI-Therapie
Eine prophylaktische PPI-Therapie sollte gut mit dem Patienten besprochen werden bezüglich Vor- und Nachteilen bzw. etwaigen Risiken (s.o.).
Die DGVS-Leitlinien empfehlen in unterschiedlicher Empfehlungsstärke eine prophylaktische PPI-Therapie in den folgenden Situationen:
-
Beginn einer Dauertherapie mit NSAR, Aspirin und anderen Thrombozytenaggregationshemmern (P2Y12-Inhibitoren, z.B. Clopidogrel), SSRI oder OAK bei Patienten mit einem in Tabelle 1 erwähnten weiteren Risikofaktor («Soll»-Empfehlung bei klassischen NSAR, «Sollte»-Empfehlung bei Coxiben), wobei das Alter alleine wiederum nicht als Risikofaktor zählt;
-
Beginn einer Medikation mit zwei gerinnungsaktiven Substanzen oder einer Kombination von SSRI plus NSAR oder ASS/P2Y12-Inhibitoren, OAK (unabhängig von anderen Risikofaktoren);
-
Auftreten einer gastroduodenalen Blutung unter NSAR, ASS, OAK, P2Y12-Inhibitoren (PPI-Therapie, bis Ulkus abgeheilt, danach erneute PPI-Therapie, sobald die Ulkus-ursächliche Therapie wieder begonnen werden muss).
Es wird sich zeigen, inwieweit diese neuen weitgreifenden Empfehlungen im klinischen Alltag durchgesetzt werden können.
Literatur:
1 Fischbach W et al.: Aktualisierte S2k-Leitlinie Helicobacter pylori und gastroduodenale Ulkuskrankheit der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). AWMF online 2022 2 Gralnek IM et al.: Endoscopic diagnosis and management of nonvariceal upper gastrointestinal hemorrhage (NVUGIH): European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2021. Endoscopy 2021; 53: 300-32 3 Sauter M: Management von Patientinnen und Patienten mit Refluxerkrankung und Barrett-Ösophagus. Leading Opinions Innere Medizin 2022; 6: 58-62 4 Blatchford O et al.: Acute upper gastrointestinal haemorrhage in west of Scotland: case ascertainment study. BMJ 1997; 315: 510-14 5 Malfertheiner P et al.: Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut 2022 6 McColl KE: How I manage H. pylori-negative, NSAID/aspirin-negative peptic ulcers. Am J Gastroenterol 2009; 104: 190-3
Das könnte Sie auch interessieren:
Neuste Entwicklungen in der Behandlung der akuten Divertikulitis
Die Inzidenz der Divertikulitis steigt mit zunehmendem Alter. Die Behandlung ist multimodal und muss sowohl dem Stadium der Divertikulitis als auch dem Patienten angepasst werden. Im ...
Welche Substanzen könnten sich als Gamechanger erweisen?
Ein spannender Vortrag zum Thema „New drugs on the horizon“ fand am letzten Tag der UEG (United European Gastroenterology)Week in Wien statt. Darin wurden der Stellenwert der bislang ...
Target-Mikrobiome in der Behandlung gastrointestinaler Erkrankungen
Das Mikrobiom kann durch unterschiedliche Parameter wie Ernährung, Antibiotika und Krankheiten beeinflusst werden. Veränderungen der Zusammensetzung sind mit zahlreichen ...