Morbus Crohn: Studie spricht für frühe Biologikatherapie
Bericht:
Reno Barth
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine randomisierte kontrollierte Studie evaluierte die Therapiewahl für Morbus Crohn anhand eines prognostischen Biomarkers. Das Ergebnis war negativ, doch ein Nebenbefund könnte praxisverändernde Auswirkungen haben: Eine aggressive Biologikatherapie gleich nach Diagnose erwies sich nämlich unabhängig vom individuellen Risiko im Vergleich zu einem moderateren Therapieeinstieg als signifikant und sehr deutlich überlegen.
Optimale Therapiestrategien für chronisch-entzündliche Darmerkrankungen (CED) sind nach wie vor in Diskussion. Unter anderem werden Vor- und Nachteile einer schrittweisen Eskalation der Therapie gegenüber einer frühen aggressiven Therapie abgewogen. „Eine frühe aggressive Therapie wird heute vor allem in wenigen spezialisierten Zentren durchgeführt, wobei früh meist innerhalb der ersten beiden Jahre nach Diagnose bedeutet. Viel häufiger wird nach wie vor mit einer weniger aggressiven Medikation begonnen und die Therapie im Fall von Flares bei Bedarf eskaliert“, sagt dazu Dr. Nurulamin Noor von der Universität Cambridge. Dringend gesucht würden Biomarker, anhand derer Patienten identifiziert werden können, die besonders von einer frühen aggressiven Behandlung profitieren könnten.
T-Zell-Signatur zeigt Risiko für ungünstigen Krankheitsverlauf
Ein neuer Biomarker ist der PredictSURE-IBD-Assay, der auf einer Auswertung der Transkriptions-Signaturen von T-Zellen beruht. In Studien erwies sich dieser Marker als signifikant assoziiert mit häufigen Rezidiven und höherer Krankheitsaktivität.1, 2
Die randomisierte, multizentrische Studie PROFILE („PRedicting Outcomes For Crohn’s dIsease using a moLecular biomarkEr“) untersuchte die Frage, ob dieser Biomarker bei der Entscheidung für oder gegen eine frühe Biologikatherapie hilfreich sein kann.3 Es ist dies die erste derartige Studie zur klinischen Einsetzbarkeit eines Biomarkers bei Morbus Crohn. Eingeschlossen wurden Patienten mit neudiagnostiziertem Morbus Crohn, einem Harvey-Bradshaw-Index ≥7, erhöhtem C-reaktivem Protein oder fäkalem Calprotectin oder beidem sowie endoskopischer Evidenz für aktive Entzündung. Der Biomarkerstatus blieb über die gesamte Dauer der Studie verblindet. Die Patienten wurden randomisiert nach einer „Top-down“- oder einer „Acceleratedstep-up“-Strategie behandelt, wobei „top-down“ einen Therapieeinstieg mit Infliximab in Kombination mit einem Immunmodulator bedeutete. In der „Acceleratedstep-up“-Gruppe wurde die Therapie konventionell begonnen und bei mangelndem Ansprechen schnell eskaliert. Die Eskalation erfolgte in zwei Schritten: Nach vier Wochen wurde ein Immunmodulator begonnen. Brachte dieser nicht den gewünschten Erfolg, wurde zu Woche 16 zusätzlich Infliximab gegeben. Primärer Endpunkt war die anhaltende Steroid- und Chirurgie-freie Remission zu Woche 48. Remission war definiert durch eine Kombination aus Symptomen und Inflammationsmarkern. Die Therapie wurde im Median zwölf Tage nach Diagnosestellung begonnen.
Frühe aggressive Therapie im gesamten Kollektiv überlegen
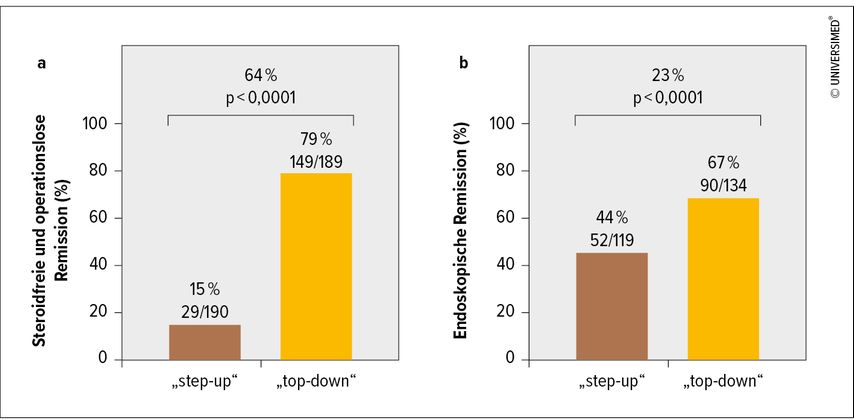
Die von Noor im Rahmen des ECCO-Kongresses 2024 vorgestellten Ergebnisse zeigen keinerlei prognostischen Wert des untersuchten Biomarkers im Hinblick auf die Wahl der therapeutischen Strategie. Die Chancen auf Remission unter einer der beiden Therapiestrategien war in keiner Weise mit dem Biomarker assoziiert. Als für die Zukunft relevanter bezeichnet Noor jedoch ein weiteres Ergebnis der Studie: die dramatische Überlegenheit der „Top-down“-Strategie, also der frühen Biologikatherapie. Während in der „Top-down“-Gruppe 79% der Patienten den primären Endpunkt erreichten, waren es in der „Step-up“-Gruppe lediglich 15% (Abb. 1a). In der „Top-down“-Gruppe wurden sehr wenige Flares beobachtet, während in der „Step-up“-Gruppe Eskalationen häufig erforderlich wurden. Auch endoskopische Remission war in der „Top-down“-Gruppe signifikant häufiger und wurde zu Woche 48 bei 67% der „Top-down“-Patienten erreicht (Abb. 1b).3
Abb. 1: Ergebnisse der PROFILE-Studie hinsichtlich steroidfreier und operationsloser Remission (a) sowie endoskopischer Remission (b) (modifiziert nach Noor NM et al. 2024)3
Dieser Therapieerfolg wurde nicht durch vermehrte Nebenwirkungen erkauft. Schwere unerwünschte Ereignisse, die eine Hospitalisierung erforderlich machten, sowie Infektionen waren in der „Step-up“-Gruppe sogar häufiger. Nur ein Patient aus der „Top-down“-Gruppe musste operiert werden. Ursache war ein Gallenstein. In der „Step-up“-Gruppe wurden wegen Strikturen oder penetrierender Erkrankung zehn Operationen erforderlich.
Noor: „Wir schließen aus diesen Daten, dass eine ,Top-down‘-Strategie in Zukunft Standard in der Therapie des neudiagnostizierten Morbus Crohn sein sollte. Wir sollten die Therapie so früh wie möglich beginnen und brauchen keine prognostischen Marker.“ Noor fügt allerdings hinzu, dass seine Aussagen nur für Patienten mit relevanter Krankheitsaktivität gelten. Fälle von sehr mildem Morbus Crohn waren aus PROFILE ausgeschlossen. Die PROFILE-Studie wurde zeitgleich mit der Präsentation in Lancet publiziert.3
Bessere Therapieergebnisse als in älteren Studien
Prof. Dr. Séverine Vermeire von der Katholischen Universität Leuven, Belgien, weist darauf hin, dass PROFILE nicht die erste Studie war, die frühe aggressive Therapie des Morbus Crohn mit einem langsameren, durch die Krankheitsaktivität gesteuerten Einstieg in die Therapie verglich. Die vor mehr als 15 Jahren publizierte „Step-uptop-down“-Studie gelangte bereits zu ähnlichen Ergebnissen, wobei die Unterschiede zwischen den Gruppen nicht so dramatisch ausfielen wie in PROFILE.4 Insbesondere in der „Top-down“-Gruppe waren die erreichten Therapieergebnisse schlechter als in PROFILE. Mögliche Erklärungen liegen in einem höheren Anteil rauchender Patienten in der älteren Studie, darüber hinaus jedoch auch in einem etwas anderen Therapieschema. Während in PROFILE die Patienten in der „Top-down“-Gruppe durchgehend eine Kombinationstherapie mit Infliximab erhielten, wurde das Biologikum in der „Step-uptop-down“-Studie nur zur Induktion eingesetzt, während im Falle eines Ansprechens die Erhaltungstherapie mit Azathioprin als Monotherapie erfolgte.4
Vermeire weist darauf hin, dass allerdings auch unter diesem Regime bei einem erstaunlich hohen Prozentsatz der Patienten nach zwei Jahren mukosale Heilung nachweisbar war. Daraus könne man schließen, dass vielleicht nicht alle Crohnpatienten dauerhaft eine Biologikatherapie benötigen und damit sehr wohl noch Weiterentwicklungen in Richtung einer individualisierten Therapie möglich sind. Es könnte also sein, so Vermeire, dass nicht die aggressive Therapie, sondern der frühe Beginn der langfristig entscheidende Faktor ist. Möglicherweise werde man in Zukunft alle Patienten früh und intensiv behandeln und mit dem Profiling beginnen, wenn einmal Remission erreicht sei. Die Frage sei, ob alle Patienten anhaltend eine Kombinationstherapie aus Biologikum und Immunmodulator benötigten oder ob sich Patientengruppen definieren ließen, in denen die Therapie wieder deeskaliert werden könne. Im Extremfall könne das sogar ein Absetzen aller Therapien bedeuten.5
Unterschiedliche Krankheitsverläufe eröffnen Chance der Individualisierung
Vermeire weist in diesem Zusammenhang auf unterschiedliche Cluster hin, die innerhalb der CED-Population definiert werden können. Die Erkrankung kann mit einem massiven Flare beginnen und in der Folge milder verlaufen, sie kann sich aber auch nach Jahren mit niedriger Krankheitsaktivität verschlechtern, diese kann anhaltend hoch bleiben oder durch rezidivierende, schwere Schübe charakterisiert sein. Auswertungen einer norwegischen Kohorte über zehn und 20 Jahre zeigen, dass rund 40% der Patienten mit Colitis ulcerosa von den schweren Verlaufsformen betroffen sind.6, 7
Personalisierung der Therapie werde also in Zukunft an Bedeutung gewinnen, finde aktuell aber vor allem im Hinblick auf die Dosierung von Biologika statt. Einen Versuch, auch die Indikationsstellung zu einer bestimmten Therapie zu personalisieren, stelle das Vedolizumab Decision Support Tool dar, das auf Basis klinischer Parameter die Wahrscheinlichkeit eines Ansprechens auf Vedolizumab vorhersagen soll.8 Vermeire schätzt dieses Tool zwar als hilfreich ein, unterstreicht jedoch, dass ihm die Spezifität fehle, um als alleiniges Kriterium für klinische Entscheidungen herangezogen zu werden. Vielmehr beschreibe der Score einen idealen Patienten für die Therapie mit Vedolizumab. Dieses und andere vergleichbare Tools würden der molekularen Heterogenität der CED nicht gerecht. Um hier besser zu werden, benötige man große Datenbanken, zuverlässige Methoden zur Charakterisierung der zellulären Signaturen sowie die Rechnerkapazitäten, um diese Daten zu verarbeiten. Auch künstliche Intelligenz werde dabei eine Rolle spielen.
Von diesen Überlegungen unabhängig bestehe jedoch in jedem Fall bei der Qualität der heute im klinischen Alltag eingesetzten Therapien reichlich Luft nach oben. So zeigen relativ rezente Daten aus den USA, dass gerade einmal 14% der neudiagnostizierten Crohnpatienten eine Biologikatherapie erhalten. Bei der Colitis ulcerosa ist der Anteil noch niedriger.9 Das hat Konsequenzen. So wurden im Jahr 2020 in den USA nach wie vor 63% Prozent der Patienten mit CED ausschließlich mit Kortikosteroiden behandelt. Manche erhielten bis zu zehn Zyklen.10 Vermeire: „Wir benützen unsere modernen Therapien nicht.“
Quelle:
Session „Crossing borders in IBD: Session 1 – IBD therapy – crossing borders“,19. Kongress der ECCO am 22. Februar in Stockholm
Literatur:
1 Lee JC et al.: J Clin Invest 2011; 121(10): 4170-9 2 Biasci D et al.: Gut 2019; 68(8): 1386-95 3 Noor NM et al.: Lancet 2024; doi: 10.1016/S2468-1253(24)00034-7 4 D’Haens G et al.: Lancet 2008; 371(9613): 660-7 5 Verstockt B et al.: Gastroenterology 2022; 162(5): 1383-95 6 Solberg IC et al.: Scand J Gastroenterol 2009; 44(4): 431-40 7 Monstad IL et al.: J Crohns Colitis 2021; 15(6): 969-79 8 Dulai PS et al.: Gastroenterology 2018; 155(3): 687-95.e10 9 Siegel CA et al.: Digestive Disease Week (DDW) 2023; Sat 1814 10 Siegel CA et al.: Clin Transl Gastroenterol 2020; 11(2): e00128
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Das kardiovaskuläre Risiko von IBD-Patienten
Eine aktive IBD erhöht das Risiko für kardiovaskuläre Erkrankungen, während bestehende kardiovaskuläre Probleme die Wahl der Medikation erschweren. Das Ziel ist es, die richtige Balance ...