Personalisierte Medizin bei CED: Was? Für wen und wann?
Autor:
PD Dr. Michel H. Maillard, MD-PhD
Centre des maladies digestives Lausanne
Avenue Louis-Ruchonnet 30
1003 Lausanne
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die chronisch-entzündlichen Darmerkrankungen (CED) sollten nicht als zwei getrennte Krankheitsentitäten, sondern als ein Spektrum von Krankheiten betrachtet werden, die in ihrer Ausbreitung, ihrem Schweregrad und ihrer Progredienz variieren. Deshalb ist es wichtig, die Patient:innen besser nach klinischen Kriterien zu kategorisieren, aber auch genetische, immunologische und umweltbezogene Faktoren in unsere strategischen Entscheidungen einfliessen zu lassen.
Die chronisch-entzündlichen Darmerkrankungen (CED), die den Morbus Crohn und die Colitis ulcerosa unter einem Begriff zusammenfassen, sind durch die Entwicklung einer überschiessenden Entzündungsreaktion des Verdauungstrakts auf das Darmmikrobiom gekennzeichnet. Die Ursachen der Erkrankungen sind vielfältig und umfassen genetische, umweltbezogene und immunologische Risikofaktoren.1 Das genetische Risiko gilt als gering: Schätzungen zufolge weisen 2–14% der Patient:innen mit Morbus Crohn und 8–14% der Patient:innen mit Colitis ulcerosa seitens der Eltern eine entsprechende positive Familienanamnese auf.2 Weitere externe Faktoren modifizieren dieses Risiko, etwa chronischer Tabakkonsum, die Zusammensetzung der mikrobiellen Flora, die Ernährung oder auch die Antibiotikaexposition in der Kindheit.3
Der natürliche Verlauf der CED ist von Patient:in zu Patient:in sehr unterschiedlich, wobei sich klassischerweise Phasen mit Entzündungsschüben und mehr oder weniger lange Phasen der Remission abwechseln. Mitunter ist auch eine langsam progrediente Krankheitsentwicklung ohne Remissionsintervalle zu beobachten. Zudem gibt es grosse Unterschiede bei der Geschwindigkeit, mit der die Erkrankung fortschreitet. Deshalb ist es bei der Erstdiagnose sehr schwierig, Patient:innen mit einer aggressiven Erkrankung von solchen mit einer eher langsam progredienten Form zu unterscheiden.4 Dies ist jedoch äusserst wichtig, um das Wohlbefinden der Patient:innen durch Massnahmen gegen die Symptome (chronische Schmerzen, Passagestörungen, Gewichtsverlust, …) verbessern und gleichzeitig das Risiko von Komplikationen wie chirurgischen Resektionen, Hospitalisierungen und längerfristig von Krebserkrankungen reduzieren zu können. Die Identifikation der Hochrisikopatient:innen ist somit ein wesentliches therapeutisches Ziel, denn diese Kategorie von Patient:innen profitiert von einer frühzeitigen, aggressiven Behandlung, insbesondere von der raschen Aufnahme einer Biologikatherapie.
Stratifizierung der Patient:innen und Identifikation von Personen mit hohem Risiko
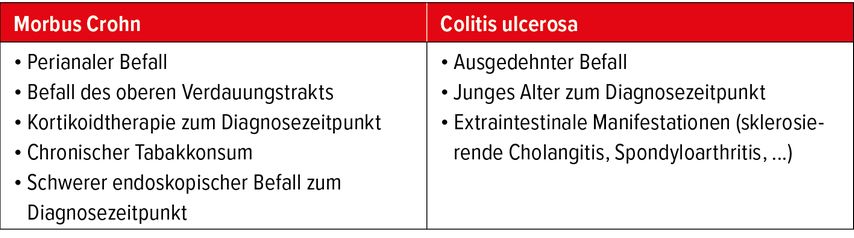
Bisher werden nur sehr wenige Faktoren herangezogen, um Patient:innen mit CED zu stratifizieren und zu versuchen, die Personen mit hohem Risiko zu identifizieren. Die aktuellen Kriterien für eine schlechte Prognose sind in Tabelle 1 zusammengefasst. Beim Morbus Crohn sind dies ein perianaler Befall oder ein Befall des oberen Abschnitts des Verdauungstrakts, chronischer Tabakkonsum, der Schweregrad zum Diagnosezeitpunkt und der Steroidbedarf zum Diagnosezeitpunkt.5 Bei der Colitis ulcerosa sind es die Ausdehnung der Erkrankung, das Alter zum Diagnosezeitpunkt und das Bestehen von extraintestinalen Manifestationen wie einer sklerosierenden Cholangitis. Die Zeit, die bis zur Stellung der Erstdiagnose vergeht, ist ebenfalls ein sehr wichtiger Faktor: Ist sie kurz, ist die Prognose am besten. Die Verkürzung der Zeit bis zur Diagnosestellung und die frühzeitige Identifikation von Risikopatient:innen sind somit zentrale therapeutische Ziele bei der Betreuung von Personen mit CED.6
Aktuelle Daten deuten darauf hin, dass sich anhand von genetischen Faktoren Patient:innen mit einer weniger guten Prognose identifizieren lassen. Dabei handelt es sich um Gene, die an der Reaktion des adaptiven Immunsystems, genauer gesagt der Modulation der T-Zell-Reaktion beteiligt sind (FOXO3, XACT, IGFBP1 und die MHC-Region zwischen den Genen HLA-B und HLA-DR). Auch das Ansprechen auf die Behandlung und das Toxizitätsrisiko bestimmter Therapien kann mithilfe von genetischen Faktoren vorausgesagt werden. Dies ist für Thiopurine gut belegt, bei denen Mutationen in den Genen Nudix-Hydrolase 15 (NUDT15) und Thiopurin-S-Methyltransferase (TPMT) mit der Knochenmarktoxizität der Therapien und ihrer myelosuppressiven Wirkung assoziiert sind.7
Wahl der Therapien in Abhängigkeit von individuellen Merkmalen
Bestimmte Umweltfaktoren sind zwar beeinflussbar, doch gegenwärtig ist es nicht möglich, die Behandlung nur auf diese auszurichten und die Entzündung im Darm auf diese Weise zu bekämpfen.
Deshalb beruhen die meisten der aktuellen therapeutischen Strategien auf einer mehr oder weniger zielgerichteten Immunmodulation über die Signalwege, die auf Ebene der Schleimhäute aktiviert werden und den Ausgangspunkt der chronischen Entzündung bilden. Im Laufe des letzten Jahrhunderts stellten die konventionellen Kombinationstherapien mit Kortikosteroiden und oralen Immunsuppressiva den Eckpfeiler der Behandlung dar, doch mit Einführung der zielgerichteteren Biologika hat sich die Versorgung der Patient:innen seit der Jahrtausendwende erheblich verbessert. Die TNF-α-Blocker sind die Gruppe von Biologika, die nach einem Scheitern der konventionellen Therapien bisher am häufigsten angewendet werden. Auch wenn sie in bestimmten Situationen sehr wirksam sind, kommt es bei zahlreichen Patient:innen zu einem primären oder sekundären Therapieversagen.8
In den vergangenen Jahren wurden in mehreren Studien Biomarker für das Ansprechen auf Anti-TNF-Therapien identifiziert. Dabei handelt es sich um genetische, immunologische oder zelluläre Faktoren. So konnten z.B. West et al. Oncostatin M als Schleimhautmarker für ein schlechtes Ansprechen auf Anti-TNF-Therapien ausmachen.9 Erhöhte Werte in der Schleimhaut von Patient:innen mit Colitis ulcerosa und einem Entzündungsschub waren demnach mit einer Resistenz gegen Anti-TNF-Therapien assoziiert. Dies war auch der Fall, wenn die Konzentration in der Schleimhaut vor der Behandlung bestimmt wurde. Das bedeutet, dass das Ansprechen bereits vor Einleitung der Therapie vorausgesagt werden kann. Die Anwendbarkeit dieses Faktors in der klinischen Praxis wird zwar noch untersucht, doch er könnte dabei helfen, die optimale Therapie für eine konkrete Person auszuwählen.
Wahl der Therapiesequenz: wann welche Behandlung?
Die Wahl des Therapietyps für eine konkrete Person hängt von mehreren Faktoren ab. Selbstverständlich wird versucht, die Therapie auszuwählen, die in der jeweiligen Situation am wirksamsten ist. Gleichzeitig soll jedoch auch das Sicherheitsprofil optimal sein. Des Weiteren wird versucht, eine Therapie zu wählen, die der Einleitung künftiger Therapien mit anderen Wirkstoffen nicht im Wege steht, sollte sie scheitern. Da es sich bei den CED um chronische Erkrankungen handelt, ist die Wahrscheinlichkeit der langfristigen Remissionserhaltung ein Schlüsselfaktor, der bei der therapeutischen Entscheidungsfindung berücksichtigt werden muss. Nicht zuletzt können auch besondere Umstände wie eine Schwangerschaft, das Auftreten extraintestinaler Manifestationen oder Begleiterkrankungen Einfluss auf die Wahl der Therapie haben.
Mit Blick auf die Wirksamkeit wurden für die Colitis ulcerosa in den vergangenen Jahren mehrere Vergleichsstudien veröffentlicht. In der VARSITY-Studie mit Patient:innen mit Colitis ulcerosa, die zuvor keine Biologikatherapie erhalten hatten (therapienaive Patient:innen), wurde die Wirksamkeit von Adalimumab mit der von Vedolizumab verglichen. Nach einem Beobachtungszeitraum von einem Jahr befanden sich 31,3% der mit Vedolizumab behandelten und 22,5% der mit Adalimumab behandelten Patient:innen in klinischer Remission (p=0,006; 95% CI: 2,5–15,0). Der entsprechende Unterschied war auch bei der endoskopischen Remission signifikant (39,7% unter Vedolizumab versus 27,7% unter Adalimumab; p<0,001; 95% CI: 5,3–18,5).10 In der EVOLVE-Studie war der Wirksamkeitsunterschied nicht signifikant, Vedolizumab zeigte jedoch ein besseres Sicherheitsprofil und war mit einer geringeren Rate schwerwiegender unerwünschter Wirkungen assoziiert als TNF-Blocker (adjustierte Hazard-Ratio: 0,34; 95% CI: 0,19–0,63).11
Mit Blick auf die Therapiepersistenz, d.h. die Zeit, während der die Patient:innen erfolgreich mit der Therapie behandelt werden, wurde in der PANIC-Studie eine Überlegenheit von Vedolizumab gegenüber Infliximab und Adalimumab festgestellt. So befanden sich nach 12 Monaten 73,4% der Colitis-ulcerosa-Patient:innen weiterhin in Behandlung mit Vedolizumab; bei Infliximab waren es 61,1% und bei Adalimumab 45,5% (p<0,001).12
Nicht zuletzt ergaben vorläufige Daten, die auf dem ECCO-Kongress 2022 präsentiert wurden, für Vedolizumab eine geringere Häufigkeit von Therapiewechseln als bei TNF-Blockern (VEDO-IBD-Studie).13
Somit ist festzuhalten, dass Vedolizumab bei nicht mit Biologika vorbehandelten Patient:innen mit aktiver Colitis ulcerosa wirksamer zu sein scheint als TNF-Blocker. Zu dieser höheren Wirksamkeit hinzu kommt eine bessere zeitliche Persistenz der Wirkung.
Für Ustekinumab liegen aktuell keine veröffentlichten Daten zur Wirksamkeit im Vergleich zu anderen Therapien bei Colitis ulcerosa vor. In der SEAVUE-Studie wurden jedoch bei Morbus Crohn Ustekinumab und Adalimumab miteinander verglichen.14 Nach einem Jahr der Beobachtung waren die Raten der Remission, des klinischen Ansprechens und der endoskopischen Remission unter beiden Präparaten ähnlich. Diese grosse, mit 386 Patient:innen in 121 Zentren durchgeführte Studie wurde kürzlich durch zwei kleinere, monozentrische Studien infrage gestellt. Diese kleineren Studien zeigten mit Blick auf das klinische Ansprechen nach 3 Monaten15 und die endoskopische Remission nach 26–52 Wochen16 eine Überlegenheit von TNF-Blockern und Adalimumab gegenüber Ustekinumab.
Die Daten zur Zweit- und Drittlinientherapie sind noch nicht hinreichend gesichert und werden kontrovers diskutiert. Studien liegen bisher nur in Form von Kongress-Abstracts vor. In der britischen Bioressource-Studie wurden Ustekinumab und Vedolizumab in zweiter Linie nach einer Anti-TNF-Therapie bei einem Patientenkollektiv mit Morbus Crohn verglichen. Dabei war über einen Beobachtungszeitraum von bis zu 5 Jahren kein Unterschied hinsichtlich der Wirksamkeit der beiden Therapien festzustellen.17 Allerdings war Vedolizumab weniger wirksam als Ustekinumab, wenn es in dritter Linie angewendet wurde, und Ustekinumab war Vedolizumab überlegen, wenn das Ileum betroffen war.17 Umgekehrt blieb das Wirksamkeitsniveau von Ustekinumab unabhängig davon, ob es in zweiter oder dritter Linie nach TNF-Blockern und Vedolizumab angewendet wurde, aufrechterhalten.18
Fazit und Ausblick
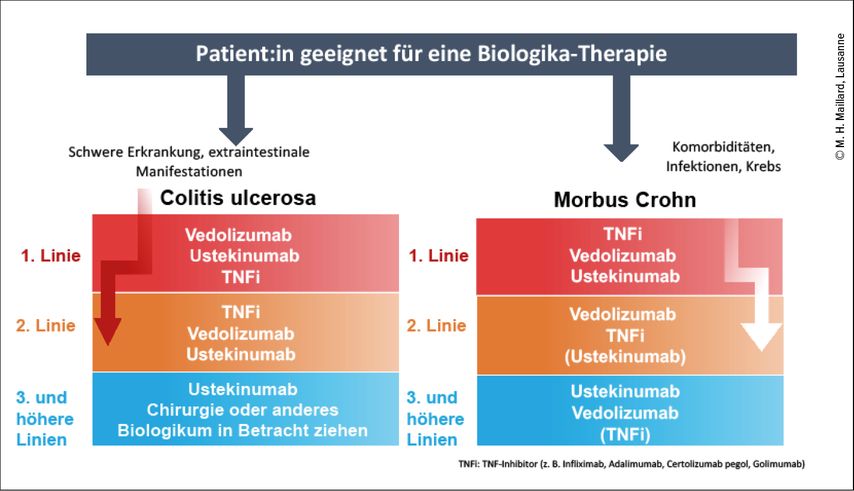
Die CED sollten nicht als zwei getrennte Krankheitsentitäten, sondern als ein Spektrum von Krankheiten betrachtet werden, die in ihrer Ausbreitung, ihrem Schweregrad und ihrer Progredienz variieren. Deshalb ist es wichtig, die Patient:innen besser nach klinischen Kriterien zu kategorisieren, aber auch genetische, immunologische und umweltbezogene Faktoren in unsere strategischen Entscheidungen einfliessen zu lassen. Bestimmte molekulare Marker ermöglichen eine Vorhersage des Ansprechens auf einzelne Biologika und sollten nach und nach Einzug in die klinische Praxis halten. Nicht zuletzt nimmt die Zahl der Biologika, die zur Behandlung der CED zur Verfügung stehen, aktuell stark zu, sodass Vergleichsstudien sehr wichtig sind, um die für eine konkrete Person optimale Therapiesequenz bestimmen zu können (Abb. 1). Angesichts der zahlreichen neuen Therapiestrategien, für die etwa die Einführung der Januskinase- oder Sphingosin-1-Phosphat-Inhibitoren ein Beispiel ist, wird die Positionierung der einzelnen Arzneimittelklassen immer komplexer. Kombinationstherapien werden aktuell ebenfalls untersucht und die Daten sind vielversprechend.
Literatur:
1 de Souza HSP, Fiocchi C: Immunopathogenesis of IBD: current state of the art. Nat Rev Gastroenterol Hepatol 2016; 13: 13-27 2 Torres J, Colombel JF: Genetics and phenotypes in inflammatory bowel disease. Lancet 2016; 387: 98-100 3 Ananthakrishnan AN et al.: Lifestyle, behaviour, and environmental modification for the management of patients with inflammatory bowel diseases: an International Organization for Study of Inflammatory Bowel Diseases consensus. Lancet Gastroenterol Hepatol 2022; 7: 666-78 4 Walsh E et al.: Clinical predictors and natural history of disease extension in patients with ulcerative proctitis. Inflamm Bowel Dis 2017; 23: 2035-41 5 Cosnes J et al.: Factors affecting outcomes in Crohn’s disease over 15 years. Gut 2012; 61: 1140-5 6 Vavricka SR et al.: Systematic evaluation of risk factors for diagnostic delay in inflammatory bowel disease. Inflamm Bowel Dis 2012; 18: 496-505 7 Verstockt B et al.: How dowepredict a patient’s disease course and whether they will respond to specific treatments? Gastroenterol 2022; 162: 1383-95 8 Torres J et al.: ECCO Guidelines on therapeutics in Crohn’s disease: medical treatment. J Crohns Colitis 2019; 14: 4-22 9 West NR et al.: Oncostatin M drives intestinal inflammation and predicts response to tumor necrosis factor–neutralizing therapy in patients with inflammatory bowel disease. Nat Med 2017; 23: 579-89 10 Sands BE et al.: Vedolizumab versus adalimumab for moderate-to-severe ulcerative colitis. New Engl J Med 2019; 381: 1215-26 11 Bressler B et al.: Vedolizumab and anti-TNFα real-world outcomes in biologic-naïve inflammatory bowel disease patients: results from the EVOLVE study. J Crohns Colitis 2021; 15: jjab058 12 Ko Y et al.: Superior treatment persistence with ustekinumab in Crohn’s disease and vedolizumab in ulcerative colitis compared with anti-TNF biological agents: real-world registry data from the Persistence Australian National IBD Cohort (PANIC) study. Aliment Pharmacol Ther 2021; 54: 292-301 13 Plachta-Danielzik S et al.: OP17 Maintenance phase propensity score adjusted effectiveness and persistence at week-52 in biologic-naïve ulcerative colitis patients treated with vedolizumab or anti-TNF (VEDO IBD-study). J Crohns Colitis 2022; 16: i018-9 14 Sands BE et al.: Ustekinumab versus adalimumab for induction and maintenance therapy in biologic-naive patients with moderately to severely active Crohn’s disease: a multicentre, randomised, double-blind, parallel-group, phase 3b trial. Lancet 2022: 399: 2200-11 15 Riviere P et al.: P524 Compared efficacy of ustekinumab and anti-TNF agents as first-line biological therapy in luminal Crohn’s disease. J Crohns Colitis 2022; 16: i479 16 Moens et al.: Adalimumab versus ustekinumab as first-line biological in moderate-to-severe Crohn’s disease: real-life cohort from a tertiary referral center. Eur J Gastroenterol Hepatol 2022; 34: 1015-20 17 Desoki R et al.: DOP74 Comparative effectiveness of vedolizumab and ustekinumab in Crohn’s disease patients who failed anti-TNF treatment: Interrogating 1019 patients from the UK IBD BioResource. J Crohns Colitis 2022; 16: i117-8 18 Alsoud D et al.: P447 Positioning of ustekinumab affects its effectiveness, drug persistence and serum exposure in Crohn’s disease. J Crohns Colitis 2022; 16: i427-8
Das könnte Sie auch interessieren:
Welche Substanzen könnten sich als Gamechanger erweisen?
Ein spannender Vortrag zum Thema „New drugs on the horizon“ fand am letzten Tag der UEG (United European Gastroenterology)Week in Wien statt. Darin wurden der Stellenwert der bislang ...
Target-Mikrobiome in der Behandlung gastrointestinaler Erkrankungen
Das Mikrobiom kann durch unterschiedliche Parameter wie Ernährung, Antibiotika und Krankheiten beeinflusst werden. Veränderungen der Zusammensetzung sind mit zahlreichen ...
Update im therapeutischen Management der Helicobacter-pylori-Infektion
Die H.-pylori-Infektion ist entscheidender Ausgangspunkt für die Entwicklung eines Magenkarzinoms. Diese Entwicklung kann durch eine frühzeitige Eradikation von H.pylori verhindert ...