Heilung für das multiple Myelom?
Autor:
OA Univ.-Prof. Mag. DDr. Klaus Podar
Klinische Abteilung für Innere Medizin 2
Universitätsklinikum Krems
Leiter der Molekularen
Onkologie und Hämatologie
Karl Landsteiner Privatuniversität für Gesundheitswissenschaften
Krems a. d. Donau
E-Mail: klaus.podar@krems.lknoe.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Fortschritte des Wissens zur Pathogenese des multiplen Myeloms (MM) und die davon abgeleitete Entwicklung neuer Behandlungsformen haben zu einer signifikanten Steigerung des Überlebens der Patient:innen geführt. Ob das MM, zumindest in Einzelfällen, heilbar ist, wird zunehmend diskutiert. Der im Rahmen der Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie 2024 gehaltene Vortrag „Heilung für das MM?“ definierte den Begriff „Heilung“ und stellte Methoden, die eine solche belegen können, sowie aktuelle Therapiestrategien vor. Der vorliegende Artikel wurde mit Referenzen zu einzelnen beim ASH-Kongress 2024 präsentierten Beiträgen ergänzt.
Keypoints
-
Neue Therapieregime erzielen beim neu diagnostizierten sowie beim relapsierten/rezidivierten multiplen Myelom Ansprechraten von bis zu 100%.
-
„Echte Heilung“ wird definiert als restloses Wegbleiben der Tumorerkrankung ohne Notwendigkeit einer weiteren Therapie, die Absenz von Therapie-assoziierten Komorbiditäten und eine Sterblichkeitsrate, die der einer gesunden altersgleichen Person entspricht.
-
„Funktionelle Heilung“ definiert ein auch bei unvollständiger Eradikation von Tumorzellen nicht beeinträchtigtes tägliches Leben von Patient:innen beziehungsweise eine komplette Remission von zumindest 10 Jahren.
-
MRD-Negativität und mehr noch eine dauerhafte MRD-Negativität sind die besten frühen prognostischen Surrogatmarker für PFS und OS.
-
Je tiefer das Therapieansprechen, umso länger die Remission und damit die Chance auf Heilung.
-
MRD-adaptierte Studien werden in Zukunft die MM-Therapie personalisieren.
-
Next-Generation-CAR-T-Zellen, bsAK, trispezifische AK, Bcl-2-Inhibitoren, Immunotoxine und Protein-Degraders werden die Heilungschancen weiter steigern.
Das MM war bis vor 20 Jahren schlecht behandelbar. Bis Anfang der 2000er-Jahre standen neben Steroiden nur Chemotherapeutika und die autologe Stammzelltransplantation (SZT) zur Verfügung; belastende Behandlungskonzepte, vor allem für ältere Patient:innen. Kontinuierliche Fortschritte des Wissens zur molekularen Komplexität der Krankheit haben seitdem zur Zulassung von 19 neuen Substanzen und mehr als 35 Therapieregimen geführt und die Behandlung des MM revolutioniert. Mit immunmodulatorischen Wirkstoffen (IMiDs), Proteasominhibitoren (PIs), monoklonalen Antikörpern (mAK) und modernen immuntherapeutischen Modalitäten (Antikörper-Wirkstoff-Konjugate [ADCs], T-Zellen mit chimerischen Antigenrezeptoren [CAR-T-Zellen] und bispezifischen Antikörpern [bsAK]) werden zunehmend tiefere und länger anhaltende Ansprechraten mit selteneren Krankheitsrückfällen erzielt. Vor allem der Einsatz von Triplet- und mehr noch von Quadruplet-Therapien bei neu diagnostizierten transplantfähigen und nichttransplantfähigen MM-Patient:innen hat zu bisher nie gesehenen Ansprechraten (ORR) sowie Raten des progressionsfreien Überlebens (PFS) und Gesamtüberlebens (OS) geführt. Die beispiellose Anti-Tumor-Aktivität von CAR-T-Zellen und bsAK bei vielfach vortherapierten Patient:innen, aber auch in früheren Therapielinien verändern derzeit abermals die MM-Behandlung. Die Heilung des MM ist in greifbare Nähe gerückt.1,2
Begriffsbestimmung „Heilung“
Der Begriff der (echten) Heilung von Tumorerkrankungen wurde erstmals von Eason und Russell3 am Beispiel des Hodgkin-Lymphoms definiert und später von Kwan und Kolleg:innen4 erweitert. Als geheilt gilt eine Person dann, wenn die Tumorerkrankung ohne weitere Therapien restlos verschwunden ist, im Verlauf des Lebens nicht zurückkehrt, keine therapie- oder krankheitsassoziierten Komorbiditäten nachweisbar sind und die Mortalität mit der einer gesunden, altersgleichen Person vergleichbar ist.3,4
Von „echter Heilung“ kann die „funktionelle Heilung“ unterschieden werden. Sie ist dadurch gekennzeichnet, dass es trotz einer vollständigen Unterdrückung des Wachstums zu einer unvollständigen Eradikation von Tumorzellen kommt, welche aber das tägliche Leben der Patient:innen nicht beeinträchtigt. Basierend auf den Erfolgen insbesondere der zielgerichteten und modernen Immuntherapien kommt dieses Konzept in der Onkologie und Hämatologie zunehmend zum Tragen. Neben der „echten“ und „funktionellen“ Heilung beschreibt die „relative Heilung“ einen lang andauernden Zustand, in dem die Tumorzellen vollständig entfernt wurden, aber die Lebensqualität nur teilweise oder auf einem niedrigeren Niveau als zuvor erhalten ist.
Was meint man nun mit „Heilung“, speziell bei MM-Patient:innen? Anfang der 1990er-Jahre war der Einsatz der Hochdosistherapie (HDT) gefolgt von einer allogenen SZT die einzige Möglichkeit einer Heilung des MM. Ein Plateau der Überlebenskurven deutete auf das kurative Potenzial dieses Therapieansatzes bei einzelnen Patient:innen hin. Allerdings war die Tumor- assoziierte Mortalität mit 40–60% sehr hoch.5,6 1991 hat Dr. Barlogie erstmals den Begriff der „Heilung des MM“ thematisiert.7 Er widmete einen großen Teil seiner Karriere der Entwicklung einer „total therapy“ (TT), die alle MM-aktiven Chemotherapeutika in der Induktionstherapie, gefolgt von einer HDT und einer Tandem-autologen SZT einsetzte, um Arzneimittel-resistente Subklone zu bekämpfen und lange komplette Remissionen (CR) zu erzielen. Eine rezente Analyse der TT-Studien (TT1, -2, -3, -3a, -3b) zeigt nach 16,6 Jahren, der längsten jemals dokumentierten Nachbeobachtungsdauer einer Phase-III-MM-Studie, ein medianes Überleben von 13,3 Jahren. Etwa ein Drittel der Patient:innen, die nach dem TT2-Protokoll behandelt wurden lebten noch 20 Jahre nach der Erstdiagnose, die Hälfte der Patient:innen, die nach dem TT3-Protokoll behandelt wurden lebten noch 15 Jahre nach Erstdiagnose. Diese Ergebnisse unterstreichen den potenziellen Langzeitnutzen einer zeitlich begrenzten Behandlung. Allerdings konnte die TT nur selektionierten Patient:innen angeboten werden und war überaus komplex.8 Basierend auf diesen Resultaten prägten Powles und Kolleg:innen den Begriff der „operativen oder funktionellen Heilung des MM“ für eine kleine Minderheit von Patient:innen, die sich nach HDT und autologer SZT mit einer On/Off-Therapie zumindest zehn Jahre lang in einer CR befanden. In weiterer Folge konnten durch den stufenweisen Ersatz von Chemotherapeutika mit IMiDs, PIs und mAK sowie die Implementierung von CAR-T-Zellen und bsAK CR-Raten sowohl in der Erstlinientherapie als auch imRR-Setting kontinuierlich gesteigert werden.
Wie eine rezente Studie zeigt, scheint die Kombination neuartiger Wirkstoffe zwischen 1980 und 2020 der Hauptfaktor für die Verbesserung der Überlebensrate beim MM zu sein. Das OS stieg von 22,4 Monaten in den Jahren 1980–1990 auf 37,4 Monate in den Jahren 1991–2000, 61,8 Monate in den Jahren 2001–2010 und 103,6 Monate in den Jahren 2011–2020. Bei guter Therapietoleranz war das mediane Überleben von Patient:innen, die mit einer Kombination von mindestens zwei neuen Wirkstoffen in der Induktionsphase behandelt wurden, signifikant länger als bei Patient:innen, die mit einem einzigen neuen Wirkstoff oder einer konventionellen Therapie behandelt wurden (143,3 vs. 61,0 vs. 42,2 Monate, p<0,001). Die Verlängerung war bei allen Patient:innen unabhängig vom Alter bei der Diagnose erkennbar. 13,2% der Patient:innen waren Langzeitüberlebende (medianes OS ≥10 Jahre). Unabhängige klinische Prädiktoren für das Langzeitüberleben inkludierten ECOG <1, Alter bei der Diagnose ≤65 Jahre, IgG- und Nicht-IgA-Subtyp, ISS-1 und Standard-Risiko-Zytogenetik. Vor allem das Erreichen einer CR und die Durchführung einer autologen SZT waren mit einer Überlebensdauer von mehr als zehn Jahren verbunden.9 Folglich kann davon ausgegangen werden, dass zumindest bei einigen Patient:innen die aktuellen Therapieansätze die Erkrankung chronisch oder sogar heilbar machen können.
Trotz dieser Erfolge darf die Frage gestellt werden, ob wirklich jede Patientin und jeder Patient mit einer aggressiven Multimedikamentenstrategie, die auf eine Heilung abzielt, behandelt werden sollte. Könnte ein sequenzieller Therapieansatz, bei dem die Lebensqualität und das OS im Vordergrund stehen, besonders bei älteren und fragilen Patient:innen nicht eine bessere Wahl sein?10,11
Methoden zum Nachweis einer Heilung
Die in der Routine verwendete Diagnostik (Serum- und Urinelektrophorese, Knochenmarksanalyse inklusive Zytogenetik, Bilddiagnostik wie Ganzkörper-CT und -MRT) erkennt nur die „Spitze des Eisbergs“ (>1010 MM-Zellen). Es besteht daher ein dringender Bedarf an sensitiven Methoden, die auch jenen Teil des Eisbergs nachweisen können, der „unter der Wasseroberfläche“ liegt. Diese sollen eine frühere Diagnose der Ersterkrankung oder eines Rezidivs, eine genauere Risikostratifizierung und die Entwicklung weiter verbesserter und personalisierter Behandlungsstrategien ermöglichen.
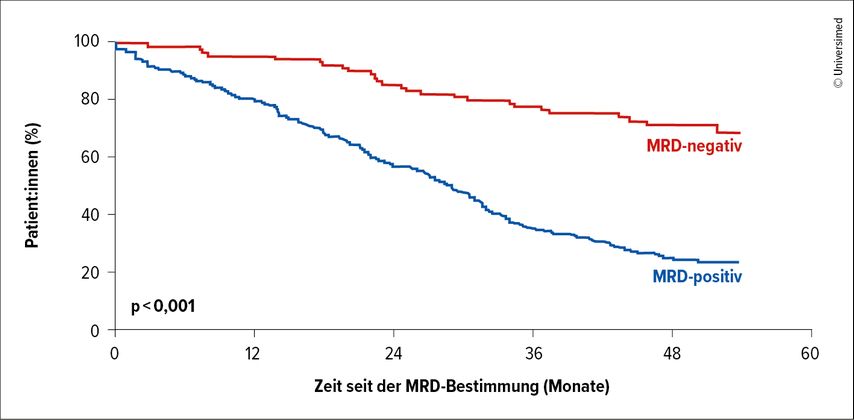
Wie bei anderen hämatologischen Malignomen, die als heilbar gelten, sind auch beim MM das Erreichen und eine dauerhafte, tiefe Remission ohne minimale Resterkrankung (MRD) ein Indiz dafür, dass die Krankheit kontrolliert oder sogar kuriert werden kann. Zwei große Metaanalysen zeigen, dass die MRD-Negativität mit einem signifikant verlängerten OS und PFS (Abb. 1) assoziiert sowie anderen traditionellen Ansprechkriterien wie der CR überlegen ist. Bemerkenswert ist, dass das Erreichen einer MRD-Negativität auch einige ungünstige Risikofaktoren aufhebt, zum Beispiel Hochrisiko-Zytogenetik, ISS oder R-ISS.12–14 Aufgrund dieser prognostischen Bedeutung hat das Oncologic Drug Advisory Board der FDA im April 2024 beschlossen, dass der Nachweis einer MRD-Negativität als früher Endpunkt in klinischen MM-Studien verwendet werden kann. Damit wird die raschere Zulassung neuer Therapien (9–12 Monate vs. ≥8 Jahre) forciert.
Abb. 1: PFS je nach MRD-Status zu Beginn der Erhaltungstherapie: Das mediane PFS wurde bei MRD-Negativität (rot) nicht erreicht, während es bei MRD-Positivität (blau) bei 29 Monaten lag (modifiziert nach Perrot A et al.)14
Die Nachanalysen mehrerer Zulassungsstudien (z.B. MAIA, ALCYONE, POLLUX, CASTOR, PERSEUS) demonstrieren darüber hinaus, dass eine lang anhaltende MRD-Negativität (≥12 Monate) ein noch aussagekräftigeres prognostisches Merkmal ist als der Einzelnachweis einer MRD-Negativität.15–18 Die Knochenmark(KM)-basierte MRD wird entweder mittels Mehrfarben-Durchflusszytometrie (NGF) oder mittels Next-Generation-Sequencing (NGS) gemessen. Die MRD-Negativität ist definiert als die Abwesenheit von MM-Zellen in einer Population von 100000 (Cut-off 10–5) oder 1000000 Zellen (Cut-off 10–6).19 Die FACS-basierte Analyse verwendet entweder 8- oder 10-Farben-Antikörper-Panels zur Identifizierung phänotypisch abweichender Plasmazellen entsprechend den validierten Protokollen von EuroFlow oder MSKCC.20,21 Die NGS-basierte MRD-Bestimmung beruht auf der Identifizierung und Nachverfolgung tumorspezifischer Immunglobulin-V(D)J-Rearrangements mittels des clonoSEQ®-Assay („adaptive biotechnologies“). Optimalerweise wird die MRD-Bestimmung durch eine PET-CT ergänzt. Die aktuellen IMWG-Ansprechkriterien definieren das tiefste Therapieansprechen als Erreichen einer CR mit MRD-Negativität (Cut-off 10–5) bei Absenz FDG-avider Läsionen.19 Eine falsch negative MRD-Bestimmung aus dem KM kann durch eine extramedulläre Erkrankung (EMD), eine lückenhafte Besiedelung des KM („patchy involvement“) oder eine verdünnte Probe verursacht werden. Liquid Biopsies, als minimalinvasive Maßnahme, könnten durch Nachweis zirkulierender Tumorzellen (CTCs), zirkulierender DNA und RNA (cDNA, cRNA) sowie vesikulärer cfRNA und Proteinen im peripheren Blut diesen Schwachpunkten entgegenwirken. Erste Indizien weisen darauf hin, dass der massenspektrometrische Nachweis des monoklonalen Proteins im peripheren Blut mittels MALDI-TOF oder qTOF die MRD-Bestimmung im KM ergänzen oder zur Orientierung für die Notwendigkeit einer KM-Punktion dienen kann.22,23 Darüber hinaus ermöglicht „whole-genome sequencing“ (WGS), zumindest in Studien, die Identifizierung von potenziellen Treibermutationen, neuen therapeutischen Zielen, Resistenzmodi gegen Therapeutika und personalisierten Behandlungsansätzen.
Die „Single cell“-Sequenzierung berücksichtigt darüber hinaus die genetische und phänotypische Heterogenität innerhalb einzelner Tumorzellen sowie innerhalb des Mikroenvironments. Eine weitere Verbesserung der Diagnostik verspricht die molekulare Bildgebung mit spezifischen Radio-Isotopen (z.B. [11C]-Methionin, [18F]-Fluciclovine), die PET-MRT und die DW-MRT.24 In Zukunft ist zu erwarten, dass die Vielzahl an klinischen, molekularen und genetischen Informationen durch künstliche Intelligenz und Machine-Learning-Algorithmen integriert werden. So können medizinische Entscheidungen verbessert und personalisierte Therapieansätze entwickelt werden, die eine MRD verhindern.
Moderne Ansätze zur Heilung einesMM
Zwei Hauptfaktoren bestimmen die Prognose des MM: das Erreichen einer MRD-Negativität und die Biologie der Erkrankung (Standardrisiko- vs. Hochrisikopatient:innen). Eine beträchtliche Anzahl der Patient:innen bleibt nach einer Induktionstherapie und autologer SZT MRD-positiv. Dies weist auf die Notwendigkeit hin, neue Wirkstoffe mit komplementärem Wirkmechanismus und günstigem Toxizitätsprofil oder neue Behandlungsstrategien einzusetzen, um eine MRD-Negativität zu erzielen und dauerhaft zu erhalten. Therapeutische Ansätze zur Vertiefung des Ansprechens und zur Steigerung der Wahrscheinlichkeit einer Heilung eines MM umfassen:
-
das frühe Eingreifen, um das Fortschreiten eines SMM in ein aktives MM mit Endorganschäden zu verhindern
-
regimeorientierte Therapien
-
response- und risikoadaptierte Therapien
-
neuartige Substanzen und präzisions-medizinische Ansätze
Frühes Eingreifen
Basierend auf den Mayo- oder PETHEMA-Risiko-Scores bzw. dem „2/20/20“-Modell werden HR-SMM-Patient:innen definiert.25–27 Zu den intensivierten, sogenannten Cure-Regimen, die das Fortschreiten eines SMM in ein aktives MM mit Endorganschäden verhindern sollen, gehören 6x KRd → HD-Mel → autologe SZT → 2x KRd → 24x Rd-Erhaltung (GEM-CESAR Studie)28 und 4x Dara-KRd → HD-Mel → autologe SZT oder Dara-KRd ohne autologe SZT → 4x Dara-KRd-Konsolidierung → 12x Dara-KRd-Erhaltung (ASCENT-Studie).29 Resultate der GEM-CESAR-Studie zeigen eine MRD-Negativität nach sechs Jahren von 40%, eine PFS-Rate von 94% nach 70 Monaten und eine OS-Rate von 98% nach 28 Monaten. In der ASCENT-Studie konnte eine MRD-Negativität von 84% nach drei Jahren nachgewiesen werden. Basierend auf diesen Daten kann eine signifikante Erhöhung der Rate an funktioneller Heilung nach 20 Jahren erwartet werden.
Aktuell untersucht die CAR-PRISM-Studie30 die Anwendung von Ciltacabtagene Autoleucel (Cilta-cel) bei HR-SMM-Patient:innen ohne Induktionstherapie. Neben diesen intensiven kommen auch weniger intensive Regime zur Anwendung. So hat die Therapie mit Lenalidomid allein oder in Kombination mit Dexamethason ebenso wie die Monotherapie mit dem CD38-mAK Daratumumab (Dara) eine vielversprechende Wirksamkeit und Verträglichkeit bei SMM-Patient:innen mit mittlerem oder hohem Risiko gezeigt.
Resultate der randomisierten Phase-III-Studie AQUILA31 gehörten zu den Highlights auf dem Gebiet der Plasmazellerkrankungen am ASH-Kongress 2024. Diese weisen darauf hin, dass die Dara-Monotherapie das Fortschreiten eines Hochrisiko-SMM in ein aktives MM mit Endorganschäden signifikant verzögert oder verhindert und dadurch das Gesamtüberleben verlängert (Abb. 2). Ein Antrag auf Zulassung von Dara in diesem Setting wurde bei der FDA eingereicht. Für die tägliche Praxis stellt sich dennoch die Frage, ob symptomlose Patient:innen mit Hochrisiko-Plasmazell-Vorläufererkrankungen generell behandelt werden sollten. Aus Sicht des Autors braucht es eine weitere Verbesserung der SMM-Risiko-Stratifizierung.
Abb. 2: AQUILA-Studie – verlängertes Gesamtüberleben (Hazard-Ratio für Tod: 0,52, 95%-KI: 0,27–0,98) unter der Monotherapie mit Daratumumab im Vergleich zum aktiven Monitoring in der Intention-to-treat-Population (modifiziert nach Dimopoulos MA et al.)31
Regimeorientierte Therapiestrategien
Regimeorientierte Studien fokussieren sich auf die Induktions-, Konsolidierungs- oder Erhaltungstherapie.
Induktion und Konsolidierung
Basierend auf Resultaten der Phase-III-Studie PERSEUS18 ist Dara-VRd → HD-Mel → autologe SZT → DR-Erhaltung der aktuelle Therapiestandard für neu diagnostizierte transplantfähige MM-Patient:innen (nach 47,5 Monaten war das PFS 84,3%, die MRD-Negativität 65,1% [Cut-off 10–6]). Vielversprechende Anti-MM-Wirksamkeit zeigen auch Quadruplet-Therapien mit Isatuximab-RVd (Isa-RVd) (GMMG-HD7-Studie: MRD-Negativität nach Beendigung der Induktionstherapie 50%, MRD-Negativität nach autologer SZT 66,2%)32,33 und Isa-KRd (GMMG-CONCEPT-Studie).34,35 Ebenso Erfolg versprechend: Dara-Teclistamab-(Tec)-Kombinationen, etwa die Quintuplet-Therapie mit Tec-DaraRd (MajesTEC-5-Studie: MRD-Negativität 100% in allen Therapiearmen).36 Frühe Resultate einer Therapie mit Belantamab Mafodotin (Belamaf) und VRd (DREAMM-9-Studie:MRD-Negativität mit Belamaf 1,9mg/kg Q3/4W 75% bzw. 1,9mg/kg Q6/Q8W 67%) bei nichttransplantfähigen Patient:innen sind ebenfalls aussichtsreich.37 Die Phase-III-Studie DREAMM-10 mit Belamaf-Rd versus Dara-Rd im RRMM-Setting ist in Planung.
Eine weitere Frage ist, ob CAR-T-Zellen die autologe SZT ersetzen können. Die Antwort darauf will die CARTITUDE-6-Studie geben. Sie vergleicht die Wirksamkeit von Dara-VRd gefolgt von Cilta-cel mit jener von Dara-VRd gefolgt von einer autologen SZT bei NDMM-Patient:innen.
Erhaltung
Die Erhaltungstherapie als abschließender Teil der Erstlinienbehandlung zielt darauf ab, Tumorzellen optimalerweise vollständig zu eradizieren, um damit das Risiko für ein Rezidiv zu minimieren und die Chance auf Heilung zu erhöhen. Die Zulassung von Lenalidomid (Len) als kontinuierlicher Erhaltungstherapie basiert auf einer Metaanalyse, die ein deutlich verlängertes medianes PFS von 52,8 Monaten und ein OS von etwa 2,4 Jahren gezeigt hat. Die Therapie sollte für ≥3 Jahre durchgeführt werden; der Nutzen einer zusätzlichen Len-Erhaltung ist unklar. Bei MRD-positiven Patient:innen sprechen die Ergebnisse für eine Fortführung von Len bis zum Fortschreiten der Krankheit.38,39
Resultate der CASSIOPEIA-Studie weisen darauf hin, dass die Dara-Monotherapie eine Alternative zu Len in der Erhaltungstherapie sein könnte.40 Weitere Studien untersuchen, ob die Wirksamkeit von Len durch die Kombination mit anderen Medikamenten gesteigert werden kann. Beispielsweise die Kombination mit Dara in der PERSEUS-Studie18 und mit Carfilzomib in der FORTE-Studie.41,42 So konnte aufgrund der anhaltenden MRD-Negativität (10–5) für ≥12 Monate die Dara-Erhaltungstherapie entsprechend dem Protokoll der PERSEUS-Studie beendet werden. Neben Len, Dara und Carfilzomib wird vielfach auch Bortezomib in der Erhaltungstherapie eingesetzt, vor allem bei Hochrisikopatient:innen. Einsatz und Dauer sind allerdings durch Nebenwirkungen häufig limitiert. Zudem untersuchen zum Beispiel die Studien MagnetisMM-7 (NCT05317416) und MajesTEC-4 (NCT05243797) die Anti-MM-Wirkung von Kombinationen der bispezifischen Antikörper Elranatamab oder Teclistamab mit Lenalidomid versus Len-Monotherapie in der Erhaltungstherapie.
Response- und risikoadaptierte Therapien
Der response- und risikoadaptierte Therapieansatz beim MM strebt danach, die Behandlung optimal auf individuelle Bedürfnisse der Patient:innen abzustimmen, um damit die Prognose zu verbessern und optimalerweise eine Heilung zu erreichen. Da die MRD eine Bewertung des dynamischen Risikos ermöglicht, sind neue, auf Grundlage der MRD angepasste Behandlungsstrategien entwickelt worden. Resultate der MASTER-Studie mit Dara-KRd gehörten zu den ersten, welche die Anwendbarkeit einer MRD-basierten, an das Ansprechen angepassten Konsolidierungsstrategie beim NDMM nachweisen konnten.43
Besonders Hochrisiko-MM-Patient:innen stellen im klinischen Alltag eine besondere Herausforderung auf dem Weg zu einer Heilung dar. Im Gegensatz zu Patient:innen mit Standardrisiko beträgt das OS von Hochrisikopatient:innen <3 Jahre. Resultate der PETHEMA/GEM2012MENOS65-Studie haben erstmals gezeigt, dass das Erzielen einer MRD-Negativität die schlechte Prognose von Hochrisikopatient:innen überwinden kann.44 Auch Resultate der Studien UK OPTIMUM/MUKnine45 und GMMG-CONCEPT34,35 weisen auf eine hohe Effizienz einer intensivierten Therapie mittels Quadruplet-Konsolidierung nach autologer SZT für Ultra-Hochrisiko-MM-Patient:innen hin. Langzeitresultate werden mit Spannung erwartet. Eine hohe Anti-MM-Effizienz von Dara-KRd und Dara-RVd konnte auch in einer Subanalyse der MASTER- und der GRIFFIN-Studie nachgewiesen werden, zumindest für die Subgruppen mit keiner oder einer Hochrisiko-zytogenetischen Abnormität (HRCA), jedoch nicht für die Subgruppe mit ≥2 HRCA.46 Ähnliche Resultate wurden in der Phase-II-Studie SKyLark beobachtet.47,48 Einschränkend muss erwähnt werden, dass es derzeit keine international gültigen Hochrisikokriterien als Voraussetzung für den objektiven Vergleich spezifischer Therapieformen gibt. Eine entsprechende Publikation wird noch für dieses Jahr erwartet. Aktuell rekrutiert die multizentrische randomisierte ADVANCE-Studie (NCT042 68498) für NDMM-Patient:innen. Anhand von MRD-Tests nach Abschluss der Kombinationstherapie wird im Rahmen dieser Studie Patient:innen nur dann eine autologe SZT angeboten, wenn sie nach 8x Dara-KRd oder KRd noch MRD-positiv sind. Alle anderen setzen die alleinige Erhaltungstherapie fort. Ziel dieser translationalen Studie ist es, die zugrunde liegende Biologie der anhaltenden MRD-Negativität bei MM-Patient:innen zu definieren.
Neuartige Substanzen und Präzisions-medizinische Ansätze
Neben den bereits zugelassenen CAR-T-Zell-Produkten und bispezifischen Antikörpern befindet sich noch eine Reihe von weiteren Next-Generation-CAR-T-Zell-Produkten, bispezifischen und trispezifischen Antikörpern, ADCs, Immunotoxinen, Radioimmunokonjugaten, Bcl-2-Inhibitoren und Protein-Degraders in klinischer Entwicklung. Weiterhin zielten eine Reihe von Untersuchungen darauf ab, die T-Zell-Reaktion und die hämatopoetische Regeneration zu optimieren sowie Resistenzmechanismen zu identifizieren. Auch auf Resultate von Präzisionstherapie-Studien wie der MyDrug-Studie darf man gespannt sein. ◼
Literatur:
1 Kumar SK et al.: J Natl Compr Canc Netw 2023; 21(12): 1281-301 2 Podar K, Leleu X: Cancers (Basel) 2021; 13(20): 5154 3 Easson EC, Russell MH: Br Med J 1963; 1(5347): 1704-7 4Kwan A et al.: Clin Lymphoma Myeloma Leuk 2017; 17(2): 108-19 5 Gahrton G et al.: N Engl J Med 1991; 325(18): 1267-73 6 Gahrton G et al.: Stem Cells 1995; 13(Suppl 2): 122-5 7 Barlogie B: N Engl J Med 1991; 325(18): 1304-6 8 Al Hadidi S et al.: BloodAdv2024;doi: 10.1182/bloodadvances.2024014889 (online ahead of print) 9 Puertas B et al.: Cancers (Basel) 2023; 15(5): 1558 10 Rajkumar SV: Mayo Clin Proc 2008; 83(10): 1142-5 11 Rajkumar SV et al.: Blood 2011; 118(12): 3205-11 12 Landgren O et al.: Bone Marrow Transplant 2016; 51(12): 1565-8 13Munshi NC et al.: JAMA Oncol 2017; 3(1): 28-35 14 Perrot A et al.: Blood 2018; 132(23): 2456-64 15Bahlis NJ et al.: Leukemia 2020; 34(7): 1875-84 16 Dimopoulos MA et al.: N Engl J Med 2016; 375(14): 1319-31 17Palumbo A et al.: N Engl J Med 2016; 375(8): 754-66 18 Sonneveld P et al.: N Engl J Med 2024; 390(4): 301-13 19 Kumar S et al.: Lancet Oncol 2016; 17(8): e328-46 20Flores-Montero J et al.: Leukemia 2017; 31(10): 2094-103 21Roshal M et al.: Blood Adv 2017; 1(12): 728-32 22 Diamond BT et al.: Blood Rev 2021; 46: 100732 23 Derman BA et al.: Blood Cancer J 2021; 11(2): 19 24 Revheim ME et al.: Acta Radiol 2022; 63(8): 995-1004 25 Rajkumar SV et al.: Lancet Oncol 2014; 15(12): e538-48 26Mateos MV et al.: Blood Cancer J 2020; 10(10): 102 27Pérez-Persona E et al.: Blood 2007; 110(7): 2586-92 28 Mateos MV et al.: Blood 2019; 134(suppl_1): 781 29 Mateos MV et al.: J Clin Oncol 2024; 42(27): 3247-56 30 Nadeem O et al.: Blood 2024; 144(suppl_1): 1027 31 Dimopoulos MA et al.: NEngl J Med 2024; doi: 10.1056/NEJMoa 2409029 (online ahead of print) 32 Goldschmidt H et al.: Lancet Haematol 2022; 9(11): e810-21 33 Mai EK et al.: HemaSphere 2022; 6: S3 34 Leypoldt LB et al.: J Clin Oncol 2024; 42(1): 26-37 35Weisel K et al.: Clin Lymphoma Myeloma Leuk 2019; 19(10_suppl): e17 36 Raab MS et al.: Blood 2024; 144 (suppl_1): 493 37 Usmani SZ et al.: Blood 2024; 144 (suppl_1): 931 38 McCarthy PL et al.: JClin Oncol 2017; 35(29): 3279-89 39 Jackson G et al.: Blood 2024; 144(suppl 1): 3375 40 Moreau P et al.: Lancet 2019; 394(10192): 29-38 41 Gay F et al.: J Clin Oncol 2019; 15_suppl: 8002 42 Gay F et al.: EHA Library 2019; S672 43 Costa LJ et al.: Lancet Haematol 2023; 10(11): e890-901 44 Goicoechea I et al.: Blood 2021; 137(1): 49-60 45 Kaiser MF et al.: J Clin Oncol 2023; 41(23): 3945-55 46 Callander NS et al.: Blood Cancer J 2024; 14(1): 69 47 O’Donnell E et al.: Lancet Haematol 2024; 11(6): e415-24 48 O’Donnell EK et al.: Blood 2024; 144(suppl_1): 4747
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
mCRPC: Ra-223 zu Enzalutamid – RCC: Immuncheckpoint-Rechallenge?
Beim metastasierten kastrationsresistenten Prostatakarzinom war u.a. der Late-Breaking Abstract Nummer 1, vorgestellt von Prof. Dr. Silke Gillessen, Bellinzona, spannend: DieHinzunahme ...
AxSpA: Kommunikation ist essenziell für gute Diagnosestellung und Therapie
Die axiale Spondyloarthritis (axSpA) präsentiert sich klinisch heterogen. Es treten sowohl muskuloskelettale Manifestationen auf als auch extramuskuloskelettale wie Uveitis, Psoriasis ...