Prothesenendokarditis: Zeitpunkt und Art der Therapie
Autor:
Prof. Dr. med. Dr. h.c. Omer Dzemali
Chefarzt Klinik für Herzchirurgie
Stadtspital Zürich Triemli
Birmensdorferstrasse 497, 8063 Zürich
E-Mail: omer.dzemali@triemli.zuerich.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit einer Letalität von 20–60% ist die infektiöse Endokarditis (IE) auch heute noch eine sehr ernst zu nehmende Erkrankung. Bei ca. 10–30% aller Fälle handelt es sich hierbei um Infektionen an implantierten künstlichen Herzklappen. Die Prognose ist entscheidend von der unverzüglichen Einleitung einer effektiven und adäquaten Therapie abhängig. Umfangreiche Aufklärung und Fortschritte hinsichtlich Prävention, Diagnostik und Therapie sollten in der Zukunft dazu beitragen, die Prognose weiter zu verbessern. Dennoch ist der Durchbruch bei der Behandlung bei Weitem nicht erreicht und trotz etablierter Leitlinien steigt die Anzahl der infektiösen Endokarditiden stetig an.
Keypoints
-
Die Infektion künstlicher Herzklappen stellt eine schwerwiegende Komplikation der Herzklappenchirurgie dar und ist mit einer besonders hohen Letalität assoziiert.
-
Die aktuellen Leitlinien können durch erste randomisierte Studien von chirurgisch sanierten Prothesenendokarditiden sowie modernen bildgebenden Verfahren mit einer verbesserten Diagnostik, insbesondere aus dem Bereich der Nuklearmedizin, gestützt werden.
-
Die Prothesenendokarditis sollte heute als multidisziplinäre Erkrankung verstanden und therapiert werden, sodass die Behandlung und Betreuung der betroffenen Patienten an einem Referenzzentrum und durch spezialisierte Teams (Endokarditis-Team) der beteiligten Fachdisziplinen erfolgen sollten.
Einteilung und Ätiologie
Grundsätzlich teilt man die Prothesen-endokarditis (PVE) in eine frühe und eine späte Form ein. Diese Einteilung ist arbiträr: Während Lopez et al. das Auftreten eines solchen Ereignisses innerhalb von 365 Tagen als frühe Endokarditis definieren, bezeichnen viele Autoren eine Endokarditis innerhalb von 60 Tagen als postoperative Endokarditis.1,2 Solch eine Einteilung hat sich aber im klinischen Alltag, aufgrund der verschiedenen Therapieoptionen und Behandlungsergebnisse, gut bewährt.
Die Ursachen bei der frühen Form dieser Endokarditiden sind eher bei postoperativen Kontaminationen während der Hospitalisation zu suchen, wie z.B. Infektionen am Blasenkatheter oder zentralen Venenkatheter, Wundinfektionen oder etwaige postoperative Pneumonien, was auch das nosokomiale Keimspektrum erklären würde. Bei der späten Form handelt es sich in den meisten Fällen um das gleiche Keimspektrum wie bei der nativen Endokarditis. Als Ursache sind hierbei häufig invasive Eingriffe, die eine Endokarditisprophylaxe benötigen, wie z.B. zahnärztliche Eingriffe, gastrointestinale oder urologische Eingriffe etc. zu nennen.
Die Aortenklappenprothese ist mit ca. 60% die am meisten betroffene Prothese, gefolgt von der Mitralklappenprothese mit ca. 30%, und bei den übrigen 10% handelt es sich um Mehrfachklappenprothesenendokarditiden. Die biologischen Prothesen sind etwas häufiger betroffen als die mechanischen Prothesen.3
Hoen et al. zeigten in ihrer Publikation im «New England Journal of Medicine», dass Patienten nach Klappenimplantation die höchsten Raten an infektiösen Endokarditiden aufwiesen.4 Als PVE ist dabei jede Infektion einer biologischen, mechanischen Kunstklappe, einer rekonstruierten Herzklappe oder eines Homografts definiert. Die Ursachen werden meistens im turbulenten Blutfluss am Nahtring (vornehmlich bei mechanischen Klappen) und dem noch nicht endothelialisierten Übergang zum nativen Gewebe (biologische Prothesen) vor allem bei frühen PVE gesehen.
Die Infektionsübertragung erfolgt meistens durch die direkte Kontamination während der Operation oder durch die indirekte Kontamination über den Blutweg.5 Rutledge et al. haben gezeigt, dass die klinisch-pathologischen Befunde bei PVE folgendermassen verteilt sind:6
-
Prothesendysfunktion 44%
-
Klappenringabszesse 54%
-
Myokardabszesse 38%
-
Klappendehiszenzen 38,5%
-
Klappenvegetationen 11,5%
Durch die infektionsbedingte Strukturveränderung des Kollagens wird die Haltbarkeit der biologischen Prothesen deutlich verkürzt. Bei PVE sind Staphylokokken (Staph. epidermidis) und Pilze wahrscheinlich, aufgrund der zunehmenden Zahl nosokomial- bzw. Gesundheitssystem-vermittelter erworbener Endokarditiden, die am häufigsten anzutreffenden Keime.7 Bei der späten Form finden sich vor allem Staphylokokken, Streptokokken (Strept. viridans) oder Enterokokken. Eine Sondersituation stellen bei der «late-PVE» die kulturnegativen Endokarditiden dar, was häufig auf eine bereits eingeleitete antibiotische Therapie zurückzuführen ist.
Klinik und Diagnose
Wie bei der nativen Endokarditis ist auch bei der PVE die Symptomatik durch allgemeine Infektionszeichen geprägt. Die PVE kann sich klinisch abhängig von der Dauer des Zeitraumes nach der initialen Protheseninmplantation (früh vs. spät) unterschiedlich präsentieren. Zu den unspezifischen Beschwerden zählen meistens Fieber, Schwitzen, Leistungsschwäche, Abgeschlagenheit, Krankheitsgefühl, Appetitlosigkeit und Müdigkeit. Sowohl bei Fieber als auch bei neu aufgetretenem Herzgeräusch bei Patienten mit Herzprothese sollte eine PVE ausgeschlossen werden. Zu etwas spezifischeren Symptomen zählen Irritationen des Reizleitungssystems, Mikro- und Makroembolien mit möglichen septischen Metastasierungen, sowie zerebrovaskuläre Pathologien. Um diese oftmals unspezifischen Symptome mit der Verdachtsdiagnose einer Endokarditis vereinbaren zu können, wurden 1994 die Duke-Kriterien entwickelt und im Jahr 2000 von Li et al. modifiziert. Diese können helfen, wenn eine Diagnose nicht oder nicht mit hinreichender Zuverlässigkeit gestellt werden kann. Sie sichern aber, wie alle Scoresysteme, keine Diagnose, sondern machen aufgrund statistischer Überlegungen die Diagnose mehr oder weniger wahrscheinlich.8
Klinische Zeichen, bildgebende Verfahren und die Laborbefunde sind die drei wichtigsten Tools zur Diagnosesicherung.
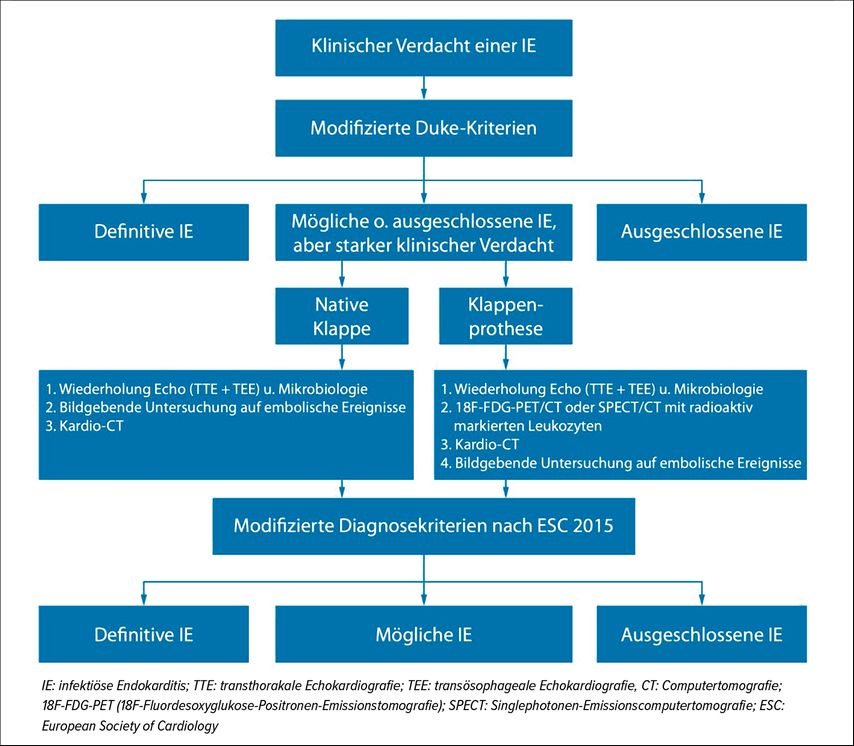
Die beiden Hauptpfeiler der PVE-Diagnostik sind Blutkulturen zur Detektion einer systemischen Infektion und der spezifische echokardiografische Nachweis von intrakardialen Vegetationen, neu aufgetretenen Klappeninsuffizienzen und vorhandenen Abszessen. Eine Verbesserung der Bildgebung hat zur besseren Detektion der endokardialen Beteiligungen der IE geführt. Eine echokardiografische Untersuchung sollte bei allen Patienten mit klinischem Verdacht auf Endokarditis durchgeführt werden, wobei die transösophageale Echokardiografie (TEE) der transthorakalen Echokardiografie (TTE) meist überlegen ist und den goldenen Standard darstellen sollte. Ergänzend zur Echokardiografie finden sich in den neuen Leitlinien auch CT und PET-CT als Bildgebung und wurden in die modifizierten Duke-Hauptkriterien aufgenommen (Abb. 1). F-FDG-PET oder SPECT-CT mit radioaktiv markierten Leukozyten erhöhen die Sensitivität für die Diagnostik einer PVE.9 Aufgrund von unspezifischen Entzündungsreaktionen postoperativ kann dieses Verfahren allerdings erst drei Monate nach erfolgtem Eingriff sinnvoll und zielführend angewendet werden.
Abb. 1: Diagnostischer Algorithmus bei Patienten mit Verdacht auf eine infektiöse Endokarditis (modifiziert nach Haghikia et al., 2013)15
Die Komplexität der Diagnostik und Behandlungsentscheidung hat dazu geführt, dass in den neuen Leitlinien neben einem Endokarditis-Team auch ein sogenanntes «Referenzzentrum» einen Platz in der Behandlungskette eingenommen hat. Diese Massnahmen haben zur Erhöhung der Behandlungsqualität und zu einem Rückgang der Mortalität geführt.10
Therapie
Das therapeutische Ziel bei der infektiösen Endokarditis ist einerseits die Beseitigung der verursachenden Erreger (Abszess- und Herdbeseitigungen) und andererseits die Rekonstruktion von kardialen und extrakardialen Strukturen sowie die Korrektur abnormer Turbulenzen im Blutfluss, wodurch die Morbidität und Letalität reduziert werden können.
Medikamentöse Therapie
Voraussetzung für eine erfolgreiche medikamentöse Therapie sind die mikrobiologische Keimidentifikation und spezifische resistenzgerechte Antibiotikatherapie. Bei der richtigen Wahl der Antibiotika, die für den Behandlungserfolg ausschlaggebend ist, sind verschiedene Gesichtspunkte zu berücksichtigen. Wichtige Kriterien sind die Art, die Wirksamkeit, die Sicherheit, die Verträglichkeit und auch die Kosten der verschiedenen Antibiotika. Bei der medikamentösen Behandlung ist auch den spezifischen Besonderheiten der infektiösen Endokarditis Rechnung zu tragen. Ein Nachteil aller aktuellen Therapieempfehlungen ist, dass es zwar neue Substanzen gibt, jedoch keine entsprechenden Therapie- bzw. Zulassungsstudien. In der aktuellen Literatur finden sich kleinere, aber sehr interessante Endokarditis-Studien, die aufgrund ihres Designs keinen Einfluss auf die entsprechenden Guidelines haben. Die sehr lange als obligat angesehene Kombination eines Betalaktam-Antibiotikums mit einem Aminoglykosid wird in den neuen Leitlinien bei Streptokokken-Endokarditiden und Nativklappenendokarditiden, verursacht durch empfindliche Staphylokokken, nicht mehr empfohlen.9 Bei den Enterokokken-Endokarditiden sollte eine Kombinationstherapie mit Aminoglykosid und Ceftriaxon erfolgen. Mittlerweile ist die Gabe von Vancomycin bei Methicillin-empfindlichen Staphylokokkeninfektionen nicht mehr Bestandteil der aktuellen Leitlinien. Unterdessen gibt es interessante Entwicklungen wie z.B. die Einführung von neuen Lipoglykopeptiden oder anderen neuen Substanzen sowie deren Verabreichungsdauer und -art. Sie weisen vorrangig vielversprechende Ergebnisse auf, obwohl die Verwendung dieser Substanzen noch nicht mit entsprechenden wissenschaftlichen Quellen belegt sind.9
Bei dieser Vielzahl von Optionen gilt es aber immer noch, dass die Behandlung der Endokarditis auch nach der operativen Sanierung noch vier bis sechs Wochen lang fortgesetzt werden soll, da die Elimination der Erreger in vivo langsamer erreicht wird als unter In-vitro-Bedingungen.
Chirurgische Therapie
Etwa 50% aller Patienten mit PVE sind mit antibiotischer Therapie alleine nicht ausreichend behandelt und müssen wegen schwerer Komplikationen operativ saniert werden.11 Die moderne Herzchirurgie hat der Behandlung der infektiösen Endokarditis eine neue Dimension eröffnet. Die chirurgische Therapie kann den progredienten Krankheitsverlauf durch Normalisierung der abnormen Turbulenz- und Strömungsverhältnisse positiv beeinflussen. Hauptziele hierbei sind die Vermeidung einer progressiven Herzinsuffizienz, einer infektionsbedingten Zerstörung kardialer Strukturen und Embolisationen lebenswichtiger Organe. Die Entscheidung für eine chirurgische Behandlung basiert individuell auf dem Krankheitsverlauf, dem Schweregrad der Gewebedestruktion, dem hämodynamischen Zustand des Patienten und den aufgetretenen Komplikationen.
Die aktuellen Leitlinien heben die Bedeutung von präoperativer Risikostratifizierung mittels gängiger Risikoscores (z.B. EuroSCORE II, STS) hervor. Einen besonderen Stellenwert hat hierbei das «Endokarditis-Team». Obwohl Embolisationen, insbesondere innerhalb der ersten zwei Wochen, sehr häufig sind (20–50%), wird die Indikation zur frühen Operation nach wie vor kontrovers diskutiert. In der Studie von Kang et al. wurde aber gezeigt, dass eine Operation innerhalb von 48 Stunden nach der Diagnose die Embolisationsrate signifikant senken konnte.12 Paravalvuläre Abszesse und die durch die Infektion bedingte Herzinsuffizienz sind zwei weitere klinische Auswirkungen, die eine chirurgische Therapie notwendig machen können. Durch eine chirurgische Intervention kann erfolgreich eine Exklusion einer Abszedierung aus der Zirkulation oder ein Debridement der Abszedierung von benachbartem infiziertem Gewebe erzielt werden.
Die progrediente Herzinsuffizienz stellt in 85–97% der Fälle eine Indikation zur chirurgischen Therapie dar.13 Horstkotte et al. haben gezeigt, dass die kumulative Überlebensrate der Patienten mit Aortenklappen-Endokarditis und Herzinsuffizienz deutlich höher war, wenn bei den Patienten frühzeitig ein Klappenersatz durchgeführt wurde.7 Auch bei Erkrankungen der Mitralklappe war dieser Unterschied signifikant. Nach Saby et al. ist die Mortalitätsrate nach einem operativen Eingriff bei hämodynamisch stabilen Patienten niedriger als 5%, während die Mortalität bei instabilen Patienten auf 30% stieg. Die Indikation zur chirurgischen Therapie sollte in einer solchen Situation früh gestellt werden, da diese Patienten besonders gefährdet sind.
Die gut ausgewählte antibiotische Therapie erlaubt uns, eine Verbesserung der Infektionszeichen innerhalb von 72 Stunden zu erwarten. Tritt dies nicht ein, handelt es sich in den meisten Fällen um intrakardiale oder extrakardiale Abszedierungen. Diese unkontrollierten Infektionsherde stellen neben der Herzinsuffizienz die wichtigste absolute Indikation zur chirurgischen Therapie dar. Sind Pilze die Ursache der Infektion, so ist dies eine absolute Indikation zur chirurgischen Therapie, da die antimykotische Therapie oft für eine Restitution nicht effektiv genug ist, was auch an der Immunabwehr dieser Patienten liegt. Eine chirurgische Behandlung während der aktiven Infektion hat dasselbe Risiko wie eine chirurgische Behandlung, die nach der akuten Phase des Krankheitsverlaufs durchgeführt wird. Ischämische und hämorrhagische neurologische Ereignisse haben einen entscheidenden Einfluss auf die Wahl des optimalen Operationszeitpunktes. In den neuesten Leitlinien haben auch Transkatheterklappen (TAVI), welche analog zu chirurgischen Klappenprothesen zu behandeln sind, ihren Platz eingenommen. Obwohl die meisten TAVI-Patienten deutliche Nebenerkrankungen aufweisen, sollte v.a. bei hochgradiger Protheseninsuffizienz eine operative Therapie in Erwägung gezogen werden.
Trotz und auch wegen all dieser beschriebenen Erkenntnisse sollte das Endokarditis-Team den klinischen Zustand des Patienten zum Zeitpunkt der Indikationsstellung für oder gegen eine Operation in den Vordergrund stellen, um Komplikationen möglichst zu minimieren oder zu vermeiden.14
Literatur:
1 Lopez J et al.: Definition, clinical profile, microbiological spectrum, and prognostic factors of early-onset prosthetic valve endocarditis. Eur Heart J 2007; 28: 760-5 2 Englberger L, Carell T et al.: Prothesenendokarditis – Inzidenz, Diagnostik und Therapie. Z Herz Thorax Gefässchir 2000; 14: 4-12 3 Gilbert H et al.: Prosthetic valve endocarditis: current approach and therapeutic options. Prog Cardiovasc Dis 2008; 50: 274-81 4 Hoen B et al.: Infective Endocarditis. N Engl J Med 2013; 368: 1425-33 5 Gordon SM, Keys TF et al.: Bloodstream infections in patients with implanted prosthetic cardiac valves. Semin Thorac Cardiovasc Surg 1995; 7: 2-6 6 Rutledge R et al.: Actuarial analysis of the risk of prostetic valve endocartitis in 1,598 patients with mechanical and bioprosthetic valves. Arch Surg 1985; 120: 469-72 7 Horstkotte D et al.: Late prosthetic valve endocarditis. Eur Heart J 1995; 16: 39-47 8 Frantz S et al.: Kommentar zu den 2015-Leitlinien der Europäischen Gesellschaft für Kardiologie zur infektiösen Endokarditis. Kardiologe 2016; 10: 142-8 9 Saby L et al.: Positron emission tomography/computed tomography for diagnosis of prosthetic valve endocarditis: increased valvular 18F-fluorodeoxyglucose uptake as a novel major criterion. J Am Coll Cardiol 2013; 61: 2374-82 10 Mylotte DAA et al.: Transcatheter heart valve failure: a systematic review. Eur Heart J 2015; 36: 1306-27 11 Tornos P et al.: Infective endocarditis in Europe: lessons from the Euro heart survey. Heart 2005; 91: 571-5 12 Kang DH et al.: Early surgery versus conventional treatment for infective endocarditis. N Engl J Med 2012; 366: 2466-73 13 Lefort A et al.: Activities of dalbavancin in vitro and in a rabbit model of experimental endocarditis due to Staphylococcus aureus with or without reduced susceptibility to vancomycin and teicoplanin. Antimicrob Agents Chemother 2004; 48: 1061-4 14 Thuny F et al.: Management of infective endocarditis: challenges and perspective. Lancet 2012; 379: 965-75 15 Haghikia A et al.: Infektiöse Endokarditis. Z Herz- Thorax- Gefässchir 2018; 32: 103-10
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Labormedizinische Fallstricke bei kardialen Markern
Bei Schädigung oder Stress des Herzmuskels werden kardiale Marker in den Blutkreislauf freigesetzt. Ihre labormedizinische Bestimmung spielt eine Schlüsselrolle in der Diagnostik, ...