Telemedizin und kardial implantierbare Devices in Zeiten von Covid-19
Autorin:
Univ.-Prof. Dr. med. Marianne Gwechenberger
Universitätsklinik für Innere Medizin II
Klinische Abteilung für Kardiologie
Medizinische Universität Wien
Telemedizin ist ein Sammelbegriff für verschiedenste ärztliche Versorgungskonzepte, bei denen medizinische Leistungen über eine räumliche Entfernung erbracht werden, dabei werden Informations- und Kommunikationstechnologien eingesetzt. Die vorliegende Arbeit beschäftigt sich mit der telemedizinischen Betreuung von Patienten mit kardial implantierbaren elektronischen Geräten (CIED).
Keypoints
-
Die telemedizinische Betreuung von Patienten mit CIED ist sicher und effektiv.
-
Telemonitoring (auch «remote monitoring», RM) erlaubt die frühzeitige Erkennung von Aggregat- und Elektrodenfehlfunktionen, die Detektion klinisch relevanter Ereignisse wie atrialer und ventrikulärer Arrhythmien, aber auch eine frühzeitige Erkennung kardialer Dekompensationen bei Herzinsuffizienz.
-
RM kann die ambulanten Kontrollen, die Hospitalisierungsraten und die Mortalität senken.
-
Speziell während der Covid-19-Pandemie ist es sinnvoll, die Patienten mittels RM zu betreuen und so das Infektionsrisiko zu senken und die Ambulanzen zu entlasten.
Vor allem zu Beginn der Covid-19-Krise wurden etliche geplante Operation, aber auch ambulante Untersuchungen abgesagt oder verschoben. Die Mehrheit der Patienten mit CIED («cardiac implantable electronic devices») zählt jedoch zur Risikogruppe. Viele Patienten waren verunsichert und wollten keine ambulanten Kontrollen. Durch die telemedizinische Versorgung kann das Risiko einer Covid-19-Erkrankung gesenkt werden, die Geräte können telemedizinisch überprüft und Ambulanzen entlastet werden.
Trotz der Evidenz der Vorteile der Telemedizin erfolgte die Implementation vor allem in Europa eher langsam und die meisten Nachsorgen finden im Spitalssetting statt. In den ESC-Guidelines von 2013 erhielt die telemedizinische Überwachung von CIED eine Klasse-IIa-Indikation.1 Es ist jedoch zu erwarten, dass sie in den demnächst erscheinenden neuen Guidelines eine Klasse-I-Indikation erhalten wird. So wurde bereits im ESC-Positionspapier «ESC Guidance for the Diagnosis and Management of CV Disease during the Covid-19 Pandemic» empfohlen, das Home Monitoring so oft wie möglich einzusetzen.2 In den USA hat die Heart Rhythm Society bereits 2015 eine Klasse-I-Empfehlung ausgesprochen.3 Auch die Arbeitsgruppe für Rhythmologie der österreichischen kardiologischen Gesellschaft hat kürzlich ein Positionspapier zu Telemedizin verfasst.4 Durch die Covid-19-Krise kam es zu einem massiven Schub der Telemedizin und weitreichender Anwendung.
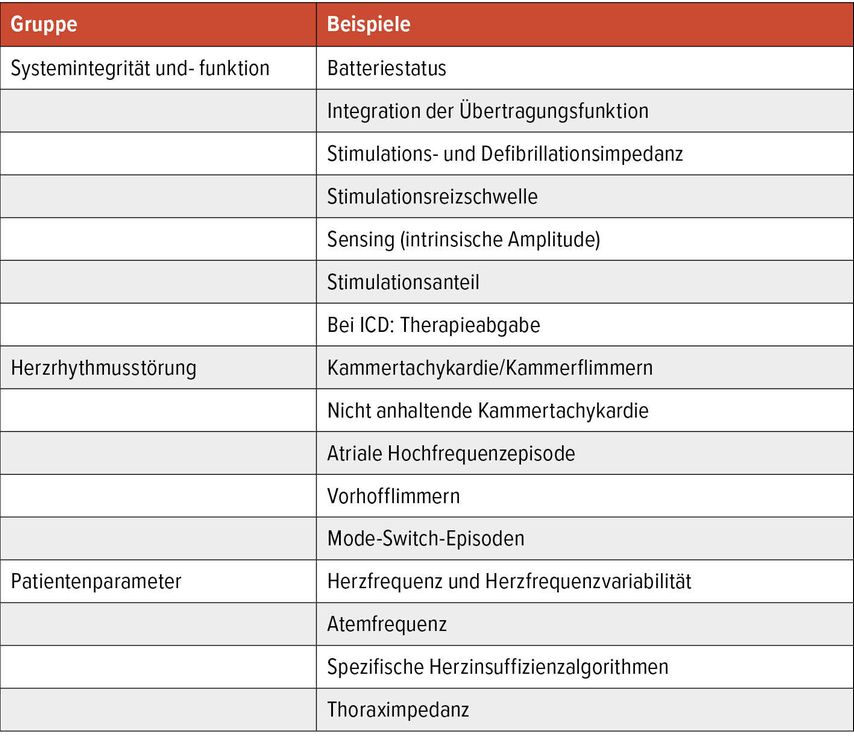
Alle Hersteller von Schrittmachern (PM), implantierbaren Defibrillatoren (AICD), kardialer Resynchronisationstherapie (CRT), Looprekordern, aber auch von pulmonaler Druckmessung (Cardio MEMS) bieten Telemedizin an. Es können nicht nur Parameter der Systemintegrität und -funktion, sondern auch für das Patientenmanagement wichtige Daten überprüft werden (Tab. 1). So können nicht nur frühzeitig Arrhythmien erkannt und so rasche Therapieanpassungen eingeleitet werden, sondern es kann auch in zunehmendem Ausmass das Herzinsuffizienzmanagement verbessert werden. Das führt nicht nur zu einer Kostenreduktion durch den Wegfall ambulanter Kontrollen, sondern kann, bei konsequenter Anwendung, auch zu einer Senkung von Krankenhausaufenthalten und der Mortalität führen.5,6
Tab. 1: Beispiel für Parameter der Systemintegrität und -funktion sowie für das Patientenmanagement wichtiger Daten, die von Systemen zur telemedizinischen Auswertung zur Verfügung gestellt werden
Es muss zwischen einer «remote interrogation» (RI), bei der oft nur viertel- oder halbjährliche Übertragungen stattfinden, und der engmaschigen (täglichen bis wöchentlichen) telemedizinischen Fernüberwachung, «remote monitoring» (RM), von technischen und klinischen Parametern unterschieden werden. Selbstverständlich müssen die Daten zeitnah analysiert werden und zu präspezifizierten therapeutischen Konsequenzen führen. Nicht alle Studien haben die tägliche oder wöchentliche Übertragung untersucht, sondern oft nur halbjährliche Übertragungen durchgeführt, was einer RI entspricht. Dadurch können auch die unterschiedlichen Ergebnisse der Studien erklärt werden.
Studienlage
Elektroden und Generatormonitoring
Die Guidelines der Heart Rhythm Society (HRS) geben eine Klasse-I-Empfehlung für das RM zur Elektroden- und Batterieüberwachung ab.3
Zunächst wurde in randomisierten Studien die Nichtunterlegenheit im Vergleich zu herkömmlichen Routinekontrollen untersucht. In der COMPAS-Studie wurden 568 PM-Patienten eingeschlossen. Der primäre Endpunkt war das Auftreten eines «major adverse event» (Gesamtmortalität, gerätebedingte Hospitalisierung oder unerwünschtekardiovaskuläre Ereignisse) und trat in 17,3% der RM-aktiven Gruppe und in 19,1% der Kontrollgruppe auf (p<0,01 für Nichtinferiorität). Die Zahl der ambulanten Kontrollen war in der RM-Gruppe um 56% reduziert (p<0,001) und Änderungen in der Programmierung wurden in 62% der RM-Gruppe und in 29% der Kontrollgruppe durchgeführt (p<0,001).7
Durch das RM konnte in einer retrospektiven Studie eine längere Batterielaufzeit beobachtet werden.8
In der TRUST-Studie wurden 1339 Patienten mit einem ICD untersucht. Die Zahl der Spitalsvisiten war hochsignifikant um fast die Hälfte reduziert, hinsichtlich der Mortalität und der Schlaganfälle fand sich kein Unterschied. Diese Effekte zeigten sich auch bei Patienten in der NYHA-Klasse III/IV. Gleichzeitig konnten mittels RM Device-assoziierte Probleme wie z.B. Sondenbrüche oder Batterieerschöpfung frühzeitig erkannt werden.9
Diese Ergebnisse wurden in zahlreichen Studien, aber auch in grossen Registern bestätigt.
Reduktion der Ereignis-Reaktion-Zeit, Arrhythmiemanagement und Mortalität
Die schnelle Reaktion auf Ereignisse ist ein essenzieller Vorteil des RM. So kann bei der Detektion von Vorhofflimmern frühzeitig mit der Antikoagulation begonnen werden und rasch eine Behandlungsstrategie (medikamentöse Therapie, Kardioversion, Ablation) eingeleitet werden. Bei ventrikulären Arrhythmien kann evaluiert werden, ob eine Therapie effektiv, zweckmässig oder nicht zweckmässg war (z.B. T-Wellen-«Oversensing», magnetische Interferenz, keine ventrikulären Arrhythmien etc.), und das Gerät gegebenenfalls rechtzeitig umprogrammiert werden.
In der TRUST-Studie fand die Evaluierung der Arrhythmien in der RM-Gruppe innerhalb von <2 Tagen statt, während sie in der konventionellen Gruppe 36 Tage in Anspruch nahm (p<0,001), und sie war für alle Arrhythmien (Vorhofflimmern, ventrikuläre Tachykardie, Kammerflimmern, supraventrikuläre Tachykardie) nachweisbar.9 Auch in der CONNECT-Studie fand sich einesignifikante Reduktion der Zeit vom klinischen Ereignis bis zur klinischen Entscheidung von 22 Tagen im Ambulanzarm auf 4,9 Tage im RM-Arm (p<0,001). Ebenso konnte die Dauer des stationären Aufenthaltessignifikant reduziert werden (p=0,002).10
In der COMPAS-Studie fanden sich signifikant weniger Hospitalisierungen aufgrund von Arrhythmien (6 vs. 18) und Schlaganfällen (2 vs. 8 resp. 0,8% vs. 3,3%; p<0,05).7
Die ECOST-Studie zeigte eine signifikante Reduktion der zweckmässigen und nicht zweckmässigen Schocks um 71% in der RM-Gruppe gegenüber der Kontrollgruppe (p=0,02). Des Weiteren fand sich auch eine Reduktion der nicht zweckmässigen Schocks um 52% in der Gruppe mit «remote monitoring» (5% in der RM-Gruppe vs. 10,4% in der Kontrollgruppe; p=0,04), und die Hospitalisierungsrate aufgrund von nicht zweckmässigen Schocks konnte um 72% gesenkt werden. Die Batterielebensdauer des Generators konnte aufgrund der Verminderung der Kondensatorladungen um 7,9 Monate verlängert werden (95% CI: 2,6–13,2; p=0,005).11
In die IN-TIME-Studie wurden 664 Patienten mit einer LVEF <35% mit einem ICD oder CRT-D eingeschlossen. Der kombinierte primäre Endpunkt aus Gesamtmortalität, Hospitalisierung wegen Herzinsuffizienz, Verschlechterung der NYHA-Klasse und Verschlechterung der Patientenselbsteinschätzung trat signifikant seltener in der telemedizinisch betreuten Gruppe auf als in der konventionellen Gruppe. Es konnte erstmalig auch eine signifikant niedrigere Mortalität gezeigt werden.12
Die ALTITUDE-Survival-Studie untersuchte 185778 Patienten mit einem ICD, CRT-D und CRT-P und konnte ebenfalls zeigen, dass die 1- und die 5-Jahres-Mortalität durch die telemedizinische Betreuung signifikant gesenkt werden konnten.13
Das RM konnte auch die Mortalität bei Herzinsuffizienzpatienten in einer Real-World-Kohorte (All-Comers-COMMIT-Studie) signifikant senken.14
Eine Metaanalyse der TRUST-, ECOST- und IN-TIME-Studie demonstrierte die positive Rolle des RM bei der Senkung der Gesamtmortalität sowie beim kombinierten Endpunkt aus Gesamtmortalität und Hospitalisierung aufgrund einer sich verschlechternden Herzinsuffizienz.15
Hingegen konnte die MORE-CARE-Studie keinen Mortalitätsvorteil zeigen.16 Allerdings wurden in dieser Studie Patienten mit einer weiter fortgeschrittenen Herzinsuffizienz eingeschlossen. Es scheint, dass die Patientenselektion, aber auch das Kontrollintervall und die Reaktion auf Ereignisse wichtig sind für das Outcome. So konnte eine Metaanalyse zeigen, dass eine engmaschige telemedizinische Kontrolle und eine strukturierte Behandlungssequenz die Gesamtmortalität senken.17
Herzinsuffizienz
Die frühzeitige Detektion einer beginnenden Verschlechterung der Herzinsuffizienz ist ein vordringliches Ziel in der Behandlung von Patienten mit Herzinsuffizienz, um durch eine rasche Intervention die Patienten zu stabilisieren und Hospitalisationen zu verhindern; dabei kann das RM hilfreich sein. Im Falle einer CRT ist eine nahezu 100%ige biventrikuläre Stimulation ausschlaggebend für das Ansprechen auf die Therapie. Sollte der Stimulationsanteil z.B. durch das Auftreten von Arrhythmien abfallen, kann dies durch das RM frühzeitig detektiert werden und es kann therapeutisch eingegriffen werden. Des Weiteren können die Thoraximpedanz, die Herzfrequenzvariabilität und die Atemfrequenz als Surrogatparameter für eine sich verschlechternde Herzinsuffizienz dienen. Die Thoraximpedanz korreliert mit dem pulmonalarteriellen Wedge-Druck und kann so auf eine drohende kardiale Dekompensation hinweisen. Allerdings sind im klinischen Alltag die teilweise extrem niedrige Sensitivität und Spezifität sowie die hohe Rate an falsch positiven Alarmen problematisch, und es konnte in randomisierten Studien kein Überlebensvorteil gefunden werden.18,19 Es ist daher das Bestreben, durch die Verbindung mehrerer Messparameter, die Sensitivität und Spezifität zu verbessern. So konnte Vamos bei 42 CRT-D-Patienten zeigen, dass durch die Kombination von OptiVol mit einem niedrigen Aktivitätslevel, einem geringeren biventrikulären Stimulationsanteil und einer hohen nächtlichen Herzfrequenz die Spezifität von 37,5 auf 86,5% und der positive prädiktive Wert von 34,1 auf 69,8% gesteigert werden könnten.20
Ein neuer, vielversprechender Herzinsuffizienzalgorithmus (Heart LogicTM, Boston Scientific) verbindet mehrere physiologische Sensoren (Messung des 1. und 2. Herztons, Atemfrequenz, Atemvolumen, Patientenaktivität, Thoraximpedanz). In der MULTISENSE-Studie mit 900 Patienten konnte er eine 70%ige Sensitivität aufweisen und die Warnung vor einer drohenden Verschlechterung erfolgte im Median 34 Tage vor einem Herzinsuffizienzereignis, bei gleichzeitig wenigen falsch positiven Meldungen.21 Die Herzinsuffizienzereignisrate war 10-fach erhöht, wenn die Patienten einen «IN»-Alarm hatten. Die Aktivierung des HeartLogic-Algorithmus führte in einer aktuellen Studie mit 68 Patienten und einem 1-Jahres-Follow-up zu einer signifikanten Reduktion der Hospitalisierungsrate von 27 in der Präaktivierungsphase auf 7 in der Postaktivierungsphase (p=0,003). In einer Subanalyse zeigte sich eine Reduktion der gesundheitsökonomischen Kosten (p=0,025).22
Die kontinuierliche pulmonalarterielle Druckmessung mittels eines in der Pulmonalarterie liegenden Sensors konnte eine signifikante Reduktion der Hospitalisierungsrate und der Mortalität zeigen.23,24 Auch Patienten mit einer LVEF >40% mussten seltenerhospitalisiert werden.
RM und Covid-19
In den RM-Studien während der Covid-19-Pandemie fanden sich unterschiedliche Ergebnisse. Während eine multizentrische Kohortenstudie in den USA eine signifikante Reduktion ventrikulärer Arrhythmien um 32% fand, konnten Krumholz und eine italienische Studie keinen signifikanten Unterschied bei Arrhythmien zeigen.25–27 In dänischen nationalen Datenregistern fand sich ein Rückgang von neu diagnostiziertem Vorhofflimmern um 47% während der Pandemie und es wurde eine «Unterdiagnose» vermutet, auch wenn ein realer Rückgang nicht ausgeschlossen werden konnte. Eine britische Studie zeigte bei Patienten mit einem implantierten Looprekorder eine signifikante Zunahme von Patienten-initiierten Übertragungen, auch wenn die meisten davon keine Arrhythmien aufwiesen. Insgesamt fand sich trotzdem eine 5-fache Häufung von arrhythmogenen Ereignissen, wobei die meisten Arrhythmien Vorhofflimmern, Schmalkomplextachykardien und ventrikuläre Ektopie waren. Es wurden keine anhaltenden VT beobachtet.28 Wir haben in einer multizentrischen, österreichweiten Studie die RM-Daten von Patienten mit einem ICD/CRT-D während der Covid-19-Pandemie von Februar 2020 bis Mai 2020 analysiert und die Ergebnisse mit dem Vergleichszeitraum 2019 verglichen. Es fand sich ein signifikanter Rückgang von SVT und aller ventrikulären Arrhythmien (VT1, VT2 und VF) zusammengefasst, jedoch kein Unterschied im Auftreten von Vorhofflimmern (Manuskript in Vorbereitung).
Zusammenfassung
Die Covid-19-Pandemie hat einen enormen Schub in der Anwendung und Akzeptanz der Telemedizin gebracht. Klinische Studien konnten belegen, dass die Telemedizin nicht nur sicher und effektiv ist, sondern auch durch die frühzeitige Erkennung von technischen Problemen bzw. Patientenereignissen wie z.B. Arrhythmien, die Mortalität und Hospitalisierungsrate senken kann. Allerdings sind eine engmaschige Übertragung und klar strukturierte Konsequenzen von spezifischen Befundkonstellationen erforderlich. Besonders während der Covid-19-Pandemie können die Patienten durch das RM vor einer Infektion geschützt und die Ambulanzen entlastet werden.
Literatur:
1 Brignole M et al.: 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J 2013; 34: 2281-329 2 ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic ( escardio.org ) 3 Slotwiner D et al.: HRS Expert Consensus Statement on remote interrogation and monitoring for cardiovascular implantable electronic devices. Heart Rhythm 2015; 12: e69-e100 4 Gruska M et al.: Recommendations on the utilization of telemedicine in cardiology. Wien Klin Wochenschr 2020; 132: 782-800 5 Capucci A et al.: Economic impact of remote monitoring after implantable defibrillators implantation in heart failure patients: an analysis from the EFFECT study. Europace 2017; 19: 1493-9 6 Ladapo JA et al.: Health care utilization and expenditures associated with remote monitoring in patients with implantable cardiac devices. Am J Cardiol 2016; 117: 1455-62 7 Mabo P et al.: A randomized trial of longterm remote monitoring of pacemaker recipients (the COMPAS trial). Eur Heart J 2012; 33: 1105-11 8 Ricci R et al.: Effect of daily remote monitoring on pacemaker longevity: a retrospective analysis. Heart Rhythm 2015; 12: 330-7 9 Varma N et al.: Efficacy and safety of automatic remote monitoring for implantable cardioverter-defibrillator follow up: the LUMOS-T safely reduces routine office device follow up (TRUST trial). Circulation 2010; 122: 325-32 10 Crossley GH et al.: The CONNECT trial: the value of wireless remote monitoring with automatic clinician alerts. JACC 2011; 57: 1181-91 11 Guedon-Moreau L et al.: A randomized study of remote follow up of implantable cardioverter defibrillators: safety and efficacy report of the ECOST trial. Eur Heart J 2012; 34: 605-14 12 Hindricks G et al.: Implant-based multiparameter telemonitoring of patients with heart failure (IN-TIME): a randomized controlled trial. Lancet 2014; 384: 583-90 13 Saxon LA et al.: Longterm outcome after ICD and CRT implantation and influence of remote monitoring device follow up. The Altitude Survival study. Circulation 2010; 122: 2359-67 14 Kurek A et al.: Impact of remote monitoring on longterm prognosis in heart failure patients in a real-world cohort: results from the All-Comers COMMIT-HF trial. J Cardiovasc Electrophysiol 2017; 28: 425-31 15 Hindricks G et al.: Daily remote monitoring of implantable cardioverter-defibrillator: insights from three randomized trials (IN-TIME, ECOST, TRUST). Eur Heart J 2017; 38: 1749-55 16 Boriani G et al.: Effects of remote monitoring on clinical outcomes and use of health care resources in heart failure patients with biventricular defibrillators: results of the MORE-CARE multicenter randomized controlled trial. Eur J Heart Fail 2017; 19: 416-25 17 Braunschweig F et al.: Remote monitoring of implantable cardioverter defibrillators and resynchronization devices to improve patient outcome: dead end or way ahead? Europace 2019; 21: 846-55 18 Palfy JA et al.: CorVue algorithm efficacy to predict heart failure in real life. Pacing Clin Electrophysiol 2018. doi: 10.1111/pace.13399 19 Boehm M et al.: Fluid status telemedicine alerts for heart failure: a randomized controlled trial. Eur Heart J 2016; 37; 3154-63 20 Vamos M et al.: Refined heart failure detection algorithm for improved clinical reliability of OptiVol alerts in CRT-D recipients. Cardiol J 2018; 25: 236-44 21 Boehmer JF et al.: A multisensory algorithm predicts heart failure events in patients with implanted devices: results from the MultiSENSE study. JACC HF 2017; 5: 216-25 22 Treskes RW et al.: Clinical and economic impact of HeartLogicTM compared with standard care in heart failure patients. ESC Heart Fail 2021; 8: 1541-51 23 Abraham WT et al.: Wireless pulmonary artery haemodynamic monitoring in chronic heart failure: a randomized controlled trial. Lancet 2011; 377: 658-66 24 Adamson PB et al.: Wireless pulmonary artery pressure monitoring guides management to reduce decompensation in heart failure with preserved ejection fraction. Circ Heart Fail 2014; 7: 935-44 25 O’Shea CJ et al.: Ventricular arrhythmia burden during the coronavirus disease 2019 (COVID-19) pandemic. Eur Heart J 2021; 42: 520-8 26 Harding I et al.: Remote monitoring of arrhythmias in the COVID lockdown era. Circ Arrhythm Electrophysiol 2021; 14: e008932 27 Malanchini G et al.: Ventricular arrhythmia among patients with implantable cardioverter-defibrillation during the COVID-19 pandemic. J Arrhythm 2021; 37: 407-13 28 Holt A et al.: New-onset atrial fibrillation: incidence, characteristics, and related events following a national COVID lockdown of 5.6 million people. Eur Heart J 2020; 41(32): 3072-9
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Neue Wege in der Diagnostik des Vorhofflimmerns
Vorhofflimmern ist die häufigste Rhythmusstörung unserer Zeit. Die Folgen reichen von eingeschränkter Lebensqualität und Belastbarkeit bis zu schwerwiegenden Komplikationen wie ...