Alzheimer: Was gibt es Neues in der Biomarker-Entwicklung?
Autor:
OA Dr. Fabio Rossini
Universitätsklinik für Neurologie, neurologische Intensivmedizin und Neurorehabilitation
Uniklinikum Salzburg
E-Mail: f.rossini@salk.at
Schätzungen zufolge leben in Österreich 115000 bis 130000 Menschen mit einer Form der Demenz. Eine Zahl, die sich bis zum Jahr 2050 verdoppeln wird.1 Antikörper-Wirkstoffe könnten in der Behandlung der Alzheimerdemenz zum Gamechanger werden. Dafür braucht es aber eine reliable Früherkennung. Biomarker könnten hier zum Schlüssel-element für Diagnose, Stadieneinteilung und Prognose der Alzheimerkrankheit werden.
Keypoints
-
Das AT(N)-Scoring-System dient dazu, die Alzheimerkrankheit auf Basis der neuropathologischen Veränderungen zu diagnostizieren.
-
A steht für Amyloidbeta-Pathologie, T für Tau-Pathologie und N für neurodegenerative Prozesse, die aber nicht Alzheimer-spezifisch sind.
-
Liquortests können mit hoher Genauigkeit zwischen neuropathologischen Veränderungen bei AD unterscheiden. Hierbei sind Verhältnismarker verlässlicher als „Stand alone“-Marker.
-
Bei den Serummarkern liefern Kits, die p-tau217 bestimmen können, die besten Ergebnisse.
-
NfL und GFAP geben einen unspezifischen Aufschluss über neuronale Schädigungen, was zur Prognoseabschätzung nützlich ist. Diese können aber auch bei Schädel-Hirn-Traumata und Schlaganfällen ansteigen.
Bereits 2011 wurden Biomarker in die überarbeiteten Empfehlungen des National Institute on Aging(NIA) als diagnostische Kriterien für wahrscheinliche und mögliche Alzheimerdemenz (AD) zur Verwendung im Bereich der Forschung integriert.2 In diesem ersten Modell wurden die Biomarker in zwei Hauptkategorien unterteilt, in Biomarker für die Amyloid-Beta (Aβ)-Akkumulation und in Biomarker für Neurodegeneration.2 Die darauffolgenden Kriterien von 2018 basieren auf der Annahme, dass die Alzheimerkrankheit auf einem Aggregat von neuropathologischen Veränderungen basiert und daher in vivo durch Biomarker und nicht durch klinische Symptome definiert wird.3
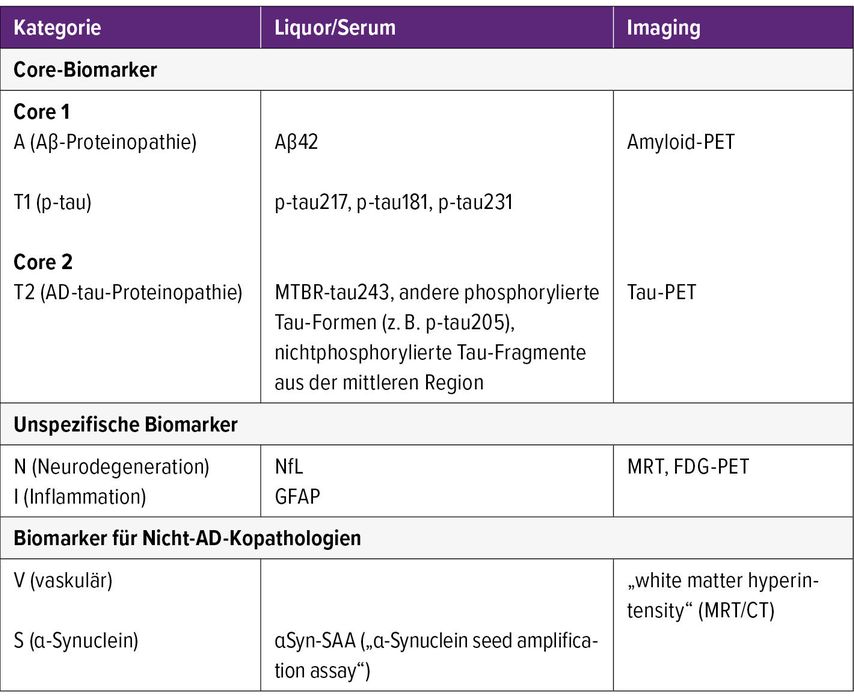
Dementsprechend wurde das AT(N)-Scoring-System eingeführt und die Biomarker wurden in drei Kategorien eingeteilt.4 Zu den Biomarkern für Aβ-Plaques (mit „A“ gekennzeichnet) gehören die kortikale Amyloid-PET-Ligandenbindung und niedriges Aβ42 im Liquor. Zu den Biomarkern für fibrilläres Tau-Protein (mit „T“ gekennzeichnet) gehören erhöhtes phosphoryliertes Tau (p-tau) im Liquor und kortikale Tau-PET-Ligandenbindung. Schließlich wurden t-tau (totales Tau) im Liquor, FDG-PET-Hypometabolismus und Atrophie im MRT als Biomarker für Neurodegeneration und neuronale Schädigung (N) betrachtet. Biomarker der Gruppe (mit „[N]“ gekennzeichnet) sind Indikatoren für Neurodegeneration und neuronale Schädigung. Sie sind nicht spezifisch für eine Alzheimer-assoziierte Neurodegeneration. Im Gegensatz zu A- und T- können (N)-Biomarker nicht zur Diagnose der Alzheimerkrankheit verwendet werden. Ihre Verwendung dient lediglich dazu, Informationen über das Stadium der Krankheit und Hinweise auf Komorbiditäten zu liefern.
Die Biomarker werden in drei große Kategorien eingeteilt (Tab.1):
-
Core-Biomarker für neuropathologische Veränderungen bei AD (ADNPC): Man unterscheidet zwischen Core-1- und Core-2-Biomarkern, die sich durch den Zeitpunkt des Auftretens der Anomalie und den Verwendungszweck unterscheiden. Core-1-Biomarker werden etwa zur gleichen Zeit abnormal wie die Amyloid-PET, Core-2-Biomarker werden erst später in der Entwicklung von Alzheimer abnormal.
-
Unspezifische Biomarker, die bei der AD-Pathogenese wichtig sind, aber auch bei anderen Hirnerkrankungen eine Rolle spielen
-
Biomarker für Nicht-AD-Kopathologien
„Core biomarkers“
Anwendung in der AD-Diagnose
Nach der neuen Klassifizierung reicht eine Veränderung der Core-1-Biomarker (A und T) aus, um die biologische Diagnose der Alzheimerkrankheit zu stellen. Insbesondere sind die folgenden Tests für die Diagnose von AD geeignet: Amyloid-PET, Aβ42/40 im Liquor, p-tau181/Aβ42 im Liquor, t-tau/Aβ42 im Liquor, „genaue“ Plasmatests oder Kombinationen dieser Tests. In einer Bildgebungs-zu-Autopsie-Studie betrugen Sensitivität und Spezifität der Florbetapir-PET-Bildgebung für die Erkennung mittelschwerer bis häufiger Plaques 96% bzw. 100% bei Patienten, die innerhalb eines Jahres obduziert wurden.5
Liquormarker
Die Zulassung von Liquortests wurde an positive/negative visuelle Messwerte der Amyloid-PET geknüpft.4
Diese Liquortests unterscheiden mit einer hohen Genauigkeit zwischen mittelschweren/schweren und keinen/leichten ADNPC, vor allem anhand erniedrigter Aβ42-Werte, eines erniedrigten Aβ42/Aβ40-Verhältnisses sowie erniedrigter Werte für t-tau, p-tau, p-tau/Aβ42 und p-tau/t-tau.6 Bemerkenswert dabei ist, dass die sogenannten Ratios (Aβ42/Aβ40, p-tau/Aβ42 und p-tau/t-tau) eine bessere Leistung zeigen im Vergleich zu „Stand alone“-Bestimmungen.7
Serummarker
Ein Merkmal der neuen Klassifizierung ist die Verwendung von Serummarkern bei der Diagnose. Verschiedene Kits stehen hier zur Auswahl. Die besten Ergebnisse liefern Kits, die das phosphorylierte Tauproteinp-tau217 bestimmen können. Diese zeigen eine hohe Korrelation mit Liquorbiomarkern. Zudem kann p-tau217 auch gut zwischen verschiedene Demenzformen diskriminieren wie der frontotemporalen Demenz.8
Weitere Verwendungszwecke von p-Tau-Serummarkern sind die Abschätzung der Prognose, das Screening im Zusammenhang mit neuen Amyloid-Antikörpertherapien und die Bewertung des Ansprechens auf die Behandlung.9
Die Amyloid-Biomarker sind im Serum dagegen weniger aussagekräftig, weder als „Stand alone“- noch als Verhältnismarker. Tatsächlich beträgt der Unterschied zwischen Personen mit und ohne pathologischer Aβ-Veränderung um die 50% für Aβ42/40 im Liquor, aber nur 10% bis 15% für Aβ42/40 im Plasma.10 Es ist jedoch wichtig zu berücksichtigen, dass die biologische Diagnose die klinische Bewertung von Personen mit kognitiven Beeinträchtigungen nur unterstützen und nicht ersetzen soll.
Fazit
Die biologische Diagnose einer AD kann mit A- und T-Biomarkern gestellt werden, dafür wurden Liquor- und Serumbiomarker entwickelt. Serum-Tau-Biomarker sind aussagekräftiger als Serum-Amyloid-Biomarker und Verhältnismarker sind besser als „Stand alone“-Biomarker.
Biologisches Staging
Auch im Zusammenhang mit der Stadieneinteilung müssen wir zwischen der Einteilung des Schweregrads der Alzheimerbiologie mit Biomarkern und der Einstufung des Schweregrads anhand klinischer Symptome unterscheiden. Die Einstufung der Alzheimerkrankheit gilt nur für Personen, bei denen die Krankheit mithilfe von Core-1-Biomarkern diagnostiziert wurde. Das biologische Stufensystem der Alzheimerkrankheit basiert ebenfalls auf Core-Biomarkern. Das erste Stadium zeichnet sich durch positive Core-1-Biomarker bei negativen Core-2-Biomarkern aus.
Imaging
Eine abnormale Amyloid-PET (Core 1) tritt häufig als isolierter Befund bei älteren Menschen auf, die kognitiv nicht beeinträchtigt sind. Im Gegensatz dazu werden hohe Werte der neokortikalen Tau-PET nur selten ohne abnormale Amyloid-PET festgestellt. Hohe neokortikale Tau-PET-Werte gehen immer mit Neurodegeneration und klinischen Symptomen einher. Bei Personen mit abnormaler Tau-PET stehen die klinischen Symptome und die Neurodegeneration in engem Zusammenhang mit Lokalisation und Ausmaß von Tau in der PET-Aufnahme.4 Dies bedeutet, dass ein höheres biologisches AD-Stadium die Wahrscheinlichkeit erhöht, dass die kognitiven Symptome einer Person auf eine AD-Pathologie zurückzuführen sind. Aktuell wurde ein biologisches Staging der Alzheimerkrankheit nur mit radiologischen Core-2-Biomarkern (d.h. Tau-PET) etabliert. Tau-PET ist jedoch in Österreich derzeit nicht verfügbar.
„Fluid biomarkers“
Die Verwendung von Serumbiomarkern für das Staging der Alzheimerkrankheit ist noch nicht operationalisiert worden. Der erste Anstieg von abnormalen flüssigkeitsbasierten Core-1-Biomarkern erfolgt etwa zum Zeitpunkt des Auftretens von sichtbaren Amyloid-Veränderungen in der PET. Bereits zwei Dekaden vor Auftreten der ersten AD-Symptome und Tau-PET-Veränderungen, können Veränderungen der flüssigkeitsbasierten Core-1-Biomarker sichtbar werden.4,11In einer Studie, die den Verlauf der Tau-Werte bei Teilnehmern mit einer genetischen Disposition für AD untersuchte, zeigten sich spezifische Phosphorylierungsveränderungen je nach Krankheitsverlauf.11
Die Zunahme von t-tau und die Phosphorylierungen treten in einer relativen Reihenfolge auf: Die Phosphorylierung von Tau an Threonin-217 (pT217/T217) wird gefolgt von der Phosphorylierung von Threonin-181 (pT181/T181), darauf folgt ein t-tau-Anstieg, dann eine Phosphorylierung von Tau an Threonin-205 (pT205/T205).12 Rezent entwickelte Tau-Assays (wie MTBR-tau243 und nichtphosphorylierte Tau-Fragmente der mittleren Domäne) korrelieren besser mit der Tau-PET als mit der Amyloid-PET.13 Aus diesen Daten wurde eine Abfolge von Ereignissen vorgeschlagen, bei der pathologische Tau-Spezies in der folgenden Reihenfolge auftreten: 1) p-tau181, p-tau217, p-tau231; 2) p-tau205 (im Liquor und im Serum); 3) MTBR-tau243 (im Liquor und im Serum); 4) nichtphosphorylierte Tau-Fragmente der mittleren Domäne.4 Auf der Grundlage dieser Daten kann man sich ein Stufenschema vorstellen, das das Schema der bildgebenden Diagnostik widerspiegelt.
Unspezifische Biomarker, die auch bei der AD-Pathogenese wichtig sind
N-Biomarker
Neurodegeneration und neuronale Schädigung stellen wichtige Schritte in der Pathogenese der Alzheimerkrankheit dar, allerdings treten Anomalien bei den N-Biomarkern auch bei vielen anderen neurodegenerativen und nicht neurodegenerativen Krankheiten (z.B. bei Schädel-Hirn-Traumata oder Schlaganfällen) auf. FDG-PET und MRT werden weiterhin als „imaging N biomarkers“ eingestuft, wie bereits in den früheren Kriterien. Im Gegensatz zu den Kriterien von 2018 wird in der neuen Klassifizierung t-tau nicht mehr als N-Biomarker zugeordnet.4
Unter den flüssigkeitsbasierten N-Biomarkern wurde die leichte Kette des Neurofilaments (NfL) eingeführt. Neurofilamente (NF) sind wichtige Strukturproteine des neuronalen Zytoskeletts und werden nach ihrem Molekulargewicht in die schwere, die mittlere und die leichte Kette eingeteilt.
NF werden bei Nervenschädigung in die interstitielle Flüssigkeit und den Liquor freigesetzt. Insbesondere die leichte Kette (NfL) ist die am häufigsten vorkommende und lösliche Untereinheit. Sie wurde vermehrt im Liquor von Patienten mit entzündlichen, degenerativen, vaskulären oder traumatischen Schäden gefunden, korrelierend mit der klinischen und radiologischen Aktivität.14 Somit spiegelt NfL den axonalen Schaden unabhängig von der Ursache wider.
NfL kann sowohl im Liquor als auch im Plasma (oder Serum) bestimmt werden, und die Korrelation zwischen Liquor- und Blutkonzentrationen ist gut bis ausgezeichnet (r-Werte von 0,70–0,97).15
Der NfL-Spiegel ist auch bei AD erhöht. Studien über die autosomal dominante AD zeigen, dass die Veränderungsrate von NfL im Blut bereits 15 Jahre vor dem Auftreten der Symptome sichtbar ist. Wichtig ist, dass höhere NfL-Werte bei den meisten neurodegenerativen Erkrankungen mit einem schnelleren Fortschreiten der Krankheit und einer stärkeren Hirnatrophie verbunden sind. Zudem kann NfL zur Überwachung der klinischen Wirksamkeit einer Behandlung verwendet werden.16
I-Biomarker
Diese Kategorie wurde eingeführt, da es Hinweise auf immunologische und entzündliche Mechanismen in der AD-Pathogenese gibt.4 Das saure Gliafaserprotein (GFAP) ist ein Marker reaktiver Astrozyten und liefert sowohl im Plasma als auch im Liquor gute Ergebnisse, scheint aber im Plasma besser zu funktionieren. Plasma-GFAP ist jedoch auch bei anderen neurodegenerativen Zuständen erhöht. Obwohl es nicht spezifisch für AD ist, wird es mit einem frühen Befund in derAmyloid-PET, einem höheren Risiko für das Auftreten von Demenz und einem schnelleren kognitiven Abbau in Verbindung gebracht.16
Fazit
Zusammenfassend lässt sich sagen, dass die N- und I-Biomarker zwar unspezifisch sind, aber mit der Geschwindigkeit des Fortschreitens der Krankheit korrelieren und möglicherweise eine prognostische Rolle spielen.
Biomarker für Nicht-AD-Kopathologien
Indikatoren der Kopathologie können klinisch nützlich sein, wenn es um die Ätiologie der Symptome, Prognose und Behandlungsentscheidungen geht.4
S-Biomarker
„Alpha-synuclein seed amplification assays“ (αSyn-SAA) im Liquor wurden zum Nachweis von flüssigkeitsbasierten Biomarkern für die neuronale α-Synuclein-Krankheit (NSD) vorgeschlagen. Sie sind sensitiv und spezifisch für die Ante-mortem-Identifizierung von pathologischen Veränderungen des kortikalen α-Synucleins als (Ko)pathologie.17
V-Biomarker
Zu dieser Gruppe gehören Bildgebungsbiomarker für Schlaganfälle und Hyperintensität der weißen Substanz in CT oder MRT.18
Literatur:
1 Österreichischer Demenzbericht. 2014 2 Jack CR Jr et al.: Introduction to the recommendations from the national institute on aging-alzheimerʼs association workgroups on diagnostic guidelines for Alzheimerʼs disease. Alzheimers Dement 2011; 7(3): 257-62 3 Jack CR Jr et al.: NIA-AA research framework: toward a biological definition of Alzheimerʼs disease. Alzheimers Dement 2018; 14(4): 535-62 4 Jack CR Jr et al.: . Revised criteria for diagnosis and staging of alzheimerʼs disease: alzheimerʼs association workgroup. Alzheimers dement. Alzheimers Dement 2024; 20(8): 5143-69 5 Clark CM et al.: Cerebral PET with florbetapir compared with neuropathology at autopsy for detection of neuritic amyloid-β plaques: a prospective cohort study. Lancet Neurol 2012; 11(8): 669-78 6 Mattsson-Carlgren N et al.: Cerebrospinal fluid biomarkers in autopsy-confirmed alzheimer disease and frontotemporal lobar degeneration. Neurology 2022; 98(11): e1137-50 7 Janelidze S et al.: Head-to-head comparison of 10 plasma phospho-tau assays in prodromal Alzheimerʼs disease. Brain 2023; 146(4): 1592-601 8 Thijssen EH et al.: Alzheimerʼs disease: towards diagnostic and therapeutic trial applications. Lancet Neurol 2021; 20(9): 739-52 9 Gonzalez-Ortiz F et al.: Advancing research and treatment for frontotemporal lobar degeneration investigators. Plasma phosphorylated tau 217 and phosphorylated tau 181 as biomarkers in alzheimerʼs disease and frontotemporal lobar degeneration: a retrospective diagnostic performance study. Mol Neurodegener 2023; 18(1): 18 10 Janelidze S et al.: . Head-to-head comparison of 8 plasma amyloid-β 42/40 assays in alzheimer disease. JAMA Neurol 2021; 78(11): 1375-82 11 Barthélemy NR et al.: A soluble phosphorylated tau signature links tau, amyloid and the evolution of stages of dominantly inherited alzheimerʼs disease. Nat Med 2020; 26(3): 398-407 12 Barthélemy NR et al.: CSF tau phosphorylation occupancies at T217 and T205 represent improved biomarkers of amyloid and tau pathology in alzheimerʼs disease. Nat Aging 2023; 3(4): 391-401 13 Horie K et al.: CSF tau microtubule binding region identifies tau tangle and clinical stages of alzheimerʼs disease. Brain 2021; 144(2): 515-27 14 Gaetani L et al.: Neurofilament light chain as a biomarker in neurological disorders. J Neurol Neurosurg Psychiatry 2019; 90(8): 870-81 15 Zetterberg H, Blennow K: Moving fluid biomarkers for alzheimerʼs disease from research tools to routine clinical diagnostics. Mol Neurodegener 2021; 16(1): 10 16 Hansson O et al.: Blood biomarkers for alzheimerʼs disease in clinical practice and trials. Nat Aging 2023; 3(5): 506-19 17 Hall S et al.: Performance of αSynuclein RT-QuIC in relation to neuropathological staging of lewy body disease. Acta Neuropathol Commun 2022; 10(1): 90 18 Vemuri P et al.: White matter abnormalities are key components of cerebrovascular disease impacting cognitive decline. Brain Commun 2021; 3(2): fcab076
Das könnte Sie auch interessieren:
Menschen mit Demenz: Was beeinflusst deren Überleben nach Diagnosestellung?
Verschiedenste Faktoren beeinflussen die Überlebenszeit nach einer Demenzdiagnose. Das Wissen um Risikofaktoren zum Zeitpunkt der Diagnose einer Demenzerkrankung oder in deren Verlauf ...
Invasive Neuromodulation: letzte Option bei refraktärem Kopfschmerz
In Fällen chronischer, refraktärer Migräne oder beim refraktären Cluster-Kopfschmerz können invasive Methoden der Neuromodulation zum Einsatz kommen. Die beste Evidenz steht aktuell für ...
Kappa-FLC zur Prognoseabschätzung
Der Kappa-freie-Leichtketten-Index korreliert nicht nur mit der kurzfristigen Krankheitsaktivität bei Multipler Sklerose, sodass er auch als Marker zur Langzeitprognose der ...