Pumpentherapien bei fortgeschrittenem Morbus Parkinson
Autor:innen:
Dr. Keno Hagena
PD Dr. Monika Pötter-Nerger
Klinik Neurologie
Universitätsklinikum Hamburg-Eppendorf
Korrespondierende Autorin:
PD Dr. Monika Pötter-Nerger
E-Mail: m.poetter-nerger@uke.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Parkinsonkrankheit ist die zweithäufigste neurodegenerative Erkrankung und die neurologische Erkrankung mit der am schnellsten steigenden Inzidenz, mit einer Verdopplung der Zahl der Erkrankten weltweit zwischen 1990 und 2015.1 Niedergelassene Neurolog:innen werden mit einer wachsenden Zahl an Patient:innen im fortgeschrittenen Stadium mit Wirkfluktuationen konfrontiert, in dem eine orale medikamentöse Therapie an Grenzen stößt. Hier stellen die verschiedenen Pumpentherapien einen wesentlichen Therapiebaustein dar.
Keypoints
-
Der Einsatz von Pumpentherapien sollte erwogen werden, wenn trotz adäquater oraler Therapie weiterhin relevante Wirkfluktuationen bei den Parkinsonpatient:innen bestehen. Bei der Entscheidungsfindung können die „5-2-1“-Regel oder das Online-Tool „MANAGE PD“ unterstützen.
-
Zur Auswahl stehen aktuell subkutane Apomorphin-Pumpen, intestinale Gels (LCIG/LECIG) sowie neu zugelassen eine subkutane Levodopa/Carbidopa-Pumpe.
-
Alle verfügbaren Pumpensysteme sind im Vergleich zur Tablettentherapie effektiv in der Reduktion von Off-Zeit und der Verlängerung von On-Zeit ohne Dyskinesien. Die Pumpensysteme unterscheiden sich bezüglich der Effektivität (Off-Zeit-Reduktion: Apomorphin etwa 2–3h/Tag, LCIG 4h/Tag).
-
Die Entscheidung für ein Pumpensystem sollte gemeinsam mit den Patient:innen getroffen werden und sich nach bevorzugtem Applikationsweg (s.c./intestinal), Wirkprofil (motorische und nichtmotorische Symptome) und möglichen Nebenwirkungen richten.
Nach den ersten „Honeymoon-Jahren“ mit suffizienter Einstellung der Parkinsonkrankheit unter oraler Medikation kommt es mit Fortschreiten der Erkrankung zu therapeutisch herausfordernden motorischen wie auch nicht motorischen Wirkfluktuationen. Die motorischen Fluktuationen manifestieren sich in Form von „Off“-Phasen mit Akinese, Tremor oder auch Off-assoziiertem „freezing of gait“ (FoG) und „On“-Phasen mit hyperkinetischen Dyskinesien. Die nicht motorischen Wirkfluktuationen können mit neu entwickelten Scores der Movement Disorder Society erfasst werden (MDS-NMS,2 NoMoFA3) und sind bei bis zu 41% aller Patient:innen nachweisbar.2 Besonders häufig sind Fluktuationen der Fatigue (68,5%) und der Angst (62,4%),2 aber auch Fluktuationen der kognitiven Leistung (Wortfindung [76%], Gedankenabreißen [73%]), von Schmerz (69,7%) und Ruhelosigkeit (66%).3
Im fortgeschrittenen Krankheitsstadium können Fluktuationen neben chirurgischen Verfahren wie der tiefen Hirnstimulation (THS) durch verschiedene Pumpensysteme behandelt werden. Derzeit verfügbar sind 1. die subkutane Apomorphin-Pumpe, 2. die Levodopa/Carbidopa-Intestinal-Gel(LCIG)-Pumpe, 3. die Levodopa/Entacapon/Carbidopa-Intestinal-Gel(LECIG)-Pumpe. Zusätzlich wurde gerade eine subkutane Levodopa-Pumpe zugelassen. Der niedergelassene Neurologe wird bei der Indikationsstellung eines Pumpensystems mit verschiedenen Fragestellungen konfrontiert.
Wann ist der optimale Zeitpunkt für eine Pumpentherapie?
Gemäß der Leitlinie der Movement Disorder Society und den aktuellen Zulassungsbestimmungen in Deutschland und Österreich sollte eine medikamentöse Pumpe bei fortgeschrittener Erkrankung mit unkontrollierten Wirkfluktuationen unter oraler Therapie in Betracht gezogen werden.4 Eine einfache Heuristik für den klinischen Alltag bietet die „5-2-1“-Regel:5 Eine gerätegestützte Therapie sollte bei Patient:innen erwogen werden, die Levodopa zu mindestens 5 Zeitpunkten einnehmen, mindestens 2 Stunden täglich im Off sind oder mindestens1 Stunde unter störenden Dyskinesien leiden. Das kostenfreie, online verfügbare Screening-Tool „MANAGE PD“6 hilft den Therapeut:innen, Patient:innen bezüglich der Notwendigkeit einer gerätegestützten Therapie zu stratifizieren. In dem Online-Tool werden verschiedene Aspekte berücksichtigt, wie die Anzahl der Levodopagabezeitpunkte, therapierefraktäre Symptome, Wirkfluktuationen, Medikamentennebenwirkungen und Einschränkungen im Alltag.
Welche Pumpentherapie ist für Patient:innen am besten geeignet?
Die Auswahl der gerätegestützten Therapie (Abb.1) sollte individualisiert und patientenzentriert erfolgen. Bei der Bewertung der Verfahren können die multizentrischen Studien EuroInf7 und EuroInf 28 herangezogen werden, die insbesondere Unterschiede der Pumpensysteme bezüglich des nicht motorischen Symptomprofils erbracht haben. Apomorphin scheint besonders effektiv Apathie, Schlafstörungen und Aufmerksamkeit zu verbessern, während das Nebenwirkungsprofil von LCIG günstiger ist bei bestehenden Halluzinationen.8 Nach Aufklärung der Patient:innen über den Grad der Invasivität, das Nebenwirkungsprofil und die Wirkstärke sollte die Therapiewahl im „Shared decision making“-Verfahren erfolgen.9
1. Subkutane Apomorphin-Pumpe
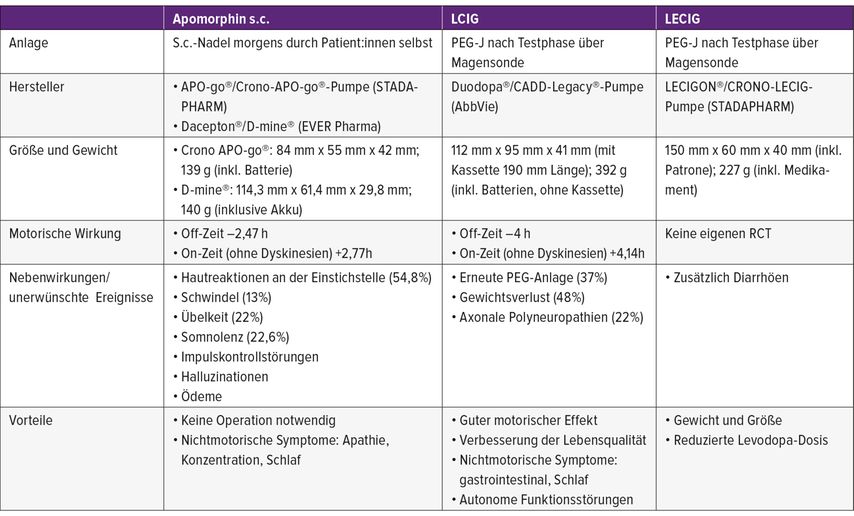
Die seit etwa 30 Jahren verfügbare Therapie mit dem Dopamin-D2-Rezeptoragonisten Apomorphin kann als subkutan injizierte Pen- oder Pumpenapplikation angewendet werden. Im deutschsprachigen Raum werden Pumpen und Injektionslösungen mehrerer Hersteller vertrieben (D-mine®/EVER-Pharma und APO-go®/STADA). Die Pumpeninfusion kann über 16h oder 24h erfolgen. Über die Einstellungsmöglichkeiten verschiedener kontinuierlicher Laufraten kann ein individualisiertes Tagesprofil für die Patient:innen erstellt werden, zusätzlich sind Bolusgaben möglich. Die orale Medikation wird gewöhnlich in reduzierter Dosierung fortgeführt. Durch den subkutanen Applikationsweg kommt die Pumpe ohne einen operativen Eingriff aus, was auch einen probatorischen, reversiblen Einsatz ermöglicht. Zahlreiche offene Studien zeigten in unterschiedlichen Kohorten von 27–173 Patient:innen eine Reduktion der Off-Zeit um 49–60%/Tag gegenüber der alleinigen, oralen Tablettentherapie.10 Mit der multizentrischen TOLEDO-Studie11 wurde Apomorphin als Pumpentherapie randomisiert und doppelt verblindet bei 106 Patient:innen gegen Placebo getestet. Es konnte eine zuverlässige Verbesserung motorischer Symptome (Reduktion von Off-Zeit um 2,47 Stunden, Zunahme von On-Zeit ohne Dyskinesien um 2,77 Stunden) über 12 Wochen gezeigt werden.11 Die häufigsten unerwünschten Ereignisse umfassten Hautreaktionen (54,8%), Schwindel (13%), Übelkeit (22%) und Somnolenz (22,6%), etwas seltener Ödeme, Impulskontrollstörungen und Halluzinationen. Bei 16,7% der Patient:innen wurde die Therapie innerhalb von 64 Wochen abgebrochen.12 Absolut kontraindiziert ist eine Apomorphin-Pumpe bei schwerer Demenz, relative Kontraindikationen sind Impulskontrollstörungen, ein Levodopa-Dysregulationssyndrom, orthostatische Hypotension, Tagesmüdigkeit, Halluzinationen oder eine therapeutische Antikoagulation.
2. Levodopa/Carbidopa-Intestinal-Gel (LCIG)
Das Levodopa/Carbidopa-Intestinal-Gel (LCIG; Duodopa®/AbbVie) wurde in der EU 2004 zugelassen. LCIG wird mittels perkutaner endoskopischer Gastrostomie mit jejunaler Verlängerung (PEG-J) intestinal appliziert. Die Infusion erfolgt über 16–24 Stunden mit zusätzlichen Bolusgaben. Gewöhnlich wird eine LCIG-Therapie ohne weitere orale Parkinsonmedikation fortgeführt. In der multizentrischen, doppelblinden, placebokontrollierten Zulassungsstudie konnten eine Off-Zeit-Verkürzung um 4 Stunden mit entsprechender On-Zeit-Verlängerung sowie eine Verbesserung der Lebensqualität nachgewiesen werden,13 Effekte, die auch in der 5-jährigen Open-Label-Studienverlängerung anhielten.14 In unverblindeten Studien zeigte LCIG einen positiven Effekt auf nicht motorische Symptome, insbesondere profitierten Patient:innen mit Schlafstörungen, autonomen Funktionsstörungen und gastrointestinalen Symptomen.8 Über einen Nachbeobachtungszeitraum von fünf Jahren berichteten 94% der Patient:innen von unerwünschten Ereignissen, 37% benötigten eine erneute PEG-Anlage. Applikationsspezifische Nebenwirkungen umfassten darüber hinaus Gewichtsverlust (48%) sowie axonale Polyneuropathien (22%), Letztere wahrscheinlich bedingt durch einen Anstieg von Homocystein als Abbauprodukt von Levodopa. Therapieabbrüche wurden jährlich bei 10% der Patient:innen verzeichnet.14
3. Levodopa/Entacapon/Carbidopa-Intestinal-Gel (LECIG)
Seit 2021 ist mit dem intestinalen Levodopa/Entacapon/Carbidopa-Gel (LECIG; Lecigon®/STADAPHARMA) ein weiteres Gel zur intestinalen Anwendung mit eigener Pumpe auf dem deutschsprachigen Markt. Durch Zugabe eines COMT-Hemmers lässt sich die Levodopa-Dosis bei vergleichbarer Wirksamkeit um ca. 35% im Vergleich zu LCIG reduzieren.15,16 Dies ermöglicht eine deutlich kleinere und leichtere Pumpe im Vergleich zur etablierten LCIG-Pumpe (Tab.1 und Abb. 1). In einer prospektiven Beobachtungsstudie über 300 Tage sahen Patient:innen, die zuvor von einer LCIG-Pumpe auf eine LECIG-Pumpe umgestellt worden waren, mehrheitlich eine Verbesserung bezüglich der Bedienung sowie der Größe der Pumpe.17 Pathophysiologisch denkbar wäre ein Vorteil des LECIG gegenüber LCIG in Hinsicht auf die Entwicklung axonaler Polyneuropathien, da durch die Kombination mit einem COMT-Inhibitor weniger Homocystein gebildet wird. Hierzu fehlen jedoch bislang klinische Daten. Aufgrund des hinzugefügten Entacapons ist zusätzlich auf Diarrhöen oder eine bekannte Unverträglichkeit des oralen Entacapons zu achten. Zu berücksichtigen ist die im Vergleich zur LCIG-Therapie deutlich schlechtere Studienlage mit nur wenigen offenen, monozentrischen Studien.
Abb. 1: Aktuell verfügbare Pumpensysteme. Links: CADD-Legacy®-Duodopa®-Pumpe. Mitte: CRONO-LECIG-Pumpe. Rechts: D-mine®-Apomorphin-Pumpe
4. Subkutane Levodopa/Carbidopa-Pumpe
Neben dem unlängst zugelassenen Produodopa®/AbbVie befindet sich mit ND0612/NeuroDerm noch ein zweites Präparat in einer fortgeschrittenen Studienphase. Ergebnisse aus den randomisierten, doppelblinden Phase-III-Studien konnten für beide Wirkstoffe bereits signifikante Verbesserungen in Off- und On-Zeiten gegenüber oraler Medikation zeigen.18,19 Unerwünschte Ereignisse scheinen überwiegend dem Sicherheitsprofil von oral appliziertem Levodopa/Carbidopa zu entsprechen, während zusätzliche Hautreaktionen im Bereich der Einstichstelle milde bis moderat ausfallen.18,20 Der erhoffte Vorteil im klinischen Alltag besteht in einer Kombination der Vorteile der Apomorphin-Pumpe (geringe Invasivität, weniger Prozedur-assoziierte unerwünschte Ereignisse) mit der allgemein besseren Verträglichkeit von Levodopa/Carbidopa gegenüber Apomorphin, insbesondere in Bezug auf die in fortgeschrittenem Alter zunehmenden Nebenwirkungen von Dopaminagonisten.
Können gerätegestützte Therapien gewechselt oder kombiniert werden?
Prinzipiell sind ein Wechsel oder eine Kombination der gerätegestützten Therapien möglich. Retrospektive Studien belegen jedoch, dass ein Wechsel oder eine Kombination der gerätegestützten Therapien seltene Ereignisse sind.21,22 Eine retrospektive Studie über 12 Jahre ergab, dass nur 5% der Patient:innen von einer Monotherapie zu einer anderen Monotherapie wechselten und bei ca. 1% eine Kom-binationstherapie eingesetzt wurde. Die häufigsten Wechsel waren die von einer LCIG- oder Apomorphin-Pumpe auf THS, Gründe hierfür waren residuelle, noch nicht ausreichend kontrollierte motorische Fluktuationen oder unerwünschte Ereignisse in Zusammenhang mit der Pumpe.21 Bei den Pumpen fand sich häufig ein Wechsel von einer Apomorphin-Pumpe auf die effektivere LCIG-Pumpe.21 Kombinationstherapien wurden in vier Fallserien, zwei retrospektiven und einer prospektiven Studie beschrieben, bei nicht ausreichend kontrollierten motorischen Fluktuationen unter der primär gewählten Monotherapie.21,22 Die häufigste Kombinationstherapie war eine primäre THS-Therapie, die um eine Pumpe ergänzt wurde. Patient:innen konnten nach Beginn einer zweiten, gerätegestützten Therapie nochmals eine Verringerung der Off-Zeiten und eine Erhöhung der Lebensqualität erreichen.22 Somit kann in Einzelfällen, in denen mit einer gerätegestützten Monotherapie noch keine ausreichende Symptombesserung erzielt werden kann, ein Wechsel oder eine Kombination der Therapien in Erwägung gezogen werden.
Literatur:
1Dorsey ER et al.: Lancet Neurol 2018; 17: 939-53 2 Rodriguez-Blazquez C et al.: Prevalence of non-motor symptoms and non-motor fluctuations in Parkinson’s disease using the MDS-NMS. Mov Disord Clin Pract 2020; 8(2): 231-9 3 Kleiner G et al.: Non-motor fluctuations in Parkinson’s disease: validation of the non-motor fluctuation assessment questionnaire. Mov Disord 2021; 36(6): 1392-1400 4 Deuschl G et al.: European Academy of Neurology/Movement Disorder Society – European Section Guideline on the Treatment of Parkinson‘s Disease: I. Invasive Therapies. Mov Disord 2022; 37(7): 1360-745 Aldred J et al.: Application of the ‚5-2-1‘ screening criteria in advanced Parkinson’s disease: interim analysis of DUOGLOBE. Neurodegener Dis Manag 2020; 10(5): 309-23 6 https://www.managepd.eu/ 7 Martinez-Martin P et al.: EuroInf: a multicenter comparative observational study of apomorphine and levodopa infusion in Parkinson’s disease. Mov Disord 2015; 30(4): 510-6 8 Dafsari HS et al.: Beneficial effects of bilateral subthalamic stimulation on non-motor symptoms in Parkinson’s disease. Brain Stimul 2016; 9(1): 78-85 9 Nijhuis AP et al.: The patient’s perspective on shared decision-making in advanced Parkinson’s disease: A cross-sectional survey study. Front Neurol 2019; 10: 896 10 Gaire A et al.: Continuous subcutaneous apomorphine infusion in advanced Parkinson’s disease: A systematic review. Cureus 2021; 13(9): e17949 11 Katzenschlager R et al.: Apomorphine subcutaneous infusion in patients with Parkinson‘s disease with persistent motor fluctuations (TOLEDO): a multicentre, double-blind, randomised, placebo-controlled trial. Lancet Neurol 2018; 17(9): 749-59 12 Katzenschlager R et al.: Long-term safety and efficacy of apomorphine infusion in Parkinson’s disease patients with persistent motor fluctuations: Results of the open-label phase of the TOLEDO study. Parkinsonism Relat Disord 2021: 83: 79-85 13 Olanow CW et al.: Continuous intrajejunal infusion of levodopa-carbidopa intestinal gel for patients with advanced Parkinson’s disease: A randomised, controlled, double-blind, double-dummy study. Lancet Neurol 2014; 13(2): 141-9 14 Fernandez HH et al.: Long-term safety and efficacy of levodopa-carbidopa intestinal gel in advanced Parkinson’s disease. Mov Disord 2018; 33(6): 928-36 15 Senek M et al.: Levodopa-entacapone-carbidopa intestinal gel in Parkinson’s disease: A randomized crossover study. Mov Disord 2017; 32(2): 283-6 16 Senek M et al.: Population pharmacokinetics of levodopa gel infusion in Parkinson’s disease: effects of entacapone infusion and genetic polymorphism. Sci Rep 2020; 10(1): 18057 (2020) 17 Öthman M et al.: Initial experience of the levodopa-entacapone-carbidopa intestinal gel in clinical practice. J Pers Med 2021; 11(4): 254 18 Soileau MJ et al.: Safety and efficacy of continuous subcutaneous foslevodopa-foscarbidopa in patients with advanced Parkinson’s disease: a randomised, double-blind, active-controlled, phase 3 trial. Lancet Neurol 2022; 21(12): 1099-1109 19 https://neuroderm.com/our-company/news-and-events/positive-results-from-the-pivotal-phase-iii-boundless-trial/ 20 Olanow CW et al.: Continuous subcutaneous levodopa delivery for Parkinson’s disease: A randomized study. J Parkinsons Dis 2021; 11(1): 177-86 21 Georgiev D et al.: Switching and combining device-aided therapies in advanced Parkinson’s disease: a double centre retrospective study. Brain Sci 2022; 12(3): 343 22 Boura I et al.: Combining device-aided therapies in Parkinson’s disease: A case series and a literature review. Mov Disord Clin Pract 2021; 8(5): 750-7
Das könnte Sie auch interessieren:
Kappa-freie Leichtketten anstatt oligoklonaler Banden?
Der Nachweis oligoklonaler Banden gilt nach wie vor als Goldstandard zur Diagnosestellung einer Multiplen Sklerose. Allerdings gewinnt auch die Detektion von freien Leichtketten immer ...
Sprache im Fokus der Diagnostik der Alzheimerdemenz
Gängige neuropsychologische Tests erfassen in der Alzheimerdiagnostik die sprachlich-kommunikativen Fähigkeiten der Betroffenen nur unzureichend. Insbesondere komplexe sprachliche ...
Resilienz und kognitive Reserve
Bereits 1998 wurde in einer Studie festgehalten, dass eine Verzögerung des Ausbruchs von Demenz um nur fünf Jahre einen Rückgang der Demenzprävalenz von 50% bewirken könnte.1 Die ...