REBOA in der Polytraumaversorgung: State of the Art und Case Report
Autoren:
Priv.-Doz Dr. Lukas L. Negrin, MSc, MSc, PhD
Universitätsklinik für Orthopädie und Unfallchirurgie, Medizinische Universität Wien
E-Mail: lukas.negrin@meduniwien.ac.at
Priv.-Doz. Dr. Paul Puchwein
Universitätsklinik für Orthopädie und Traumatologie, Medizinische Universität Graz
E-Mail: paul.puchwein@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Aktuell ist eine Hämorrhagie für etwa 40% aller zivilen traumabedingten und für über 90% der potenziell überlebbaren militärischen Todesfälle verantwortlich. Nichtkomprimierbare Blutungen im Bauch- und Beckenraum sowie distale Aortenverletzungen stellen nach wie vor eine große Herausforderung für das versorgende Team dar. Ein Überleben bis zur definitiven operativen Blutstillung kann durch die Anwendung des minimalinvasiven Notfallverfahrens REBOA („resuscitative endovascular balloon occlusion of the aorta“) erreicht werden.
Keypoints
REBOA scheint bei Polytraumapatienten mit einem hämorrhagischen Schock aufgrund abdomineller, pelviner oder stammnaher Blutungen ein sicheres und effektives Verfahren zur raschen Reduktion des Blutverlusts und zur hämodynamischen Stabilisierung zu sein.
REBOA ist keine definitive Therapie, sondern ein Notfallverfahren, um einen Zeitgewinn von 30–60 Minuten für die definitive chirurgische Blutstillung im Abdomen oder Becken zu erzielen.
Zurzeit gibt es keine ausreichende Evidenz für die Reduktion der Letalität durch die Anwendung von REBOA bei Polytraumapatienten.
Es sind weitere Studien notwendig, um die Indikationsstellung zu verbessern und somit Patienten zu identifizieren, die von REBOA profitieren können.
Die niedrige Inzidenz von REBOA-Anwendungen macht sowohl theoretische und praktische Einschulungen als auch regelmäßiges Training im Rahmen von Refresherkursen notwendig.
Die aortale Ballonokklusion kam bereits während des Korea-Krieges in den 1950er-Jahren zum Einsatz, erlebte aber erst Mitte der 1990er-Jahre mit der Weiterentwicklung endovaskulärer Techniken eine Renaissance und wird mittlerweile im klinisch-operativen Alltag von Gefäßchirurgen zur temporären Blutungskontrolle bei einem rupturiertem Aortenaneurysma routinemäßig verwendet. Bei der Versorgung von Polytraumapatienten wird REBOA vor allem im nordamerikanischen Raum, in Japan und in Großbritannien als bedeutend weniger invasive Alternative zur Notfallthorakotomie mit supradiaphragmaler Klemmung der Aorta eingesetzt, da über dieses Verfahren 30–60 Minuten Zeit für eine gezielte Diagnostik und eine geordnete, definitive chirurgische Versorgung im Operationssaal gewonnen werden.
Grundprinzip
Über eine perkutane Punktion oder offen über einen kleinen Hautschnitt wird ein Ballon an der Spitze eines Katheters – unter optimalen Bedingungen mit Durchleuchtungskontrolle – in der Aorta (mit oder ohne Hilfe eines vorher eingebrachten Führungsdrahtes) platziert und entfaltet. Durch den endovaskulären Verschluss der Aorta kommt der Blutfluss distal des Ballons zum Erliegen, wodurch proximal des Ballons eine Verbesserung der hämodynamischen Situation eintritt, bei der die überlebenswichtige myokardiale und zerebrale Oxygenierung gesichert wird. Die Anwendung von REBOA darf aber keinesfalls zu einem verzögerten Beginn einer definitiven chirurgischen Versorgung der Hämorrhagie führen. Beispielsweise bewirkt bei starken abdominellen Blutungen ein Aufschub um 3 Minuten einen Anstieg der Letalität um 1%.
Indikation
REBOA ist indiziert:
bei Polytraumapatienten im therapierefraktären hämorrhagischen Schock bei gesicherten oder vermuteten nichtkomprimierbaren Blutungen im Abdomen, im Retroperitoneum, im Becken, an der Leiste oder am proximalen Bein
bei Verletzten mit traumatischem Herzstillstand infolge einer subdiaphragmalen Blutung.
Von klinischer Bedeutung ist auch das präventive Platzieren des Katheters ohne Okklusion bei potenziellen REBOA-Patienten, da der zeitkritische Schritt des Zugangs noch ohne Stress vorgenommen kann und der liegende Katheter zum arteriellen Druckmonitoring und zur Applikation von Medikamenten genutzt und bei Bedarf jederzeit geblockt werden kann. Kandidaten für REBOA können rasch anhand ihres Verletzungsmusters und der Ursache der Verletzung erkannt werden. Hierzu zählen penetrierende und stumpfe Traumata im abdominellen oder im pelvinen Bereich sowie Beckenfrakturen mit den Zeichen einer hämodynamischen Instabilität.
Kontraindikation
Es herrscht allgemeiner Konsensus, dass REBOA bei schweren intrathorakalen, zervikalen und/oder intrakraniellen Blutungen nicht zum Einsatz kommen darf, da diese Blutungen oberhalb des Zwerchfells durch die aortale Ballonokklusion mutmaßlich verstärkt werden würden. Insbesondere sollte eine (noch) gedeckte Aortenruptur ausgeschlossen werden. Uneinigkeit herrscht jedoch darüber, ob ein Schädelhirntrauma eine Kontraindikation darstellt, da zurzeit noch nicht feststeht, ob der durch REBOA gesteigerte Perfusionsdruck mehr Schaden oder mehr Nutzen bewirkt.
Effizienz
Im Tiermodell ist REBOA der Thorakotomie überlegen. Dies äußert sich in einem geringeren Anstieg des Serum-Laktats, einer geringeren Azidose, einem geringeren Bedarf an Infusionsvolumen und Vasopressoren sowie einer Verbesserung der kardialen Pumpleistung und der zerebralen Perfusion mit geringerer physiologischer Störung. Während erste klinische Studien, die die Anwendung von REBOA bei Traumapatienten im zivilen und militärischen Bereich evaluierten, vielversprechende Ergebnisse präsentierten, lieferten nachfolgende größere Fallserien widersprüchliche Resultate. Aktuelle Auswertungen des „Aortic Occlusion for Resuscitation in Trauma and Acute Care Surgery Registry“ zeigten bei vergleichbarer Verletzungsschwere für die REBOA-Gruppe einen signifikanten Überlebensvorteil sowie eine konsistentere Verbesserung der hämodynamischen Stabilität im Vergleich zur Notfallthorakotomie-Gruppe. Eine kürzlich publizierte Metaanalyse, die die Ergebnisse von 89 aktuellen Studien zusammenfasste, konnte einen signifikanten Anstieg des zentralen systolischen Blutdruckes und eine Verbesserung der Überlebensrate durch den Einsatz von REBOA bei Polytraumapatienten mit hämorrhagischem Schock nachweisen. In der interdisziplinären S3-Leitlinie Polytrauma/Schwerverletzten-Behandlung wird REBOA aufgrund der zurzeit noch nicht ausreichenden Datenlage jedoch nur mit dem Empfehlungsgrad 0 als Option bei „kreislaufinstabilen Patienten in extremis“ genannt.
Technik
Während endovaskulär tätige Gefäßchirurgien und interventionelle Radiologen weitgehend mit Material und Ausführung des REBOA-Manövers vertraut sind und daher nur die Implementierung der einzelnen Schritte in die Abläufe im Operationssaal erlernen müssen, müssen sich Ärzte mit wenig Erfahrung in endovaskulären Eingriffen dieses Notfallverfahren zunächst im Rahmen einer theoretischen und praktischen Schulung antrainieren und in Simulationstrainings immer wieder auffrischen.
Der Zugang zum arteriellen System erfolgt entweder über eine duplexsonografisch gesteuerte Punktion der A.femoralis communis oder bei vorliegender schlechter Kreislaufsituation oder Reanimation über eine offenchirurgische Freilegung des Gefäßes. Eine Punktion der A.femoralis communis nach anatomischen Landmarken und unter palpatorischer Kontrolle sollte nur im Ausnahmefall durchgeführt werden, da hierdurch das Risiko für Zugangskomplikationen wie Blutungen oder Verletzung des Gefäßes steigt.
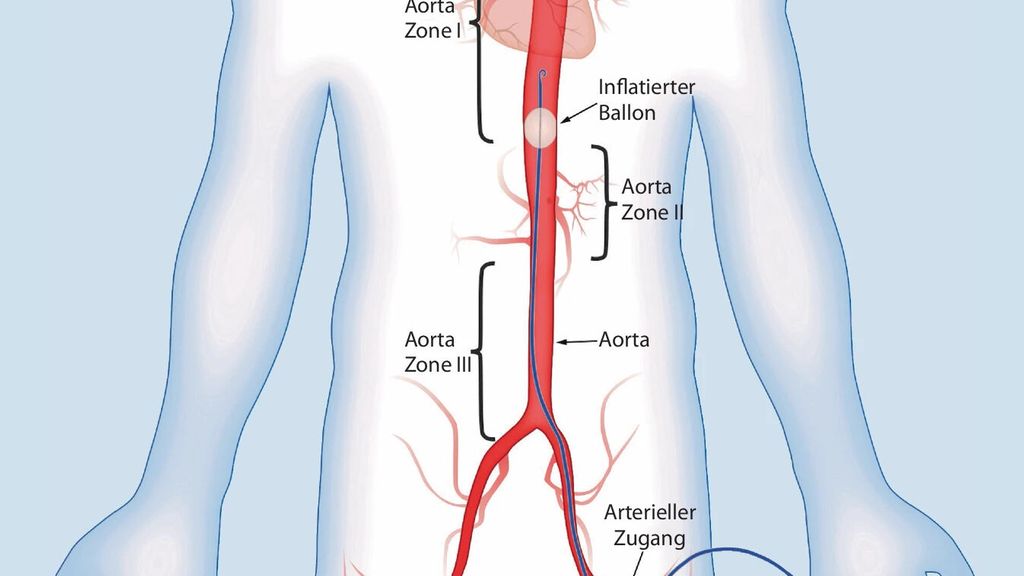
Aktuell sind mehrere Okklusionskatheter mit unterschiedlichen Vor- und Nachteilen verfügbar. Das AKH Wien und das LKH Graz haben sich, wie viele andere Traumazentren auch, für den ER-REBOATM-Katheter der Firma Prytime Medical Devices (USA) entschieden, der ohne Drahtführung positioniert werden kann und nur eine 7-Fr-Zugangsschleuse (anstatt der ursprünglich notwendigen 12-Fr-Schleuse) benötigt. Durch die Verwendung des ER-REBOATM-Katheters wird nicht nur das Zugangstrauma geringer und möglicherweise eine von einem Führungsdraht verursachte Gefäßverletzung vermieden, sondern auch das Notfallverfahren selbst erleichtert. Einen zusätzlichen Vorteil stellen die Längen- und Röntgenmarkierungen auf dem Schaft dar, die die korrekte Platzierung und die Lagekontrolle des in situ befindlichen Ballons vereinfachen. Zur richtigen Positionierung des Ballons wird die Aorta in 3 Zonen eingeteilt, wobei nur Zone I (Aorta thoracica descendens) und Zone III (infrarenale Aorta abdominalis) infrage kommen (Abb.1). Eine Inflation des Ballons in Zone II ist aufgrund des erhöhten Risikos für eine viszerale Ischämie strengstens kontraindiziert.
Abb. 1:a) ER-REBOA™-Katheter; b) Einteilung der Aorta in drei Zonen (mit freundlicher Genehmigung von Prytime Medical, Boerne, Texas, USA)
Bei abdominellen Blutungen ist die Zone I der Zielbereich, wobei die Einführtiefe ungefähr der direkten Distanz zwischen Punktionsstelle und Mitte des Sternums entspricht. Die obligate Lagekontrolle kann mittels transösophagealer Echokardiografie (TEE) erfolgen. Stehen eine TEE-Sonde oder ein im Umgang damit versierter Anwender nicht zur Verfügung, reicht eine Röntgenaufnahme des Thorax bzw. Abdomens für eine ungefähre Kontrolle der Position des Ballons aus, der in Höhe der Brustwirbelkörper 4–11 zu liegen kommen sollte. Bei pelvinen Blutungen ist hingegen eine Platzierung des Ballons in Zone III indiziert, wobei die Einführtiefe dem Abstand zwischen Punktionsstelle und Bauchnabel gleicht. Bei guten Schallbedingungen kann die Position des Ballons, die unterhalb des zweiten Lendenwirbelkörpers angesiedelt sein sollte, neben einer Röntgenaufnahme auch mittels einer Abdomensonografie kontrolliert werden. Zur Blockung wird der Ballons in Zone I mit circa 8ml und in Zone III mit circa 5ml Kochsalzlösung gefüllt.
Nach Versorgung der Blutungen und Organverletzungen im Rahmen einer explorativen Laparotomie erfolgt die Beendigung des REBOA-Manövers. Um ein Reperfusionssyndrom zu vermeiden, sollte die Deflation des Ballons langsam und schrittweise erfolgen. Im Anschluss daran müssen weitere Blutungsquellen ausgeschlossen werden. Es ist obligat, die Perfusion distal der Punktionsstelle vor und nach Entfernung der platzierten Schleuse engmaschig klinisch und sonografisch zu kontrollieren, um einen möglichen embolischen oder thromboembolischen Verschluss der Beingefäße zu erkennen und frühzeitig zu behandeln. Mögliche schwerwiegende systemische Komplikationen des REBOA-Verfahrens können somit direkt ausgeschlossen bzw. behoben werden.
Verfahrensbedingte Komplikationen
Laut aktueller Studienlage sind verfahrensbedingte Komplikationen selten. Zugangskomplikationen umfassen eine Verletzung des Zugangsgefäßes (Perforation, Blutung, Dissektion) und seinen thrombotischen Verschluss sowie eine Embolie der Beingefäße, eine kritische Extremitätenischämie und eine Wundinfektion/Wundheilungsstörung. Komplikationen durch den Ballonkatheter sinddie Perforation und Dissektion der Aorta, die Perforation der Viszeral-/Beckengefäße bei Fehllage, der thrombotische/thromboembolische Verschluss der Viszeral-, Becken- und Beingefäße und die Perforation der V. cava inferior bei venöser Fehllage.
Case Report
Die schwierigsten Entscheidungen in der akuten Unfallchirurgie müssen leider sehr oft unter massivstem Zeitdruck getroffen werden. Die Verarbeitung von Vitalparametern, die Kenntnis von Verletzungsmechanismus, Blutwerten (Blutbild, Gerinnung, Laktat, Entgleisungen des Säure-Basenhaushaltes,…) und Körpertemperatur sowie die Einschätzung der Reserven des Patienten aufgrund seiner allgemeinen Konstitution verlangen viel Wissen und Erfahrung in der Behandlung kritisch verletzter Patienten. Ähnlich einem Piloten in einer Notfallsituation (z.B. Ausfall beider Triebwerke in der Startphase) geht es hier augenscheinlich um einen Grenzgang zwischen dem Abarbeiten von „standard operating procedures“ und Erfahrungswerten und der unvermeidlichen Entscheidung, ob alle Körperfunktionen erhalten werden sollen (sichere Landung auf dem Flughafen und Erhalt des Flugzeuges) oder ein Überleben des Patienten mit Defiziten ermöglicht werden soll (Notwasserung auf dem Hudson-River; das Flugzeug ist verloren, aber alle Insassen überleben). Erfahrungsgemäß ist es schwerer, eine Entscheidung in Richtung „Landung Hudson-River“zu treffen, da Ärzte verständlicherweise das grundsätzliche Bestreben nach Wiederherstellung der Integrität des Patienten haben. Umgekehrt wird das Versterben eines Patienten in der ersten Polytrauma-Versorgungsphase sehr oft dem Umstand des Traumas angelastet und das Behandlungsregime nicht immer kritisch hinterfragt. Folgendes Fallbeispiel aus dem LKH Graz soll einerseits möglichst plastisch und für den Leser nachvollziehbar die Überlegungen des Teams widerspiegeln und andererseits zeigen, welches Outcome durch eine Maximaltherapie im Bereich der „damage control surgery“, gepaart mit dem immer nötigen Quäntchen Glück, erzielt werden kann.
Anfang Juli 2020 wird um 15:35 Uhr der Schockraumalarm ausgelöst, da der Zutransfer eines bereits präklinisch hämodynamisch instabilen Patienten (ein 55-jähriger Motorradfahrer, der mit einem PKW kollidierte) via Rettungshubschrauber angekündigt wird. Um 15:50 Uhr erfolgt die Ankunft des Patienten im Schockraum. Er ist präklinisch intubiert, mit einem systolischem Blutdruck von 85mmHg unter laufendem Arterenol-Perfusor (1mg/10ml) mit 20ml/h, Herzfrequenz 150, O2-Sättigung 99%, etCO2 50mmHg. Präklinisch wurde linksseitig eine Thorakostomie angelegt und anschließend mit einem Tubus drainiert. Weiters wurde das Becken mit einer T-POD-Beckenschlinge stabilisiert und 1g Tranexamsäure verabreicht.
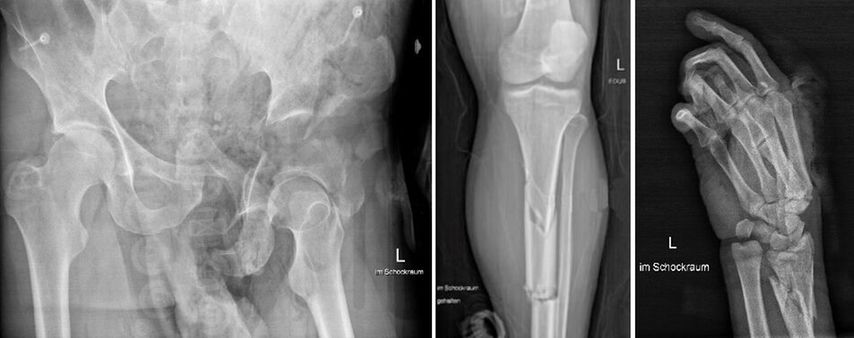
Das Schockraum-ABCDE wird durchgegangen. Im eFAST zeigt sich primär keine freie intraabdominelle Flüssigkeit. Ein Thorax- und ein Beckenröntgen werden angefertigt. Der T-POD wird belassen. Es ist von einem großen darunterliegenden Weichteiltrauma auszugehen. Aufgrund der limitierten Venensituation und des Vorliegens einer Zentralisation muss ein zentraler Venenkatheter angelegt werden. Das Schockraumteam entschließt sich, über die rechte A.femoralis eine REBOA-Schleuse einzubringen, während zeitgleich Röntgenbilder von Unterschenkel und Hand angefertigt werden (Abb.2) und mit dem Massentransfusionsprotokoll begonnen wird (6 Erythrozytenkonzentrate, 1800 PPSB, 4g Fibrinogen, 1g Tranexamsäure). An der linken unteren Extremität zeigt sich eine offene, in einer Vakuumschiene versorgte Unterschenkelfraktur und im Bereich des distalen Unterarms eine drittgradig offene Fraktur mit exzessivem Weichteilschaden, bis in die Mittelhand reichend. Erste ausgewählte Laborparameter sind in Tabelle 1 ersichtlich.
Nach einer Schockraumzeit von 35 Minuten kann das Polytrauma-CT durchgeführt werden. Hier zeigen sich folgende weitere Verletzungen: Scapulafraktur links, Serienrippenfrakturen 1–8links und 1–4 rechts, Leberlazeration, Milzlazeration mit nun schon sichtbarer freier Flüssigkeit, komplexe Acetabulum-/Ileumtrümmerfraktur links mit Abbruch der Kontrastierung der A. iliaca communis mit großem Hämatom und aktivem Kontrastmittelextravasat.
Da der Patient im CT zunehmend instabiler wird (RR-Werte um die 70mmHg systolisch trotz hochdosierter Arterenol-Gabe), wird um 16:50 Uhr ein REBOA-Katheter ohne Bildgebung in die Zone III eingebracht. In Folge stabilisieren sich die RR-Werte relativ rasch auf bis über 120mmHg, sodass der Patient in den Hybrid-OP transferiert werden kann. Nach Entfernung des T-POD zeigt sich eine ausgedehnte Weichteilverletzung mit offenliegender Darmbeinschaufel links.
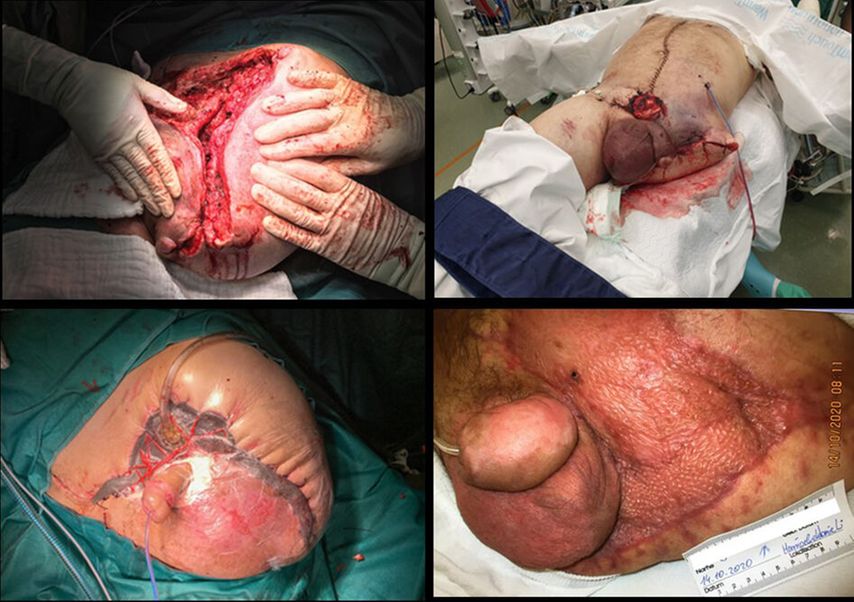
Um 17:18 Uhr erfolgt eine Laparotomie, bei der das Peritoneum nicht eröffnet wird. Innerhalb von wenigen Minuten kann über einen extraperitonealen Zugang die Iliakalgabel geklemmt werden. Da die A.iliaca interna links äußerlich intakt imponiert, wird sie nur angeschlungen. Die A.iliaca externa links hingegen zeigt sich abgerissen, der Stumpf wird geklemmt und dann ligiert. Dank des Okklusionsballons gibt es lokal auch keinerlei arterielle Blutungen aus den von der A.femoralis interna versorgten Gebieten.
Aufgrund der massiven Instabilität des Patienten muss die Entscheidung für eine Amputation bzw. subtotale Hemipelvektomie getroffen werden. Nach dem Abklemmen der Venen wird der Ballon nach einer Cuff-Zeit von etwa 40 Minuten vorsichtig abgelassen, wodurch der Blutdruck nur minimal fällt. Eine Hemipelvektomie mit Belassen von ausreichend durchbluteter Haut für den sekundären Wundverschluss wird durchgeführt und der verbleibende Hohlraum mit Bauchtüchern ausgestopft und gepackt. Der Situs ist trocken und die Hämodynamik des Patienten stabil.
Der hinzukommende Allgemeinchirurg eröffnet nun das Peritoneum. Da sich ein mäßiger Hämaskos (ca. 500ml) zeigt, erfolgen eine sofortige Splenektomie sowie die Versorgung der Leberlazerationen in den Segmenten II/IV und VI. Nach Beendigung der Eingriffe am Körperstamm ist der Patient deutlich stabiler, sodass die Katecholamindosen wesentlich reduziert werden können. Die Operation ist nach 90 Minuten beendet. Da das Laktat auf 9,4mmol/l und der pH-Wert auf 7,2 gesunken und das Hämoglobin auf 7,5g/dl gestiegen sind, fällt die Entscheidung, auch noch die schwerverletzte Hand zu versorgen. Eine genauere Exploration zeigt einen Teilausriss des N.medianus neben einer drittgradig offenen Radiusfraktur sowie Mittelhand- und Fingerfrakturen. Das Kleinfingerendglied muss amputiert werden. Anschließend wird das gesamte Decollement im Bereich des Handrückens débridiert, wundversorgt und die Operation mit dem Anlegen eines Handgelenksfixateurs beendet.
In der ersten Nacht auf der Intensivstation ist der Patient noch erheblich substitutionspflichtig und zeigt eine massive Rhabdomyolyse. Ein Adsorptionsfilter wird eingeschaltet und eine kontinuierliche venovenöse Hämodiafiltration (CVVHDF) wird begonnen. Am Folgetag sinkt der Katecholaminbedarf weiter, sodass auch die REBOA-Schleuse entfernt werden kann. Am Tag 3 erfolgt ein Depacking bei mittlerweile metabolisch ausgeglichenem Patienten. Es werden ein protektives Colostoma und ein VAC-System angelegt, da mit einem weiteren Untergang der Weichteile zu rechnen ist. An den Tagen 6 und 10 erfolgen die nächsten VAC-Wechsel nach einem erneuten Weichteildébridement sowie die Anlage eines Tracheostomas. Am Tag 13 reagiert der Patient erstmals ungezielt auf Ansprache. Am Tag 15 wird neben dem Becken auch die Handverletzung weiterversorgt. Am Tag 24 ist der Patient erstmals basal kontaktierbar, am Tag 34 kann er auf die Allgemeinstation verlegt werden. Schlussendlich wird die Wundfläche am Becken mit einem Rectuslappen und mit Spalthaut verschlossen. Bei der Verlegung in das Rehabilitationszentrum ist die Wunde noch leicht sezernierend. Der Patient ist neurologisch komplett erholt und hat bereits einige Stehversuche hinter sich.
Literatur:
bei den Verfassern
Das könnte Sie auch interessieren:
Rotatorenmanschetten-Ruptur: Zahl der Eingriffe sagt klinischen Verlauf vorher
Eingriffe an der Rotatorenmanschette gehören zum orthopädischen Standard. Heute werden sie routinemässig arthroskopisch durchgeführt. Am Kongress der Gesellschaft für Arthroskopie und ...
Schenkelhalsfrakturen bei Menschen mit Demenz
Patienten mit Hüftfraktur sollten zeitnah operiert werden, wenn es die Indikation zulässt – auch im Falle einer Demenz. Denn ein konservatives Vorgehen geht vor allem bei Kopf-Hals- ...
«Auch Patienten mit Demenz profitieren von einer chirurgischen Stabilisierung»
Patienten mit Hüftfraktur und einer leichten, mittelschweren oder schweren Demenz haben ein geringeres Risiko zu sterben, wenn sie operiert werden – vor allem wenn es sich um Kopf-Hals- ...