<p class="article-intro">Was tun, wenn trotz maßgeschneiderter Therapie mit DMARDs einzelne Gelenke nicht ansprechen? Was kann als additive Maßnahme nach einer Synovektomie bei einer zwar gutartigen, jedoch zu Rezidiven neigenden tumorösen Erkrankung eingesetzt werden? Bahnbrechende Erfolge erzielt die Radiosynoviorthese derzeit als Blutungsrezidivprophylaxe zur Behandlung der Hämophilie-Arthropathie, um eine fortschreitende Gelenkszerstörung zu verhindern. Diese beispielhaften Indikationen unterstreichen die Wertigkeit dieser minimal invasiven lokalen Therapie, die bei radiologisch gesteuerter Punktion, sorgfältiger Handhabung und bei Beachtung der entsprechenden strahlenhygienischen Maßnahmen eine äußerst geringe Nebenwirkungs- und Komplikationsrate aufweist.</p>
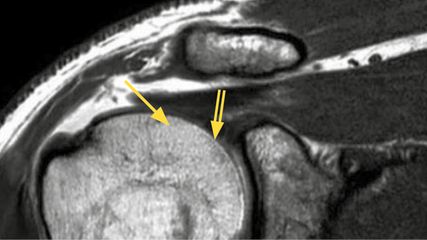
<p class="article-content"><div id="keypoints"> <h2>Keypoints</h2> <ul> <li>Die Radiosynoviorthese ist bei Einhaltung der strahlenhygienischen Richtlinien eine potente, sichere und kostengünstige Methode zur Behandlung einer chronischen Arthritis bzw. Synovitis.</li> <li>Auch im Zeitalter der DMARDs behält die RSO-Therapie ihren Stellenwert als ergänzende lokale Therapie im Formenkreis der rheumatoiden Arthritis und seronegativen Spondylarthropathien.</li> <li>Exzellente Erfolge werden derzeit bei der Behandlung der Hämarthropathie bei der genetisch bedingten Form der Hämophilie A und B erzielt.</li> <li>Auch andere Formen der Synovitiden, wie postoperativ nach Gelenksersatz oder bei aktivierten Arthrosen, sind der RSO-Therapie zugänglich.</li> <li>Wegen des auf das behandelte Gelenk beschränkten Einsatzes des Betastrahlers sind für den Patienten keine weiteren Auswirkungen der Radioaktivität zu erwarten.</li> </ul> </div> <p>Die Radiosynoviorthese (RSO) ist eine minimal invasive, lokale Gelenkstherapie in Form einer intraartikulären Applikation eines Radiopharmakons, eines Betastrahlers, zur Behandlung einer chronischen Synovitis mit ihren klinischen Erscheinungen wie Schmerzen, Schwellung bzw. Gelenkserguss. Das Ziel der Therapie ist die Fibrosierung bzw. Rückbildung der abnormen hypertrophen synovialen Membran des betroffenen Gelenkes. Prinzipiell behandelbar sind alle Formen einer chronischen aseptischen Gelenksentzündung (Tab. 1), unabhängig von ihrer Ätiologie, wobei die Überlegenheit gegenüber einer alleinigen intraartikulären Kortisongabe mehrmals in größeren Patientenkollektiven nachgewiesen wurde.<sup>1</sup> Die ersten Schritte dieser minimal invasiven Gelenkstherapie reichen bis ca. 100 Jahre zurück. Die ersten größeren Studien erschienen in den 1960er-Jahren. Damals wurde radioaktives Gold zur Behandlung von rezidivierenden Gelenksergüssen des Knies eingesetzt. Das Radioisotop Yttrium-90 fand später breiten Einzug in die Therapie des Kniegelenkes. Die zunehmende Verbreitung dieser Methode begann dann in den 1990er-Jahren mit Anwendung von Rhenium- 186 für die mittelgroßen Gelenke und Erbium-169 für die kleinen Fingerund Fußgelenke.<sup>2, 3</sup></p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Jatros_Ortho_1904_Weblinks_jatros_ortho_1904_s61_tab1_oder.jpg" alt="" width="550" height="221" /></p> <h2>Wirkprinzip der RSO</h2> <p>Das Prinzip ist die lokale intraartikuläre Applikation eines Betastrahlers, eine korpuskulare Strahlung durch Elektronen, die durch den Zerfall des applizierten Radioisotops entstehen. Das in kolloidaler Form applizierte Radionuklid (wobei der durchschnittliche Durchmesser eines Partikels von 2μm bis 5μm zwar die Phagozytose erlaubt, allerdings den kapillären Abtransport verhindert) wird von den oberflächlichen Synovialzellen (Typ 2) aufgenommen. Durch die Betastrahlung kommt es zu einer Ionisation von intrazellulären Molekülen, zur Freisetzung von freien Radikalen, mit nachfolgender Apoptose und Ablation der hypertrophen Synovitis sowie Rückbildung der chronischen Entzündung.<br />Die heutzutage verwendeten Radioisotope sind Yttrium-90, Rhenium-186 und Erbium-169, welche sich hinsichtlich ihrer Reichweite, Energie, Penetration sowie Halbwertszeit unterscheiden. Während Yttrium-90 nur für die Therapie des Kniegelenkes zugelassen ist, wird Rhenium-186 für alle mittelgroßen Gelenke wie Schulter-, Hüft- oder Handgelenk verwendet. Kleine Gelenke, wie beispielsweise die Interphalangealgelenke, werden mit Erbium- 169 behandelt.<br />Die Dosis des applizierten Radiopharmakons richtet sich in erster Linie nach der Größe des Gelenkes und in weiterer Folge auch nach dem Ausmaß der entzündlichen Aktivität und nach der klinischen Beschwerdesymptomatik.<br />Die Reichweite der Penetration, i. e. die Reichweite der emittierten Strahlung, liegt bei Yttrium-90 im Mittel bei 4 mm (maximal bei 11 mm), bei Rhenium-186 im Mittel bei 1,5 mm (maximal 3,7 mm) und bei Erbium- 169 im Mittel bei 0,3 mm (maximal 1,0 mm). Neben der therapeutisch genutzten Betastrahlung wird bei Rhenium-186 auch die zum geringen Teil vorhandene Gammastrahlung zur Bildgebung (Verteilungsszintigramm, siehe Abb. 1) genutzt. Die Verteilung von Yttrium-90 kann durch die sekundär entstandene Bremsstrahlung mittels Gamma-Kamera verifiziert und somit auch bildgebend dargestellt werden. Die erzielte intraartikuläre Verteilung des Radionuklids kann somit festgehalten werden. Aufgrund der sehr schwachen Aktivität von Erbium-169 kann dieses bildgebend nicht erfasst werden.<br />Der Eingriff selbst wird unter maximalen aseptischen Bedingungen durchgeführt, in der Regel im Applikationsraum einer Abteilung für Nuklearmedizin unter Einhaltung der entsprechenden Strahlenschutzmaßnahmen sowohl für den Patienten als auch für das Personal. Die Punktion erfolgt durchleuchtungsgezielt mittels CBogen, die korrekte Nadelposition wird mittels Arthrogramm (Abb. 2) bestätigt. Nach der Applikation des Betastrahlers wird ein lang wirksames Glukokortikoid teils intra-, teils periartikulär injiziert. Die letztere Injektion führt auch zu einer Plombierung der Gelenkskapsel, um ein vorzeitiges Entweichen des Betastrahlers zu verhindern. Danach wird unter Kompression des Stichkanals das Gelenk mehrmals durchbewegt und anschließend für 48 Stunden ruhiggestellt. Nach diesem Zeitraum ist die verabreichte Aktivität resorbiert und der Patient kann das Gelenk wieder belasten bzw. bewegen.<br /> Voraussetzung für die Durchführung der Anwendung des Radiopharmakons ist der Nachweis einer Synovitis, welcher sonografisch mittels Hochfrequenz-Ultraschallkopf (bis 12–18 MHz) erbracht werden kann. Dokumentiert werden die hypertrophe Synovia, das pannusartige Gewebe sowie die meist erhöhte Vaskularisation. Diese rasch durchführbare, unkomplizierte und patientenschonende Untersuchung ersetzt meist – in Zusammenarbeit mit erfahrenen zuweisenden Ärzten – aufwendigere apparative Verfahren, wie die Mehrphasen- Gelenks/Knochenszintigrafie mittels Technetium- 99-Diphosphonat oder kontrastmittelverstärkter MRT-Verfahren. Andererseits ist die derzeit sensitivste Methode zur Erfassung einer Synovitis, insbesondere im Hinblick auf die Frühdiagnostik von rheumatologischen Systemerkrankungen, zweifelsfrei die MRT in einem 3,0-Tesla-Magnetfeld, kontrastmittelverstärkt, unter Anfertigung von T1-betonten fettgesättigten Aufnahmen (Abb. 3). Eine meist ausreichende Sensitivität besitzt auch die Mehrphasen- Gelenks/Knochenszintigrafie mittels Technetium-99-Diphosphonat, wobei in der Weichteilphase nach 10 Minuten eine entsprechende Mehranreicherung des applizierten Tracers bei entzündlich veränderten Gelenken nachzuweisen ist, hervorgerufen durch eine gesteigerte Durchblutung und eine erhöhte Kapillarpermeabilität (Abb. 4). In der Spätphase nach 2–3 Stunden lässt sich dann der Einbau in ossäre Umbauprozesse festhalten. Im besonderen Fall der Synovitis bei Gelenksersatztherapie ist die Mehrphasen-Gelenks/Knochenszintigrafie gegenüber der MRT –aufgrund der artefaktbehafteten Bildgebung der Letzteren – die Methode der Wahl und kann in gleicher Sitzung auch oft richtungsweisende Hinweise im Falle einer Prothesenlockerung geben.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Jatros_Ortho_1904_Weblinks_jatros_ortho_1904_s61_abb1-3_oder.jpg" alt="" width="800" height="317" /></p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2019_Jatros_Ortho_1904_Weblinks_jatros_ortho_1904_s62_abb4_oder.jpg" alt="" width="425" height="482" /></p> <h2>Indikationen</h2> <p><strong>Arthritis bei Erkrankungen im rheumatologischen Formenkreis</strong><br />Die RSO-Therapie behält auch im Zeitalter der „disease-modifying antirheumatic drugs“ (DMARDs) ihren Stellenwert.<sup>4</sup> Indikationen sind weiterhin durch die Systemerkrankung betroffene, jedoch therapierefraktäre Gelenke nach medikamentöser Therapie für zumindest ein halbes Jahr. Auch ein gelegentlich vorkommendes erhöhtes Nebenwirkungsprofil einzelner Medikationsformen kann das Ausweichen auf eine lokale Therapie einleiten. Die RSO-Therapie ist auch eine Therapieoption vor einer möglicherweise unausweichlichen arthroskopischen Synovektomie. Neben der rheumatoiden Arthritis sind auch die einzelnen Krankheitsbilder der seronegativen Spondyloarthropathien (SpA) mit peripherer Gelenksbeteiligung etablierte Indikationen, wobei bei der Letzteren häufig auch das Kniegelenk sowie die mittelgroßen Gelenke therapiert werden. Bei der rheumatoiden Arthritis sind meist die metacarpophalangealen Gelenke sowie die proximalen Interphalangealgelenke betroffen.</p> <p><strong>Aktivierte Arthrosen</strong><br />Prinzipiell ist die RSOTherapie für schmerzhafte, geschwollene und degenerativ veränderte Gelenke bei Nachweis einer Synovitis zugelassen. Eine unter dieser Voraussetzung häufige Zuweisung zur RSO betrifft die aktivierte Arthrose des Daumensattelgelenks (Rhizarthrose), die auch ein meist sehr gutes Ansprechen zeigt. Nicht mehr sinnvoll ist die RSOTherapie jedoch bei zunehmender Gelenksdestruktion im Rahmen einer weit fortgeschrittenen Arthrose, hier ist auch bei Rückgang des Synovitis der klinische Benefit für den Patienten oft nur minimal.</p> <p><strong>Persistierende Synovitis</strong><br />Relativ unabhängig von der kausalen Genese, die auch oft nicht exakt geklärt werden kann, sprechen persistierende Reizungen der Gelenksinnenhaut auf die lokale minimal invasive Maßnahme gut an. Als Sonderform sei hier die persistierende Synovitis nach Gelenksersatztherapie erwähnt, die manchmal auch zeitversetzt entstehen kann. Bei Ausschluss einer Lowgrade- Infektion, Metallallergie oder Prothesenlockerung bildet sich hier bei korrekter Injektionstechnik die chronische Entzündung in der Regel zurück.<sup>5</sup></p> <p><strong>Hämarthros bei Hämophilie</strong><br />Hämarthropathien sind leider eine rezidivierende Manifestation der genetisch bedingten Hämophilie Typ A und Typ B in großen und mittelgroßen Gelenken und kausal für die Entstehung einer Arthrose verantwortlich. Die RSO ist als Erstlinientherapie imstande, eine chronische Synovitis zu verhindern und somit weitere Blutungskomplikationen vermeiden zu helfen. Weiters werden auch die anderen Symptome der chronischen Arthrose, wie Schwellung, Schmerz und Bewegungseinschränkungen, signifikant verringert.<sup>6</sup> Operative Eingriffe wie Synovektomie oder arthrodetische Eingriffe in fortgeschrittenen Stadien der Arthrose werden erst bei Fortschritt der Hämarthropathie trotz Optimierung der medikamentösen Therapie bzw. Anwendung der RSO-Therapie eingesetzt. Eine enge Zusammenarbeit mit einer hämatologischen Abteilung ist Voraussetzung, da der Eingriff nur unter entsprechender Substitution der Gerinnungsfaktoren durchgeführt werden kann.</p> <p><strong>Rezidivprophylaxe nach operativen Eingriffen bei tumorösen Erkrankungen</strong><br />Die pigmentierte villonoduläre Synovitis ist eine aggressive synoviale Proliferation. Da eine totale chirurgische Synovektomie nur in den seltensten Fällen möglich ist, stehen entweder die externe Radiatio oder die RSO-Therapie als ergänzende Maßnahmen zur Verfügung. Die RSO-Therapie wird als Rezidivprophylaxe seit Langem angewandt und die Wertigkeit konnte in der gegenwärtigen Literatur bestätigt werden, obwohl einzelne Autoren auch kontroverse Ergebnisse auflisteten.<sup>7, 8</sup> Die Einhaltung eines zumindest achtwöchigen Intervalls nach der Durchführung einer endoskopischen oder offenen Synovektomie dient der Vermeidung einer extraartikulären Verteilung des Radiopharmakons.</p> <h2>Wirkeintritt und Effizienz</h2> <p>Durch die begleitende Glukokortikoidapplikation erfährt der Patient zunächst meist eine spürbare Erleichterung seiner Beschwerden, der Wirkeintritt der Radiosynoviorthese ist jedoch erst nach einigen Wochen bis Monaten – nach Abbau der chronischen Entzündung – zu erwarten. Nach sechs Monaten kann der endgültige Therapieerfolg bewertet werden. Ist er nicht suffizient, kann die RSO-Therapie wiederholt werden. Metaanalysen erarbeiteten eine durchschnittliche Erfolgsrate von etwa 75 % .<sup>9</sup></p> <h2>Nebenwirkungen und Komplikationen</h2> <p>Bei korrekter Technik ist die Rate an unerwünschten Wirkungen und Komplikationen sehr gering. Möglich ist eine Radiosynovitis einige Tage bis Wochen nach dem Eingriff, welche aber durch die simultane Injektion von Glukokortikoiden vermieden werden kann. Falls ein Beschwerden verursachender Gelenkserguss auftritt, kann er in einer nuklearmedizinischen Abteilung punktiert werden, mit entsprechender Versorgung des Aspirats.<br /> Bei Applikationen an kleinen Fingergelenken ist die Möglichkeit eines Rückflusses von geringen Mengen der applizierten radioaktiven Substanz prinzipiell gegeben, der Erytheme und Irritationen lokal verursachen kann (sogenannte Beta-Burns). Allerdings kann dies durch die sogenannten Kortisonplomben vermieden werden.<br /> autulzerationen und Nekrosen des Unterhautgewebes und der Muskulatur sind zwar extrem seltene, aber gefürchtete Komplikationen bei der Anwendung von Yttrium und Rhenium, im Falle einer extraartikulären Verteilung des Radioisotops, hervorgerufen durch eine Fehlinjektion, Rückfluss oder Ruptur einer Kapselzyste. Als therapeutische Optionen stehen hier neben der symptomatischen lokalen Behandlung die hyperbare Sauerstofftechnik sowie – im Falle einer Yttrium- induzierten Nekrose – chirurgische bzw. plastisch deckende Verfahren zur Verfügung.<br />Das Infektionsrisiko wird mit 1:35 000 angeben. Es ist bis dato keine erhöhte Inzidenz von malignen Erkrankungen im Anschluss an die RSO nachgewiesen worden.<sup>10, 11</sup></p></p>
<p class="article-footer">
<a class="literatur" data-toggle="collapse" href="#collapseLiteratur" aria-expanded="false" aria-controls="collapseLiteratur" >Literatur</a>
<div class="collapse" id="collapseLiteratur">
<p><strong>1</strong> Kahan A et al.: 169Erbium-citrate synoviorthesis after failure<br />of local corticosteroid injections to treat rheumatoid<br />arthritis-affected finger joints. Clin Exp Rheumatol 2004;<br />22(6): 722-6 <strong>2</strong> Chojnowski MM et al.: Radionuclide synovectomy<br />- essentials for rheumatologists. Reumatologia<br />2016; 54(3): 108-16 <strong>3</strong> Mödder G: Die Radiosynoviorthese:<br />Nuklearmedizinische Gelenktherapie (und -diagnostik) in<br />Rheumatologie und Orthopädie. Meckenheim: Wahrlich,<br />1995<strong> 4</strong> Wong Y et al.: Efficacy of yttrium-90 synovectomy<br />across a spectrum of arthropathies in an era of improved<br />disease modifying drugs and treatment protocols. Int J<br />Rheum Dis 2014; 17(1): 78-83 <strong>5</strong> Mayer-Wagner S et al.: Radiosynoviorthesis<br />for treating recurrent joint effusions after<br />endoprosthetic knee replacement: Clin Nucl Med 2012;<br />37(8): 727-31 <strong>6</strong> Rodriguez-Merchan EC: Radiosynovectomy<br />in haemophilia. Blood Rev 2019; 35: 1-6 [Epub ahead of<br />print] <strong>7</strong> Koca G et al.: A low recurrence rate is possible with<br />a combination of surgery and radiosynovectomy for diffuse<br />pigmented villonodular synovitis of the knee. Clin<br />Nucl Med 2013; 38(8): 608-15 <strong>8</strong> Gortzak Y et al.: Inconclusive<br />benefit of adjuvant 90Yttrium hydroxyapatite to radiosynovectomy<br />for diffuse-type tenosynovial giant-cell tumour<br />of the knee. Bone Joint J 2018; 100-B(7): 984-8 <strong>9</strong><br />Kresnik E et al.: Clinical outcome of radiosynoviorthesis: a<br />meta-analysis including 2190 treated joints. Nucl Med<br />Commun 2002; 23: 683-8 <strong>10</strong> Kampen WU et al.: Serious<br />complications after radiosynoviorthesis. Survey on frequency<br />and treatment modalities. Nuklearmedizin 2006;<br />45(6): 262-8 <strong>11</strong> Infante-Rivard C et al.: A retrospective cohort<br />study of cancer incidence among patients treated<br />with radiosynoviorthesis. Haemophilia 2012; 18(5): 805-9</p>
</div>
</p>