Neue Daten zum Nierenzellkarzinom
Autorin:
Univ.-Prof. Dr. Manuela Schmidinger
Universitätsklinik für Innere Medizin I
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auf dem ASCO-Kongress 2024 wurden auf dem Gebiet des Nierenzellkarzinoms (RCC) zwar keine Daten präsentiert, die einen Paradigmenwechsel herbeiführen werden, es gab jedoch einige interessante Neuigkeiten, die die Therapiestrategien in der näheren Zukunft optimieren könnten. Diese umfassen das Thema der Biomarker im adjuvanten Setting, Therapieempfehlungen für Patienten mit günstigem IMDC-Score, längst fällige Überlebensdaten aus einer Phase-III-Studie, Ergebnisse zum chromophoben RCC und Therapieerfolge im Post-Lenvatinib-Setting.
Keypoints
-
KIM-1 hat als Biomarker das Potenzial, in der Zukunft Patienten für eine adjuvante Therapie zu selektionieren.
-
„Favorablerisk“Patienten sind nicht alle gleich: Jene, die als mit „very favorable risk“ eingestuft werden, benötigen eine TKI-hältige Erstlinientherapie.
-
Avelumab + Axitinib zeigt gegenüber Sunitinib keinen Überlebensbenefit.
-
Patienten mit chromophobem RCC benötigen eine Kombinationstherapie.
-
Das therapeutische Spektrum nach einer Lenvatinib-basierten Erst- oder Zweitlinientherapie gestaltet sich schwierig.
Neues aus dem adjuvanten Setting
Nachdem bereits beim ASCO GU 2024 in San Francisco berichtet worden war, das eine adjuvante Therapie mit Pembrolizumab nicht nur das „disease-free survival“ (DFS), sondern auch das Gesamtüberleben (OS) verlängert, ist die adjuvante Gabe von Pembrolizumab etabliert. Dies betrifft Patienten mit intermediär-hohem oder hohem Rückfallsrisiko sowie jene mit Zustand nach Resektion von Metastasen (M1 – „no evidence of disease“). Dennoch stellt sich oft die Frage, ob die Kriterien, die zur Definition des Rückfallsrisikos herangezogen werden, ausreichen, um das tatsächliche Risiko in Bezug auf die individuelle Biologie korrekt einzuschätzen.
„Kidney injury-1 molecule“ (KIM-1)
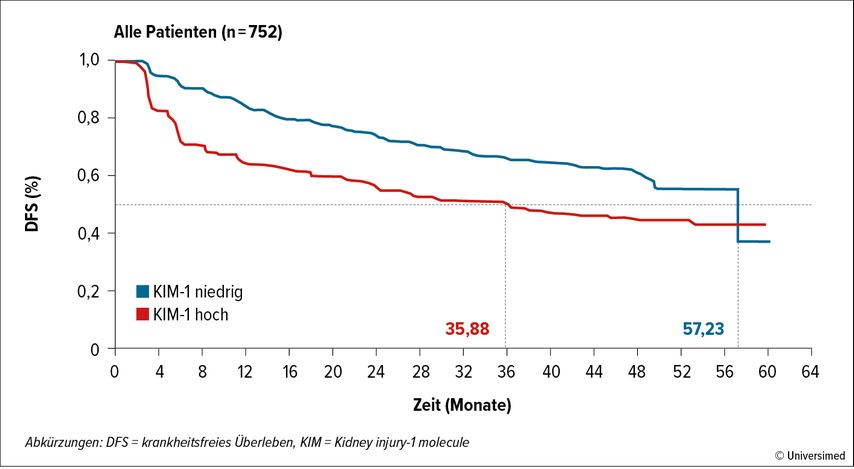
Auf dem ASCO 2024 wurde von Albiges et at. ein sehr interessanter Biomarker vorgestellt, der sowohl prognostisch als auch prädiktiv sein dürfte.1 Der identifizierte Biomarker„Kidney injury-1 molecule“(KIM-1) ist ein Membran-Glykoprotein. Bei Patienten der adjuvanten Phase-III-Studie IMmotion0102 wurde aus dem Serum eine Proteomanalyse durchgeführt, wobei die Proben zu Baseline, während der adjuvanten Therapie und zum Zeitpunkt des Rezidivs abgenommen wurden. Hierbei wurde KIM-1 als das am signifikant stärksten angereicherte Protein bei Patienten mit Rezidiven versus Baseline identifiziert.
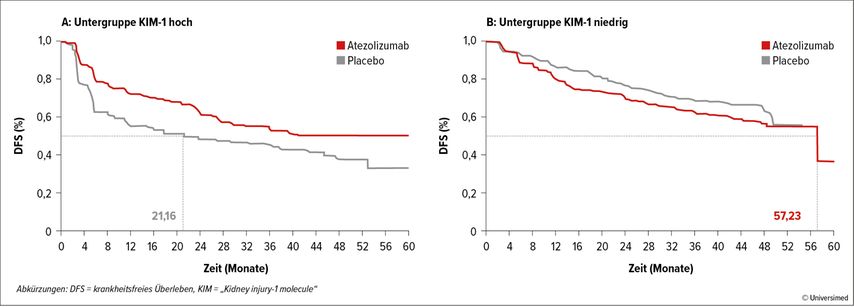
Die Rolle von KIM-1 als Biomarker aus dem Blut ist nicht ganz unbekannt. Im diagnostischen Bereich wurde KIM-1 mit einem höheren Risiko für das Vorhandensein eines Nierenzellkarzinoms assoziiert und war zudem auch zur Differenzierung zwischen benignen und malignen Läsionen geeignet.3,4 Im adjuvanten Setting nach Nephrektomie war KIM-1 innerhalb der Population der ASSURE-Studie und der StudieCheckMate-914 Part Amit „minimal residual disease“ und schlechterem DFS und OS assoziiert.5,6 Im Stadium der Metastasierung konnte bei Patienten der CheckMate-009-Studie gezeigt werde, dass ein Abfall von KIM-1 unter Nivolumab mit klinischem Ansprechen assoziiert ist. In der nun vorliegenden Studie von Albiges et al. war KIM-1 sowohl prognostisch als auch als prädiktiv: Patienten mit niedrigen KIM-1-Werten hatten ein signifikant längeres DFS als jene mit hohen KIM-1-Werten (Abb. 1); Patienten mit hohen KIM-1-Werten hatten in Gegensatz zu Patienten mit niedrigen KIM-1-Werten einen signifikanten Benefit durch Atezolizumab im adjuvanten Setting (Abb. 2).
Neues aus dem metastasierten Setting
Behandlung bei„favorable risk“
Neuigkeiten betreffen hierbei ausschließlich Patienten mit günstigem IMDC-Risikoprofil. Zarba M et al7 haben diese Population aus dem International mRCC Database Consortium (IMDC) näher in Bezug auf Ansprechen auf systemische Therapien untersucht und dabei eine neue Gruppe von Patienten innerhalb derjenigenmit „favorable risk“ definiert, nämlich jene mit „very favorable risk“.Die Definition dieser „Very favorable risk“-Gruppe beinhaltet folgende Kriterien: Zeitraum von der Diagnose des Primärtumors bis zur systemischen Therapie für Metastasen 3 Jahre oder mehr; keine Gehirn-, Leber- oder Skelettmetastasen; Karnofsky Performance Status 90 oder 100% (Tab. 1).7
Tab. 1: Patienten fallen bei Vorliegen von Risikofaktoren in folgende IMDC-Risikogruppen: 0 Risikofaktoren: gute Prognose; 1–2 Risikofaktoren: intermediäre Prognose; ≥3 Risikofaktoren: schlechte Prognose (modifiziert nach International mRCC Database Consortium; www.imdconline.com), sowie die Definition „very favorable risk“ (nach Zarba M et al. 2024)7
Diese Population ist in Bezug auf Benefit von systemischer Therapie besonders interessant, da die ESMO-Therapie-Guidelines in der neuen, aktualisierten Version nun auch die duale Immuncheckpoint-Inhibition mit Nivolumab (Nivo) und Ipilimumab (Ipi) für diese Patienten empfehlen (IC-Empfehlung; Tab. 2);7 zuvor warNivolumab+Ipilimumab nur eine Therapie für Patienten mit intermediärem oder ungünstigem Risiko.
Tab. 2: ESMO-Guidelines 2024: Nivolumab + Ipilimumab ist jetzt auch eine Behandlungsoption bei „favorable risk“ (nach Zarba M et al. 2024)7
Zarba et al. kommen zu folgenden Ergebnissen:
-
Das Gesamtüberleben ist bei allen Patienten mit „favorable risk“ mit allen 3 Therapieoptionen vergleichbar, bei den Patienten mit „very favorable risk“ sind aber eine „Vaskulärerendothelialer Wachstumsfaktor“-Tyrosinkinase-Inhibitor-Therapie (VEGFR-TKI) und eine Immun-Tyrosinkinaseinhibitor-Therapie (IO-TKI) deutlich besser als Nivo+Ipi (p=0,0412),
-
Die Ansprechrate aller Patienten mit „favorable risk“ist mit Ipi+Nivo 35%, mit IO-VEGF 51,40% und mit TKI allein 37,90% (p=0,06), bei den Patienten mit„very favorable risk“ schneiden mit Ipi+Nivobehandelte Patienten deutlich schlechter ab (23,50% versus 58,10% und 55%), p=0,039.
-
Die Zeit bis zur Notwendigkeit einer neuen Behandlung ist mit Nivo+Ipi und VEGFR-TKI signifikant kürzer als mit IO-VEGFR bei allen „Favorable risk“-Patienten (Nivo+Ipi 22,3 Monate, IO-VEGF 32,2 Monate, VEGFR-TKI 15,8 Monate) und„Very favorable risk“-Patienten (Ipi + Nivo 27,1 Monate, IO-VEGF 48,3 Monate, VEGF 23,2 Monate); p=0,024.
Basierend auf diesen Ergebnissen gilt es, wenn hinkünftig auch bei „Favorable risk“-Patienten Nivo+Ipi zum Einsatz kommen sollte, genau zu überprüfen, ob der Patient nicht in die „Very favorable risk“-Gruppe fällt und somit besser mit IO-VEGF behandelt werden sollte.
Biomarker im Metastasenstadium
Keine wesentliche Hilfe in der Selektion der individuell besten Therapie bringen zwei große Biomarkeranalysen aus den Zulassungsstudien KEYNOTE-4268 und CLEAR;9 bei KEYNOTE-426 (Axitinib+Pembrolizumab versus Sunitinib) wurde eine RNA-Sequenzanalyse durchgeführt. Die Erkenntnis war, dass ein„T-cell-inflamed“ Expressionsprofil mit Ansprechen auf Pembrolizumab+Axitinib korreliert, während ein Angiogenese-Profil mit dem Ansprechen auf Suntinib assoziiert ist.10 Ähnliche Daten wurden in der Vergangenheit auch in anderen Immuntherapiestudien generiert. Bei der CLEAR-Studie wurde in Biomarkeranalysen festgestellt, dass Lenvatinib+Pembrolizumab besser als Sunitinib ist, unabhängig vom Biomarke-Subtyp, vom genetischen Driver der Erkrankung und von der Gensignatur.11
Endgültige Überlebensdaten aus JAVELIN Renal 101
In dieser Phase-III-Studie der PD-L1-Inhibitor Avelumab kombiniert mit Axitinib einen Benefit im progressionsfreien Überleben gegenüber Sunitinib zeigen.12 Im Gegensatz zu anderen Phase-III-Kombinationsstudien waren die Überlebensdaten lange nicht reif. Nun wurde die finale Analyse vorgestellt: Weder bei Patienten mit PD-L1+-Tumoren (primärerer Endpunkt) noch in der Gesamtpopulation konnte durch Avelumab+Axitinib ein Überlebensbenefit versus Sunitinib erreicht werden; angesichts dreier anderer IO-TKI-Studien mit signifikantem Überlebensvorteil im experimentellen Arm kann daher die Gabe von Avelumab+Axitinib heute nicht mehr empfohlen werden, sofern eine der anderen drei Therapien zur Verfügung steht.
Outcome von Patienten mit chromophobem RCC
Neues im Setting der Patienten mit „non-clear cell RCC“ mit Fokus auf das chromophobe RCC wurde von Doshi S et al.13 im Rahmen einer retrospektiven Multicenteranalyse vorgestellt. Die Autoren analysierten die Effektivität von 4 verschiedenen Therapiestrategien bei 102 Patienten mit chromophobem RCC. Die Strategien umfassten:
-
Monotherapie (VEGFR-TKI oder mTOR-Inhibitor; mTOR = „mammalian Target of Rapamycin“);
-
Doppeltherapie bestehend aus VEGFR-TKI+mTOR-Inhibitor,
-
Doppeltherpie mit IO+VEGFR-TKI und
-
Immuntherapie allein.
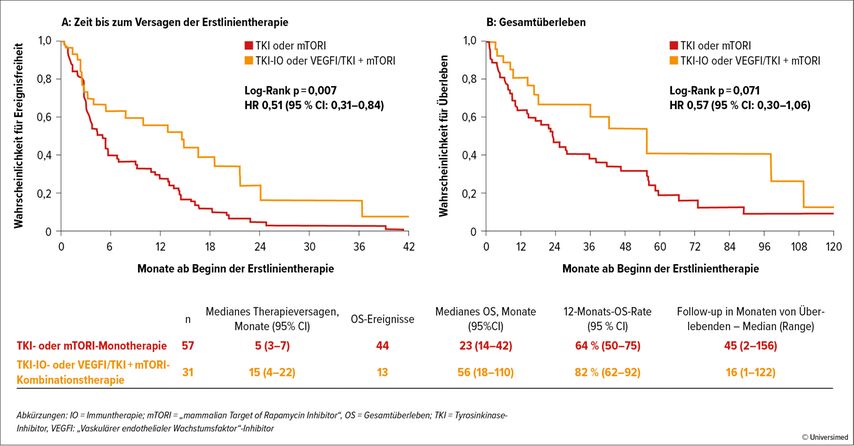
Wie aus Abbildung 3 erkennbar ist, profitieren Patienten mit chromophobem RCC von einer Doppeltherapie (VEGFR-TKI+mTOR-Inhibitor oder IO-VEGFR-TKI) mehr als von einer Monotherapie (VEGFR-TKI oder mTOR-Inhibitor oder Immun-Monotherapie).
Effektivität von Post-Lenvatinib-Therapien
Panian et al14 haben sich mit der Frage beschäftigt, wie das Ansprechen bei Patienten ist, die zuvor eine Lenvatinib-basierte First- oder Second-Line-Therapie erhalten hatten. 54 Patienten wurden retrospektiv untersucht. Lenvatinib war davor entweder in Kombination mit Pembrolizumab in der FirstLine oder in Kombination mit Everolimus in der SecondLine gegeben worden. In der Second-Line-Kohorte war das Ansprechen (mit TKI allein, IO+TKI oder einer anderen Therapie) nach Lenvatinib+Pembroliumab mit 5% sehr gering, auch die Zeit bis zum Therapieversagen war mit median 5,8 Monaten wenig vielversprechend. In der Third-Line-Kohorte war das Ansprechen auf TKI-Monotherapie, TKI+IO oder andere Therapien nach vorangehender Lenvatinib+Everolimus-Therapie ebenfalls sehr bescheiden: ORR 9%, Zeit bis zum Therapieversagen median 2,8 Monate. Die Schlussfolgerung der Autoren war, dass die Aktivität von Therapie im Post-Lenvatinib-Setting bescheiden ist.
Literatur:
1 Albiges L et al.: ASCO 2024; Abstr. #4506 2 Pal SK et al.: Lancet 2022; 400(10358): 1103-16 3 Scelo et al.: Clin Cancer Res 2018; 24(22): 5594-601 4Wenxin Xu et al.: J Clin Oncol 2024; 42(22): 2691-7015 Xu W et al.: Clin Cancer Res 2021; 27(12): 3397-403 6 Vemula et al.: AACR 2024; Abstr. #5151 7 Zarba M et al.: ASCO 2024; Abstr. #4514 8Rini B et al.: N Engl J Med 2019; 380(12): 1116-27 9 Motzer RJ et al.: N Engl J Med 2021; 385(3): 287 10 Rini BI et al.: ASCO 2024; Abstr. #4505 11 Motzer RJ et al.: ASCO 2024; Abstr. #4504 12 Motzer RJ et al.: New Engl J Med 2019 13 Doshi S et al.: ASCO 2024; Abstr. #4512 14 Panian et al.: ASCO 2024; Abstr. #4538
Das könnte Sie auch interessieren:
Prostata-spezifisches Antigen vs. digitale rektale Untersuchung in der Krebsvorsorge
Umfragen zeigen, dass viele Männer sich aus verschiedensten Gründen keiner Prostatakarzinom(PCa)-Vorsorgeuntersuchung unterziehen möchten. Die digitale rektale Untersuchung (DRU) und das ...
Highlights zum Prostatakarzinom
Am diesjährigen Kongresses der American Society of Clinical Oncology (ASCO) standen bei der Behandlung des Prostatakarzinoms ein Update der EMBARK-sowie der NEPTUNES-Studie im Fokus.
Hodentumoren: Neues vom ASCO 2024
Obwohl dieses Jahr am ASCO wenige neue Daten und Erkenntnisse zum Thema Hodentumoren vorgestellt wurden, lässt sich ein Poster von Dr. Khalid Alkhatib hervorheben.