Diagnostik und Therapie
Autorin:
MR Dr. Monika Lechleitner
AVOMED (Arbeitskreis für Vorsorgemedizin und Gesundheitsförderung in Tirol), Innsbruck
E-Mail: m.lechleitner@avomed.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Diabetes mellitus Typ 1 (T1D) entsteht aufgrund einer zellulärmediierten Autoimmundestruktion der pankreatischen Betazelle. Die Insulintherapie stellt deshalb eine lebensnotwendige Hormonersatztherapie dar. Menschen mit T1D weisen auch ein erhöhtes Risiko für die Entwicklung weiterer Autoimmunerkrankungen auf – dies sollte im umfassenden Betreuungskonzept Berücksichtigung finden.
Keypoints
-
Die Insulintherapie stellt bei Typ-1-Diabetes eine lebensnotwendige Hormonersatztherapie dar.
-
Die Optimierung der Glukosekontrolle ist von zentraler Bedeutung für die Prävention diabetischer Spätkomplikationen.
-
Die funktionelle Insulintherapie ist der Goldstandard in der Form der Insulintherapie.
-
Bei Typ-1-Diabetes besteht ein erhöhtes Risiko für die Entwicklung weiterer Autoimmunerkrankungen.
Rund 5–10% aller Menschen mit Diabetes mellitus sind von einem Typ-1-Diabetes betroffen.1,2 Grundsätzlich kann ein T1D in jedem Lebensalter auftreten, Neumanifestationen finden sich jedoch besonders häufig im Kindes- und Jugendalter.3,4 Weltweit zeigt sich ein Anstieg der Inzidenz auch für T1D mit geschätzten 15 Neudiagnosen pro 100000 Menschen pro Jahr.1 Entsprechend der Studienevidenz resultiert die Optimierung der Glukosekontrolle bei Menschen mit T1D in einer signifikanten Reduktion der diabetischen Spätkomplikationen und der Mortalitätsrate.3–5 In Bezug auf die Insulintherapie und Glukoseselbstmessung haben technische Entwicklungen die Umsetzung wesentlich erleichtert und damit zur Verbesserung der Lebensqualität beigetragen.
Diagnose des Typ-1-Diabetes
Die Diagnose eines Diabetes erfolgt anhand der Bestimmung der Blutglukosewerte. Bei einem venösen Nüchternglukosewert über 126mg/dL, einem postprandialen oder sogenannten „Random“-Wert über 200mg/dL oder einem HbA1c-Wert über 6,5% besteht ein manifester Diabetes mellitus.1,5 Bei T1D kommt es infolge einer zellulärmediierten Autoimmunreaktion zu einer Destruktion der insulinproduzierenden pankreatischen Betazellen. Der T1D wird daher durch den Nachweis von einem oder mehreren Autoantikörpern (Inselzellantikörper, GAD65-Antikörper, Insulinantikörper, Antikörper gegen TyrosinphosphataseIA-2 und IA-2beta, Zinktransporter8, Tetraspanin-7) und eine fehlende oder inadäquat niedrige Insulinsekretion, bestimmt anhand der C-Peptid-Werte, definiert.1,6 Begleitende klinische Symptome, wie Polyurie, Polydipsie, Gewichtsreduktion, Schwäche und Infektneigung sind hinsichtlich des Schweregrades variabel. Gastrointestinale Symptome können vor allem bei Kindern als Folge einer ketoazidotischen Stoffwechselentgleisung auftreten, die leider nach wie vor häufig im Rahmen einer Erstmanifestation des T1D beobachtet wird.1 Verwandte von Menschen mit T1D weisen ein erhöhtes Risiko auf, selbst einen T1D zu entwickeln. Bei eineiigen Zwillingen ist das Risiko um 25–50% erhöht. Für die genetische Prädisposition spricht auch die starke Assoziation mit dem HLA-Genotyp, insbesondere HLA-DQA und HLA-DQB.7,8
Als Variante des T1D wurde in den letzten Jahren eine idiopathische Form ohne Hinweis auf eine Betazellautoimmunität, aber mit permanentem Insulinmangel und Ketoazidoseneigung, bei Menschen mit akfrikanischer oder asiatischer Ethnizität beobachtet. Darüber hinaus kann eine Therapie mit Checkpoint-Inhibitoren mit der raschen Entwicklung eines ausgeprägten Insulindefizites in Verbindung stehen.
Der sogenannte „latent autoimmune diabetes in adults“ (LADA) umfasst ein phänotypisches Mischbild eines Diabetes bei erwachsenen Menschen, das eine frühzeitige Insulindefizienz bei einem Autoantikörper-positiven T1D beinhalten kann, aber auch Formen mit ausreichender Betazellreserve und Symptomen eines metabolischen Syndroms.1
Therapie des Typ-1-Diabetes
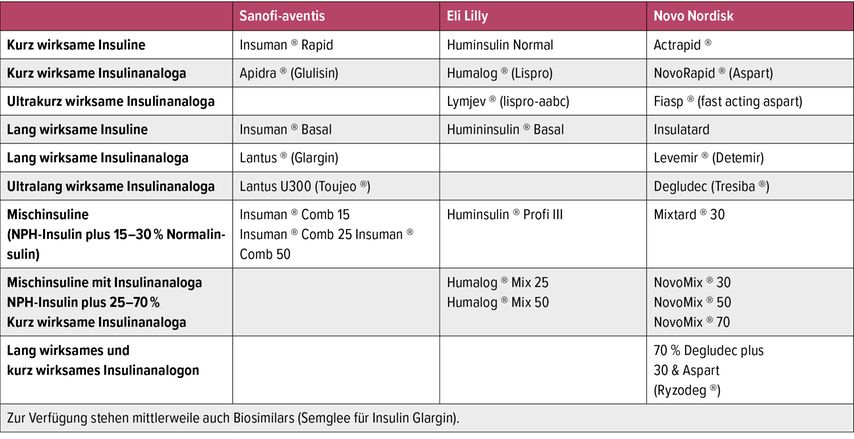
Die komplexe Betreuung von Menschen mit T1D sollte an einem diabetologischen Zentrum bzw. bei einer Ärztin/einem Arzt mit entsprechender Schwerpunktausbildung für Diabetologie/Endokrinologie erfolgen.9 Als Basis für eine erfolgreiche Umsetzung der Therapie gilt die Teilnahme an einer strukturierten Schulung, um die Voraussetzung für die Übernahme der Entscheidungskompetenz und Therapie durch die Patienten*innen selbst zu schaffen. Wichtige Inhalte sind die Insulinadministration, Glukosemessung, diabetische Akut- und Spätkomplikationen, Ernährung und Lebensstilintervention, aber auch besondere Lebenssituationen, wie z.B. sportliche Aktivität, Erkrankung und Schwangerschaft. Ein wichtiges Ziel gilt der Lebensqualität der Menschen mit Diabetes mellitus, die Belastung durch die Erkrankung („diabetes distress“) muss im Betreuungskonzept Beachtung finden. Für die Insulintherapie steht humanes Insulin in Form kurzwirksamer und langwirksamer Insuline bzw. Insulinanaloga und – für Menschen mit T1D in Ausnahmefällen – Mischinsulin zur Verfügung (Tab. 1). Die routinemäßige Verabreichung von Insulin erfolgt subkutan durch Injektionsspritze bzw. Pen oder mittels Insulinpumpe. Bei schweren Allgemeinerkrankungen, perioperativ oder bei Stoffwechselentgleisungen erfolgt kurzfristig eine intravenöse Gabe von Normalinsulin oder kurzwirksamem Insulinananloga. Kurzwirksame Insulinanaloga (Lispro, Aspart, Glulisin) weisen gegenüber Normalinsulinen einen rascheren Wirkeintritt und eine geringere Wirkdauer auf. Die Hypoglykämierate, vor allem für schwere nächtliche Hypoglykämien, ist unter kurzwirksamen Insulinanaloga deutlich geringer als unter Normalinsulin.10 Die sogenannten ultrakurzwirksamen Insulinanaloga („fast-acting insulin aspart“, „insulin lispro-aabc“) gelangen rund 10 Minuten rascher als Insulin Aspart bzw. Insulin Lispro in die Zirkulation und führen dadurch zu einer günstigen Beeinflussung der postprandialen Hyperglykämie.11,12 Die langwirksamen Insulinanaloga (Glargin, Detemir) zeigen im Vergleich zu NPH-Insulin eine längere Wirkdauer und eine flachere Wirkkurve, in klinischen Studien fand sich eine Reduktion vor allem des nächtlichen Hypoglykämierisikos.13 Als ultralangwirksame Insulinanaloga werden Insulin Glargin U300 und Insulin Degludec bezeichnet.14 Die flache Wirkkurve und besonders lange Wirkdauer ermöglichen eine Reduktion der Injektionshäufigkeit des basalen Insulins auf üblicherweise einmal täglich, in klinischen Studien wurde eine geringere Variabilität der Blutzuckerschwankungen und eine Reduktion des Hypoglykämierisikos gegenüber Glargin U100 beschrieben.
Formen der Insulintherapie
Die funktionelle Insulintherapie oder Basisbolus-Insulintherapie mit Verabreichung eines langwirksamen Basisinsulins/Insulinanalogons ein- bzw. zweimal täglichund eines kurzwirksamen Insulins/Insulinanalogons prandial bzw. als Korrekturinsulin gilt als empfohlene Standardtherapieform für Menschen mit T1D.1,9 Die Insulinpumpentherapie stellt eine Variante der funktionellen Insulintherapie dar. Die konventionelle Form der Insulintherapie sollte bei Menschen mit T1D nur noch in Ausnahmefällen zum Einsatz kommen.
Die funktionelle Insulintherapie nimmt mit der Verabreichung eines basalen und prandialen Insulins Bezug auf das physiologische Insulinsekretionsmuster. Der Insulintagesbedarf bei normalgewichtigen erwachsenen Patienten mit neudiagnostiziertem T1D beträgt insgesamt rund 0,4–1E/kg Körpergewicht, dabei entfallen rund 50–60% der Gesamttagesdosis auf den Anteil des prandialen Insulins und rund 40–50% auf den Anteil des basalen Insulins. Die Dosierung des prandialen Insulins berücksichtigt die Menge der zugeführten Kohlenhydrate, tageszeitliche Schwankungen (am Morgen höhere Dosis) sowie die Glukosezielwerte (Korrekturinsulin). Die Dosis des prandialen Insulins für die zugeführte Menge an Kohlenhydraten beträgt bei Erwachsenen im Durchschnitt 1,0–2,0IE/BE (1BE entspricht einer Kohlenhydratmenge von 12g). Die Korrekturen des prandialen Insulins im Tagesverlauf erfolgen beim Erwachsenen entsprechend der Grundregel, dass 1IE kurzwirksames Insulin die Blutglukose um 40–50mg/dL senkt. Eine individuelle Anpassung der Insulindosierung ist erforderlich, da das Ausmaß des Insulindefizits, die Insulinsensitivität, die Nahrungszufuhr, die körperliche Aktivität sowie die Pharmakokinetik und Pharmakodynamik der Insulinpräparate als Variable berücksichtigt werden müssen. Eine Adaptierung des aktuellen Insulinbedarfs ist vor allem bei Sportausübung, Erkrankungen und perioperativ wichtig. Insgesamt wird eine normnahe und damit den Werten von Menschen ohne Diabetes angenäherte Kontrolle der Blutglukosewerte angestrebt, soweit dies ohne Hyoglykämierisiko möglich ist. Die technischen Entwicklungen auf dem Gebiet der kontinuierlichen Glukosemessungen (Glukosesensoren) bieten dabei eine wesentliche Unterstützung.
Glukosezielwerte
Die Blutglukosezielwerte im Rahmen der Selbstkontrollen sollten 80–110mg/dL nüchtern bzw. vor den Mahlzeiten und vor dem Schlafengehen 110–130mg/dL betragen (Tab. 2).1,9 Ideale postprandiale Glukosespitzenwerte (Bestimmung 1–2 h nach Einnahme einer Mahlzeit) liegen unter 180mg/dL. Diese Glukosewerte entsprechen einem HbA1c-Wert von <7,0%.
Für die kontinuierlichen Glukosemessungen mittels subkutaner Glukosesensoren findet die Zeit im Zielbereich („time in range“), meist definiert durch Werte zwischen 70–180mg/dL, als Indikator für die Qualität der Glukosekontrolle Anwendung. Bei einem Anteil von rund 70% dieser Messungen im Zielkorridorbereich von 70–180mg/dL ist ein Erreichen des HbA1c-Zielwertes von unter 7% zu erwarten.
Weitere Autoimmunerkrankungen bei Typ-1-Diabetes
Menschen mit T1D weisen ein erhöhtes Risiko für die Entwicklung weiterer Autoimmunerkrankungen auf.15 Eine Autoimmunthyroiditis (Morbus Hashimoto oder Basedow) tritt bei 15–30% der Menschen mit T1D auf. Eine Autoimmungastritis und/oder perniziöse Anämie bei 5–10%, eine Zöliakie bei 4–9%, ein Morbus Addison bei rund 0,5% und eine Vitiligo bei 2–10%. Auch das Risiko für die Entwicklung einer Autoimmunhepatitis und einer Myasthenia gravis ist erhöht. Die Diagnostik beruht auf der klinischen Symptomatik und der serologischen Bestimmung organspezifischer Antikörper.
Literatur:
1 American Diabetes Association: Classification and diagnosis of diabetes: Standards of medical care in diabetes 2023. Diabetes Care 2023; 46 (1): 158-90 2 Mobasseri M et al.: Prevalence and incidence of type 1 diabetes in the world: A systematic review and meta-analysis. Health Promot Perspect 2020; 10(2): 98-115 3 Holt RIG et al.: The management of type 1 diabetes in adults. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2021; 44(11): 2589-625 4 Sinclair AJ et al.: Clinical guidelines for type 1 diabetes mellitus with an emphasis on older adults: An executive summary. Diabetic Medicine 2020; 37(1): 53-70 5 DiMeglio LA et al.: Type 1 diabetes. Lancet 2018; 391(10138): 2449-62 6 McLaughlin KA et al.: Autoimmunity to tetraspanin-7 in type 1 diabetes. Med Microbiol Immunol 2020; 209(4): 437-45 7 Pociot F, Lenmark A: Genetic risk factors for type 1 diabetes. Lancet 2016; 387(10035): 2331-9 8 Primavera M et al.: Prediction and prevention of type 1 diabetes. Front Endocrinol 2020; 11: 248 9 Lechleitner M et al.: Diagnostik und Therapie des Typ 1 Diabetes mellitus (Update 2023). Wien Klin Wochenschr 2023; 135 (1): 98-105 10 Pedersen-Bjergaard U et al.: Effect of insulin analogues on risk of severe hypoglycaemia in patients with type 1 diabetes prone to recurrent severe hypoglycaemia (HypoAna trial): A prospective, randomised, open-label, blinded-endpoint crossover trial. Lancet Diabetes Endocrinol 2014; 2(7): 553-61 11 Basu A et al.: Greater early postprandial suppression of early endogenous glucose production and higher initial glucose disappearance is achieved with fast-acting insulin aspart compared with insulin aspart. Diabetes Obes Metab 2018; 20(7): 1615-22 12 Malecki MT et al.: Ultra-rapid lispro improves postprandial glucose control and time in range in type 1 diabetes compered to lispro: PRONTO-T1DM continuous glucose monitoring substudy. Diabetes Technol Ther 2020; 22(11): 853-60 13 Poon K, King AB: Glargine and detemir: Safety and efficacy profiles of the long-acting basal insulin analogues. Drug Health Patient Saf 2010: 2: 213-23 14 Woo VC: A review of the clinical efficacy and safety of insulin degludec and glargine 300 U/mL in the treatment of diabetes mellitus. Clin Ther 2017; 39(8S2): 12-33 15 Triolo TM et al.: Additional autoimmune disease found in 33% of patients at type 1 diabetes onset. Diabetes Care 2011; 34(5): 1211-3
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...