HbA1c: Personalisierung des Langzeitzuckerwerts wird konkreter
Bericht:
Reno Barth
Der HbA1c-Wert, Maß für die langfristige Glukosebelastung, ist weitgehend akzeptiert und wurde bereits vor mehr als 30 Jahren mit dem Risiko von Diabeteskomplikationen in Verbindung gebracht.1 Allerdings unterliegt die Korrelation mit der durchschnittlichen Blutglukose des HbA1c ausgeprägten interindividuellen Schwankungen. Anhand eines persönlichen Glykierungsverhältnisses können diese Abweichungen korrigiert werden.
Keypoints
-
Gemessene HbA1c-Werte geben bei manchen Personen nur unzureichend die durchschnittliche Blutglukose wieder.
-
Auf Basis von Daten aus der kontinuierlichen Blutzuckermessung und des HbA1c-Werts kann ein persönliches Glykierungsverhältnis und daraus der persönliche HbA1c-Wert (pA1c) errechnet werden.
-
In der GDAC-Studie wurde das Konzept des persönlichen HbA1c-Werts unter Praxisbedingungen validiert.
-
Studien zur Aussagekraft des pA1c im Hinblick auf klinische Endpunkte stehen derzeit noch aus.
Trotz aller Vorteile, die der HbA1c-Wert im klinischen Alltag bietet, mehren sich die Hinweise, dass dieser Parameter lediglich ein unvollständiges Bild bietet, so Dr. Timothy Dunn, Direktor der Clinical and Computational Clinical Affairs von Abbott Diabetes Care. In älteren Studien wurde als Therapieziel zur Blutzuckerkontrolle ein HbA1c von 7% gefordert, was einer durchschnittlichen Blutglukose von 155mg/dl entspricht. Daten aus der ADAG-Studie zeigen jedoch Grenzen der Aussagekraft des HbA1c-Werts, sodass ein und derselbe HbA1c-Wert bei unterschiedlichen Personen mit sehr unterschiedlichen Glukosewerten assoziiert sein kann. Diese Abweichungen werden als positiver oder negativer „glycation gap“ bezeichnet und sind bei derselben Person weitgehend konsistent.2 Ein „glycation gap“ ist jedoch mit einer erhöhten Mortalität assoziiert, und zwar unabhängig davon, ob er ins Positive oder ins Negative ausschlägt.3
Die Hintergründe sind aktuell noch Gegenstand intensiver Forschung. „Die unterschiedliche Glykierung des Hämoglobins könnte sowohl mit Charakteristika der Erythrozyten als auch mit deren Lebensdauer zu tun haben“, so Dunn. Könnte man diese Faktoren messen oder berechnen, wäre es möglich, individuelle Korrekturfaktoren für die Bewertung des HbA1c-Wertes zu ermitteln. Ein Rechenmodell, mit dem dieses Ziel erreicht werden soll, wurde im vergangenen Jahr publiziert. Es bezieht ein persönliches Glykierungsverhältnis sowie die Affinität von Glukose zu den Membranrezeptoren der Erythrozyten mit ein. Auf dieser Basis kann ein personalisierter HbA1c-Wert (pA1c) errechnet werden. Diese Adjustierung verschiebt das HbA1c,insbesondere bei hohen Zuckerwerten.3
Ermittlung des persönlichen Glykierungsverhältnisses
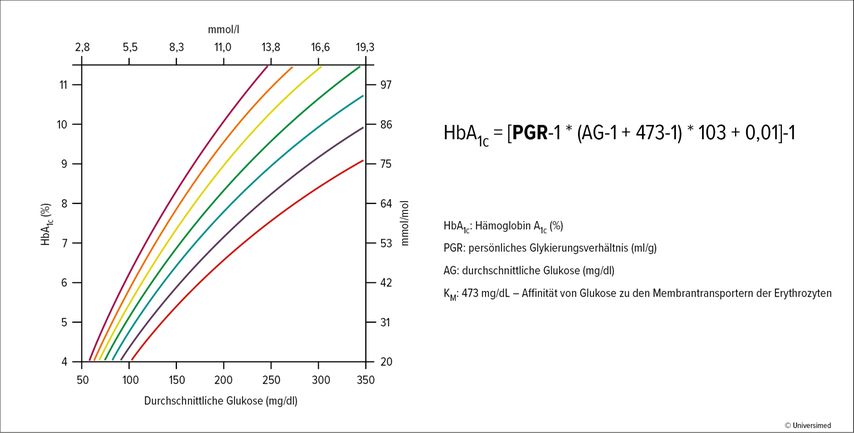
Um zu besserer Evidenz betreffend persönliches HbA1c zu gelangen, wurde die GDAC-Studie initiiert. Zielsetzung der Studie war es, das Ausmaß der Variation zwischen HbA1c und durchschnittlicher Glukose in einem prospektiven Studiendesign zu evaluieren. Damit sollte letztlich die Genauigkeit verbessert werden, mit der der HbA1c-Wert die durchschnittlichen Glukosewerte von Individuen und unterschiedlichen ethnischen Gruppen repräsentiert. In der GDAC-Studie wurde eine diverse Population über sechs Monate unter kontinuierlichem Glukosemonitoring („continuous glucose monitoring“; CGM) beobachtet. Durchgeführt wurde die Studie an 18 Zentren in Großbritannien, an denen Patient:innen, die seit über vier Jahren einen Diabetes mellitus Typ 1 (T1D) oder Typ 2 (T2D) hatten, behandelt wurden. Ausschlusskriterien waren ein HbA1c-Wert über 15,5% sowie Erkrankungen, die bekannterweise die Lebensdauer von Erythrozyten verändern. Die Studienteilnehmenden trugen jeweils zwei Sensoren: einen Sensor verblindet, den anderen nach Patientenwunsch verblindet oder nicht verblindet. Alle zwei Wochen wurden Blutproben genommen und der HbA1c-Wert wurde bestimmt. Die Studie war in zwei Phasen gegliedert. In Phase 1 wurde über 12 Wochen ein persönliches Glykierungsverhältnis (PGR) ermittelt, auf dessen Basis der individualisierte HbA1c-Wert(pA1c) errechnet wurde, in Phase 2 wurde dieser validiert. „Die Formel sieht kompliziert aus, aber ich versichere Ihnen, es macht Spaß, den pA1c zu berechnen“, so Dr. Ramzi Ajjan, Universität von Leeds, Großbritannien. Wichtig ist, mit Prozent und in mg/dl zu rechnen (Abb. 1).4
Abb. 1: Das persönliche Glykierungsverhältnis („personal glycation ratio“; PGR) definiert die Beziehung von durchschnittlichem Glukosewert und HbA1c-Wert beim individuellen Patienten (nach Dunn TC et al. 2023)4
Der Referenzwert für die„personal glycation ratio“ (PGR) ist 65,1ml/g. Wenn also bei einerPerson eine PGR von 65,1 ermittelt wird, dann entspricht der HbA1c-Wert exakt der laut Leitlinien zu erwartenden Durchschnittsglukose. Ist die PGR höher als 65,1ml/g, so fällt der gemessene HbA1c-Wert höher aus, als die gemessenen Glukosewerte tatsächlich sind. In diesem Fall muss der persönliche HbA1c-Wert nach unten korrigiert werden. Bei niedrigerer PGR gilt das Gegenteil. Die Messung des HbA1c unterschätzt die Glukoseexposition.
Die Auswertung zeigt für das gemessene HbA1c über den Studienverlauf eine einigermaßen sinnvolle Korrelation mit den gemessenen Zuckerwerten. Wird statt des gemessenen HbA1c das errechnete pA1c herangezogen, so wird diese Korrelation enger. Bei einem gemessenen HbA1c von 7% liegt die durchschnittliche Glukose zwischen 110 und 172mg/dl. Zieht man das errechnete pA1c heran, so bedeuten 7% eine Durchschnittsglukose im Bereich von 136 bis 175mg/dl. „Es reduziert die Bandbreite um 37% und erhöht damit deutlich die Aussagekraft“, so Ajjan. Dies ist auch im Hinblick auf unterschiedliche Messwerte bei unterschiedlichen ethnischen Gruppen relevant. So zeigen in der GDAC-Studienpopulation ethnische Gruppen mit schwarzer Hautfarbe einen im Verhältnis zum Blutzucker höheren HbA1c-Wert. Zieht man das pA1c heran, so verschwinden die Differenzen zwischen den Gruppen und es werden zuverlässigere Aussagen für Personen unterschiedlicher Abstammung möglich. Die Personalisierung löst auch das Problem von Schwankungen innerhalb der einzelnen ethnischen Gruppen. Ajjan betont, dass man es dabei mit Abweichungen zu tun hat, die im klinisch relevanten Bereich liegen. Durch die Verwendung von pA1c sinkt die Zahl der Personen, deren aus den Glukosemessungen berechneter HbA1c-Wert weit vom gemessenen HbA1c-Wert abweicht.5,6 „Da auf Basis des HbA1c-Werts therapeutische Entscheidungen getroffen werden, sind diese Daten klinisch relevant“, betont Ajjan. Der Routineeinsatz des pA1c hat daher das Potenzial, das klinische Management zu verbessern.
„In der spezialisierten Praxis in den Industriestaaten, wo heute üblicherweise CGM leicht verfügbar ist, hilft das Konzept des pA1c,Diskrepanzen zwischen gemessener Glukose und HbA1c zu verstehen“, so Prof. Dr. Pratik Choudhary, Universität von Leicester, Großbritannien. Noch relevanter sei die Personalisierung jedoch überall dort, wo nur der HbA1c-Wert verfügbar ist und klinische Entscheidungen – und damit in der Folge das Risiko von Langzeitkomplikationen und/oder Hypoglykämien – lediglich von dessen Interpretation abhängen. Die GDAC-Studie sagt zwar nichts darüber aus, ob HbA1c oder gemessene Glukose eine bessere Prädiktion von Komplikationen erlauben, es sei nun jedoch die Berechnung möglich, welcher HbA1c-Wert bei einer konkreten Person welche Zuckerwerte erwarten lässt. Dies erleichtert sichere Therapieentscheidungen, insbesondere in Regionen mit geringeren ökonomischen Mitteln. „Es genügt, über zwei Wochen die Blutglukose mittels CGM zu messen, um zu einem personalisierten HbA1c-Wert zu gelangen, anhand dessen sich in weiterer Folge klinische Entscheidungen treffen lassen“, so der Experte. „Das persönliche Glukoseverhältnis ist für eine individuelle Person über lange Zeit stabil. Hat man es einmal bestimmt, so lässt sich der HbA1c damit auch in Zukunft korrigieren.“
Korrekturen des HbA1c sind in konkreten Fällen praxisrelevant
Für die Publikation der GDAC-Studie wurden auch mehrere konkrete Fallbeispiele herangezogen. Zum Beispiel jenes eines 73-jährigen Patienten mit T2D und einem HbA1c von 7,9% unter Therapie mit Metformin, einem SGLT2-Inhibitor und einem GLP-1-Analogon. Man sei in diesem konkreten Fall vor der Frage gestanden, ob bei diesem Patienten ein Basalinsulin zur bestehenden Therapie hinzugefügt werden solle. Mittels CGM wurde eine „time in range“ (TIR) von 89% festgestellt. Die Berechnung auf Basis der CGM-Daten ergab eine PGR von 75ml/g (Referenz: 65) und zeigte an, dass der gemessene HbA1c-Wert nach unten korrigiert werden müsste. Die Berechnung des pA1C ergab einen Wert von 6,9%. Der Patient befindet sich folglich im Zielbereich und wurde nicht insulinisiert. „Wenn die CGM-Daten vorliegen, ist die Entscheidung einfach. Mit pA1c sind klinische Entscheidungen allerdings auch ohne aktuelle CGM-Messung leicht durchzuführen“, so Choudhary.
Die Korrektur kann jedoch auch in die andere Richtung verlaufen. Dies zeigte der Fall einer 61-jährigen Frau, einer Ethnie mit schwarzer Hautfarbe angehörig, die einen HbA1c-Wert von 6,1%aufwies, ebenfalls unter Therapie mit Metformin, einem SGLT2-Inhibitor und einem GLP-1-Analogon. „In einem solchen Fall sollte darüber nachgedacht werde, die Therapie etwas zu reduzieren“, so Choudhary. Die Berechnung der PGR ergab jedoch einen Wert von 54ml/g und zeigte damit, dass der gemessene HbA1c-Wert die Glukoseexposition unterschätzte. In der Folge wurde ein pA1c von 7,3% errechnet, was die Vermutung bestätigte.
Damit in Zukunft das pA1c das ausschlaggebende Maß für Therapieentscheidungen werden kann, ist allerdings noch eine prospektive Evaluation in klinischen Studien erforderlich.
Quelle:
„The glucose-derived personalized HbA1c correction (GDAC) study: background, rationale and design“, Vortrag von Dr. Tim Dunn; „GDAC study findings: refining inter-individual variability in the relationship between glucose and glycated hemoglobin“, Vortrag von Prof. Dr. Ramzi Ajjan; „Clinical implications of the GDAC study and future research“, Vortrag von Prof. Dr. Pratik Choudhary, präsentiert am EASD-Kongress am 13. September 2024,Madrid
Literatur:
1 Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329(14): 977-86 2 Nathan DM et al.: Translating the A1C assay into estimated average glucose values. Diabetes Care 2008; 31(8): 1473-8 3 Nayak AU et al.: Association of glycation gap with mortality and vascular complications in diabetes. Diabetes Care 2013; 36(10): 3247-53 4 Dunn TC et al.: Personalized glycated hemoglobin in diabetes management: closing the gap with glucose management indicator. Diabetes Technol Ther 2023; 25(S3): 65-74 5 Choudhary P et al.: Personalised adjustment to improve accuracy of HbA1c at reflecting hyperglycaemic exposure in different racial groups: a prospective clinical study. präsentiert am EASD-Kongress 2024; Abstract 805 6 Xu Y et al.: Average glucose and HbA1c display a nonlinear and variable relationship: implications for clinical practice. präsentiert am EASD-Kongress 2024; Abstract 804
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...