Zukünftige Therapieformen bei Adipositas und Typ-2-Diabetes
Autorin:
Priv.-Doz. Dr. Gerlies Treiber
Klinische Abteilung für Endokrinologie und Diabetologie
Universitätsklinik für Innere Medizin, Graz
E-Mail: gerlies.treiber@medunigraz.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Adipositas erhöht das Risiko für verschiedene metabolische Komplikationen. In jüngerer Zeit wurden einige Wirkstoffe und Wirkstoffkombinationen entwickelt und getestet, die zu einem nachhaltigen und gesunden Gewichtsverlust führen können.
Keypoints
-
Adipositas ist eine chronische Erkrankung und eine frühzeitige Diagnose sowie lebenslange multimodale Therapie sind erforderlich.
-
Eine Gewichtsreduktion führt zu einer Verbesserung der Begleit- bzw. Folgeerkrankungen.
-
Duale sowie Tripelagonisten führen zu deutlichem Gewichtsverlust bei Adipositas, dies zeigt sich auch im geringeren Ausmaß bei Personen mit T2D.
-
Die Reduktion der Muskelmasse bei ausgeprägtem Gewichtsverlust ist jedoch bedenklich und bedarf gezielter ernährungsmedizinischer sowie bewegungstherapeutischer Begleitung.
Adipositas ist eine chronische Erkrankung, die nicht nur durch ein Übermaß an Körperfett, sondern auch durch eine Dysfunktion des Fettgewebes gekennzeichnet sein kann, die die Gesundheit beeinträchtigt. Die World Obesity Federation schätzt, dass davon weltweit mittlerweile 988 Millionen Menschen betroffen sind.
Adipositas erhöht das Risiko für verschiedene metabolische Komplikationen, wie Typ-2-Diabetes (T2D), metabolische Lebererkrankung (MASLD), Herz-Kreislauf-Erkrankungen sowie mechanische Komplikationen wie Osteoarthrose der Knie und obstruktive Schlafapnoe. Eine frühzeitige Diagnose und eine Beurteilung des Schweregrads der Adipositas mithilfe des Edmonton Obesity Staging System identifizieren jene Personen, die von therapeutischen Interventionen besonders profitieren.
Lebensstilinterventionen, die Ernährungsumstellung, körperliche Aktivität sowie Verhaltensänderungen umfassen, stellen die Grundlage des Adipositas-Managements dar und bieten viele gesundheitliche Vorteile. Doch selbst die intensivsten Lebensstilinterventionen führen nur zu einem durchschnittlichen Gewichtsverlust (GV) von bis zu 10% und die Gewichtserhaltung bleibt eine Herausforderung, da 80% des verlorenen Gewichts in den nächsten fünf Jahren voraussichtlich wieder zugenommen werden.
Zu den Hauptmechanismen der Gewichtszunahme nach signifikantem Gewichtsverlust gehören der persistierend reduzierte Ruheumsatz sowie ein gesteigerter Appetit, der möglicherweise durch langfristig verstärkte orexigene und abgeschwächte anorexigene Signalwege vermittelt wird. Enteropankreatische Hormone spielen eine wesentliche Rolle bei der Regulation von Nahrungsaufnahme, Appetit und Blutglukose, was zur Entwicklung von Glucagon-like-Peptide-1(GLP-1)-Rezeptor-Agonisten (RA) als sichere und effektive Behandlung für Typ-2-Diabetes und Adipositas geführt hat. GLP-1-RA erhöhen das Sättigungsgefühl, reduzieren die Nahrungsaufnahme und verzögern die Magenentleerung, während sie gleichzeitig die Insulinfreisetzung stimulieren und die Glukagonsekretion auf glukoseabhängige Weise hemmen.
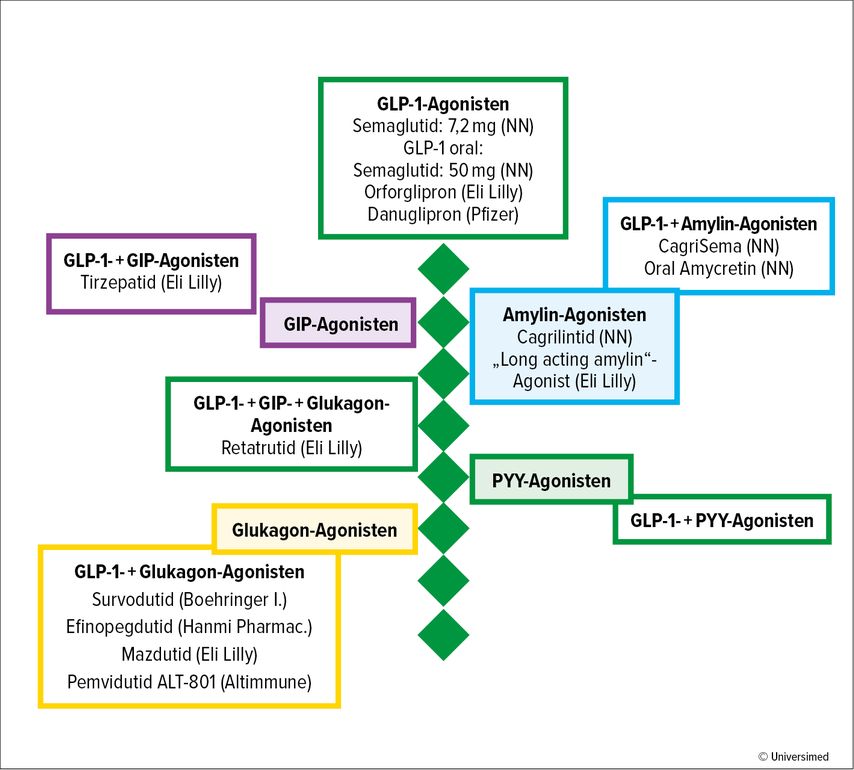
Neben GLP-1 gibt es jedoch weitere Darmhormone mit metabolischen Wirkungen, die derzeit entweder einzeln oder in Kombination mit GLP-1-Rezeptor-Agonisten untersucht werden, um die Wirkung des GLP-1-Agonismus auf Gewicht und Stoffwechsel zu verstärken und/oder zu ergänzen (Abb. 1).
Abb. 1: Entwicklungen von Darmhormon-basierten neuen Anti-Obesity-Medikamenten (angeführt ist eine Auswahl von Substanzen, die sich bereits in klinischen Studien der Phase II oder III befinden); NN, Novo Nordisk
GIP („glucose-dependent insulinotropic polypeptide“) wird von K-Zellen im Jejunum als Reaktion auf die Nahrungsaufnahme ausgeschüttet. Seine physiologische Rolle umfasst die Stimulation der Insulinsekretion, eine erhöhte Freisetzung von Glukagon, gesteigerte Lipogenese und die Verbesserung der Lipidpufferkapazität. Tirzepatid ist die erste Kombination eines dualen GLP-1- und GIP-Agonisten, die mittlerweile auch in Österreich verfügbar ist.
Glukagon wird von den α-Zellen des Pankreas ausgeschüttet, wobei der Hauptwirkungsort die Leber ist, wo es die hepatische Glukoseproduktion steigert. Glukagon-Agonismus reduziert die Nahrungsaufnahme und erhöht den Energieverbrauch, was den Gewichtsverlust fördern kann. In-vivo-Studien mit lang wirkenden Glukagon-Analoga deuten darauf hin, dass eine Hypoaminoazidämie ein wichtiger Mechanismus für die beobachtete Steigerung des Energieverbrauchs durch Glukagon-Agonisten sein könnte, jedoch führt sie auch zu einem verstärkten Verlust an fettfreier Körpermasse.
Darüber hinaus könnte die Kombination von Glukagon mit GLP-1-Wirkungen den Gewichtsverlust verstärken und gleichzeitig vor dem Risiko für eine Hyperglykämie schützen. Weitere Wirkungen von Glukagon umfassen die Verbesserung des gesamten Körperlipidstoffwechsels und die Förderung der hepatischen Fettsäureoxidation, was therapeutische Effekte bei MASLD bieten könnte.
Amylin wird zusammen mit Insulin von den β-Zellen des Pankreas ausgeschüttet und spielt eine zentrale Rolle in der Regulation des Sättigungsgefühls nach den Mahlzeiten. Amylin wirkt auf Amylin-Rezeptoren im Hirnstamm, um die Nahrungsaufnahme zu reduzieren, und verbessert den Glukosestoffwechsel, indem es die Magenentleerung verzögert und die Glukagonsekretion hemmt. Pramlintid ist das erste synthetische Amylin-Analogon, das für die Diabetesbehandlung außerhalb Europas zugelassen ist, mit einem GV bis zu 7,9%.
Cagrilintid ist ein neueres, einmal wöchentlich zu verabreichendes, lang wirksames Amylin-Analogon, das in klinischen Phase-II-Studien einen dosisabhängigen GV von 6% bis 10,8% erreichte im Vergleich zu 9% mit Liraglutid. Da der GV mit GLP-1-Rezeptor-Agonisten und Amylin-Analoga sowohl über unterschiedliche als auch überlappende Signalwege erfolgt, hat die Kombination einen synergistischen Effekt.
In einer Phase-Ib-Studie führten 20 Wochen Behandlung mit Cagrilintid in einer Dosis von 2,4mg einmal wöchentlich in Kombination mit Semaglutid 2,4mg einmal wöchentlich (CagriSema) zu einem GV von bis zu 17,1% im Vergleich zu 9,5% mit Semaglutid 2,4mg plus Placebo bei adipösen Personen.
In einer Phase-II-Studie erreichten Menschen mit Typ-2-Diabetes und Adipositas nach 32 Wochen Behandlung einen größeren durchschnittlichen GV mit CagriSema 2,4mg im Vergleich zu Cagrilintid 2,4mg oder Semaglutid 2,4mg allein (15,6% GV vs. 8,1% GV vs. 5,1% GV). Auch die mittlere HbA1c-Reduktion war mit CagriSema stärker ausgeprägt als mit Semaglutid 2,4mg oder Cagrilintid 2,4mg allein (−2,2% vs. −1,8% vs. −0,9%).
Gastrointestinale unerwünschte Ereignisse (UE) traten bei CagriSema häufiger auf als bei Semaglutid- oder Cagrilintid-Monotherapie. Allerdings waren die schwerwiegenden UE (SAE) und UE, die zum Abbruch der Medikation führten, minimal und ähnlich zwischen den Gruppen.
Das Peptid YY (PYY) wird nach der Nahrungsaufnahme zusammen mit GLP-1 von den intestinalen L-Zellen co-sezerniert. Nach der Sekretion wird PYY durch Dipeptidylpeptidase 4 (DPP-4) schnell in seine aktive Form (PYY 3-36) umgewandelt, die auf den Neuropeptid-Y-Rezeptor Typ 2 (Y2R) wirkt. Der Y2-Rezeptor ist im Gehirn vorhanden, seine Aktivierung führt zu einer Reduktion der Nahrungsaufnahme und zu einem erhöhten Sättigungsgefühl.
Dualagonist mit GLP-1 und Glukagon: Beispiel Survodutid
Survodutid ist ein GLP-1/Glukagon-Co-Agonist, der sich im Rahmen des SYNCHRONIZE-Programms in Phase-III-Studien zur Behandlung von Adipositas befindet. Laut Daten aus einer Phase-II-Studie führte eine 46-wöchige Behandlung mit einmal wöchentlich verabreichtem Survodutid (0,6–4,8mg) bei Menschen mit Adipositas zu einem dosisabhängigen mittleren Gewichtsverlust von bis zu 18,7% im Vergleich zu 2% mit Placebo.
Der Anteil der Teilnehmenden, die die Behandlung aufgrund von UE abbrachen, lag zwischen 20% und 29%. Die meisten Behandlungsabbrüche waren auf gastrointestinale UE zurückzuführen und traten während der schnellen Dosiseskalation auf – dies könnte in Phase-III-Studien durch eine schrittweise Dosiseskalation gemildert werden.
Bei Menschen mit Typ-2-Diabetes führte Survodutid in einer Dosierung von 1,8mg zweimal wöchentlich nach 16 Wochen zu einem Gewichtsverlust von 9% im Vergleich zu 5,4% mit Semaglutid 1mg und 1,2% mit Placebo (Phase-II-Studie). Die mittlere HbA1c-Reduktion war bei höheren Survodutid-Dosierungen im Vergleich zu Semaglutid 1mg überlegen (1,9% vs. 1,5%).
Obwohl die Häufigkeit von SAE ähnlich wie bei Semaglutid 1mg war, lagen die UE-bedingten Abbruchraten mit Survodutid zwischen 10% und 30% im Vergleich zu 4% bei Semaglutid 1mg.
Tripelagonist mit GLP-1/GIP/Glukagon: Retatrutid
In präklinischen Modellen führte Retatrutid, ein Dreifachagonist (GLP-1/GIP/Glukagon), zu einem stärkeren Gewichtsverlust und verbesserten Glukoseprofilen im Vergleich zu Tirzepatid, was auf einen erhöhten Energieverbrauch und eine reduzierte Kalorienaufnahme zurückzuführen ist. Retatrutid wird einmal wöchentlich verabreicht und weist eine stärkere Bindungsaffinität zu menschlichen GIP-Rezeptoren und eine geringere Affinität zu GLP-1- und Glukagon-Rezeptoren auf.
Praxistipp
Bei Anregungen zur Gewichtsreduktion gegenüber Patient:innen muss mitgedacht werden, dass Lebensstilinterventionen oft zu einer erneuten Gewichtszunahme in der Erhaltungsphase führen. Als medikamentöse Unterstützung haben sich bisher GLP-1-Agonisten bewährt. Andere Hormone mit metabolischen Wirkungen werden untersucht, auch in Kombination mit GLP-1-Agonisten. In Österreich zugelassen ist bisher Tirzepatid, die erste Kombination eines dualen GLP-1- und GIP-Agonisten.In einer Phase-II-Studie mit Teilnehmenden mit Adipositas (ohne T2D) führte Retatrutid (Dosen von 1–12mg) nach 48 Wochen zu einem dosisabhängigen Gewichtsverlust von bis zu 24,2% im Vergleich zu 2,1% bei Placebo. Nach 48 Wochen hatten 36–48% der Teilnehmenden mit den Dosierungen 8mg und 12mg einen Gewichtsverlust von ≥25% erreicht verglichen mit keinem in der Placebogruppe. Ein höherer prozentualer Gewichtsverlust wurde bei Teilnehmenden mit einem BMI ≥35kg/m2 und bei biologischen Frauen beobachtet. Deutliche Verbesserungen von Lipidprofil und Blutdruck wurden ebenfalls im Vergleich zu Placebo verzeichnet.
Bei Menschen mit T2D führte Retatrutid (0,5 bis 12mg) in einer Phase-II-Studie im Vergleich zu Placebo und Dulaglutid 1,5mg zu signifikanten Reduktionen des Körpergewichts und des HbA1c-Werts. Nach 36 Wochen zeigten sich mit Retatrutid eine HbA1c-Reduktion von bis zu –2,2% gegenüber −1,4% mit Dulaglutid und −0,3% mit Placebo sowie eine Körpergewichtsreduktion von bis zu 16,9% im Vergleich zu 2% mit Dulaglutid und 3% mit Placebo. Die Vorteile der Dreifachagonistenwirkung erstreckten sich auch auf MASLD – in einer Untergruppe von 98 Personen normalisierte sich der Fettgehalt bei etwa 90% der Personen, die die höchsten Retatrutid-Dosen erhielten.
Das Sicherheitsprofil von Retatrutid war konsistent mit dem anderer inkretinbasierter Therapien. Vorübergehende und meist leichte bis moderate gastrointestinale Symptome waren die am häufigsten berichteten unerwünschten Ereignisse und traten häufiger in den Gruppen mit einer Anfangsdosis von 4mg auf als in den Gruppen mit 2mg. In der 12mg-Dosisgruppe brachen 16% der Teilnehmenden die Behandlung aufgrund von unerwünschten Ereignissen ab, aber die Gesamtinzidenz der SAE war gering (bis zu 6–8%).
Ein Phase-III-Studienprogramm mit Retatrutid (TRIUMPH) läuft derzeit, um die Sicherheit und Wirksamkeit von Retatrutid in verschiedenen Populationen mit Adipositas zu bewerten, einschließlich Menschen mit OSA, T2D, etablierter kardiovaskulärer Erkrankung und Osteoarthritis.
Literatur:
● Blüher M et al.: Correction to: Dose–response effects on HbA1c and bodyweight reduction of survodutide, a dual glucagon/GLP-1 receptor agonist, compared with placebo and open-label semaglutide in people with type 2 diabetes: a randomised clinical trial. Diabetologia 2024; 67(4): 758 ● Brix JM et al.: Übergewicht und Adipositas bei Erwachsenen: allgemeine Behandlungsgrundsätze und konservatives Management. Wien Klin Wochenschr 2023; 135(Suppl 6): 706-20 ● Enebo LB et al.: Safety, tolerability, pharmacokinetics, and pharmacodynamics of concomitant administration of multiple doses of cagrilintide with semaglutide 2·4mg for weight management: a randomised, controlled, phase 1b trial. Lancet 2021; 397(102786): 1736-48 ● Frias JP et al.: Efficacy and safety of co-administered once-weekly cagrilintide 2·4mg with once-weekly semaglutide 2·4mg in type 2 diabetes: a multicentre, randomised, double-blind, active-controlled, phase 2 trial. Lancet 2023; 402: 720-30 ● Hall KD et al.: Maintenance of lost weight and long-term management of obesity. Med Clin North Am 2018; 102(1): 183-97 ● Jastreboff AM et al.; Retatrutide Phase 2 Obesity Trial Investigators: Triple-hormone-receptor agonist retatrutide for obesity – a phase 2 trial. N Engl J Med 2023; 389(6): 514-26 ● Lau DCW et al.: Once-weekly cagrilintide for weight management in people with overweight and obesity: a multicentre, randomised, double-blind, placebo-controlled and active-controlled, dose-finding phase 2 trial. Lancet 2021; 398(10317): 2160-72 ● Lean ME et al.: Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. Lancet 2018; 391(10120): 541-51 ● Le Roux CW et al.: Glucagon and GLP-1 receptor dual agonist survodutide for obesity: a randomised, double-blind, placebo-controlled, dose-finding phase 2 trial. Lancet Diabetes Endocrinol 2024; 12(3): 162-73 ● Melson E et al.: What is the pipeline for future medications for obesity? Int J Obes (Lond) 2024; doi: 10.1038/s41366-024-01473-y ● Rosenstock J et al.: Retatrutide, a GIP, GLP-1 and glucagon receptor agonist, for people with type 2 diabetes: a randomised, double-blind, placebo and active-controlled, parallel-group, phase 2 trial conducted in the USA. Lancet 2023; 402(10401): 529-44
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...