Physiologische Hormonersatztherapie in der Menopause
Autor:
Univ.-Prof. DDr. med. Johannes Huber
ehem. Leiter der klinischen Abteilung für Gynäkologische Endokrinologie und Reproduktionsmedizin, Universitätsklinik für Frauenheilkunde
Medizinische Universität Wien
E-Mail: johannes.huber@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Rahmen der physiologischen Hormonersatztherapie ist es wichtig, sich an die Natürlichkeit der Konditionen zu halten, die der weibliche Körper uns von der Natur aus vom Menstruationszyklus vorgibt. Das bedeutet, mit dem Einsatz von bioidenten Hormonen eine physiologisch hohe Dosis zu erzielen. Während Östradiol kontinuierlich verabreicht werden kann, ist bei Progesteron aus mehreren Gründen die zyklischeder kontinuierlichen Gabe vorzuziehen.
Bereits im Jahr 2000 wurde an der Medizinischen Universität Wien eine Analyse durchgeführt, deren Ergebnisse darauf schliessen lassen, dass im menschlichen Genom ≥20 Stellen vorliegen, an denen der Östrogenrezeptor α andocken kann.1 Inzwischen ist bekannt, dass es ≥6500 Gene gibt, die bei Männern und Frauen unterschiedlich reguliert werden und somit die Genderspezifität ausmachen.2 Demnach ist es naheliegend, dass es wohl schwierig ist, angesichts einer so grossen Anzahl an Genen eine adäquate Hormonersatztherapie (HRT; «hormone replacement therapy») durchzuführen.
Allerdings verfügen wir mit der Labormedizin über ein Instrument der modernen Medizin, das eine Bestimmung des Hormonstatus ermöglicht. Wesentlich ist v.a., dass wir uns an das halten sollten, was uns die Evolution seit >240 Millionen Jahren lehrt: die Natürlichkeit der Konditionen, unter denen die HRT stattfindet.
Was ist bei einer HRT zu berücksichtigen?
Im Rahmen des weiblichen Menstruationszyklus unterliegt Östradiol einer Schwankungsbreite zwischen 20 und 100pg, die nur einmal in der Mitte des Zyklus unterbrochen wird, wenn Östradiol auf 150pg ansteigt. Dies entspricht dem Bereich, den man mit einer HRT erzielen kann. Progesteron hingegen wird im Nanogramm-Bereich gemessen und der Normbereich in der zweiten Zyklushälfte liegt zwischen 3,5 und 10ng – der Bereich, den man mit der HRT erzielen soll. Neben der Dosis spielt bei der HRT die Bioidentität eine wesentliche Rolle, denn natürlich werden bei Östradiol und Progesteron jene Substanzen eingesetzt, die der Körper selbst herstellt. Östradiol wird von den Ovarien gebildet und ist somit bioident, das Gleiche trifft auf Progesteron zu. Hormone aus Pflanzen sind nicht «bioidenter», weil sie aus der Pflanze kommen, denn der Körper bildet Östrogen und Progesteron ausschliesslich aus Cholesterin. In der klinischen Praxis wird aus verschiedenen Gründen das transdermale Östradiol verwendet.
Neben der Gabe bioidenter Hormone in der richtigen Konzentration und einem adäquaten Serumspiegel ist es wichtig, dass auch die Rhythmik bioident ist.
D. h., während die Rhythmik der Anwendung von Progesteron zyklisch ist, kann Östradiol kontinuierlich verabreicht werden. Wie wichtig es ist, dass man sich an die Natürlichkeit und die Zyklizität hält, geht auch aus einer von Zhao et al. durchgeführten Untersuchung hervor, wonach die kontinuierliche vs. die zyklische Gabe möglicherweise mit nachteiligen Effekten auf die neurologische Gesundheit in der Menopause einhergeht.3 Concin und Polterauer weisen zudem darauf hin, dass eine langfristige Östrogen-Monotherapie mit einem signifikant erhöhten Risiko für ein Endometriumkarzinom einhergeht.4
Dazu muss noch der Aspekt berücksichtigt werden, dass Progesteron über 21 Kohlenstoffatome verfügt,im Gegensatz zu Östradiol mit 18,und somit schwerer durch die Haut diffundieren kann. Da daher unklar ist, welche Menge tatsächlich im Körper aufgenommen wird, sollen bei transdermaler Gabe regelmässig Messungen des Serumspiegels vorgenommen werden.
Um einen für das Endometrium sicherenProgesteronspiegel zu erreichen, empfiehlt sich, das Progesteron in Weichkapseln (100–400mg) entweder oral oder intravaginal 10 bis 14 Tage pro Zyklus zuzuführen.
Was darüber hinaus noch für eine HRT spricht, ist, dass der Alterungsprozess per se – das biologische Alter kann über das Epigenom gemessen werden – dadurch gebremst werden kann: Dies konnte u.a. in einer retrospektiven Observationsstudie mit 117763 postmenopausalen Frauen nachgewiesen werden – jene mit einer HRT in der Anamnese waren biologisch jünger als die Vergleichsgruppe ohne HRT.5
Zusätzliche Indikationen für Östrogengabe
Es gibt auch Indikationen, bei denen man nicht auf bioidente Hormone zurückgreifen soll, und zwar bei Patientinnen, die in der Menopause plötzlicheine Hypercholesterinämie entwickeln. In diesem Fall ist es ratsam, den LPA(Lipoprotein A)-Spiegel zu bestimmen und im Fall einer Erhöhung eine Internistin oder einen Internisten hinzuzuziehen. LPA kann in der Menopause einen massiven Anstieg von Cholesterin bewirken und stellt einen Hochrisikofaktor für Atherosklerose dar. Für Tibolon liegen Daten vor, wonach es das Potenzial aufweist, den LPA-Spiegel zu senken.6 Handelt es sich um eine nicht LPA-assoziierte Hypercholesterinämie, kann der Cholesterinwert durch Östrogengabe normalisiert werden, wobei es sinnvoll ist, in diesem Fall nicht auf konjugierte Östrogene zurückzugreifen.
Eine weitere Indikation für die Gabe von Östradiol ist die Arthralgia climacterica.7 Hier bietet sich mit der direkten lokalen Applikation auf die schmerzhaften Gelenke und einem Hub auf die innere Ellenbeuge eine weitere Möglichkeit der Hormonzufuhr an.
Auch für die menopausale Keratoconjunctivitis sicca konnte gezeigt werden, dass die topische Applikation von Östradiol innerhalb von einer Woche zu einem Abklingen der Beschwerden führen kann: Durch Erweiterung des Schlemm’schen Kanals wird mit Östradiol eine Senkung des intraokularen Drucks erzielt.8, 9
«Hot flashes»
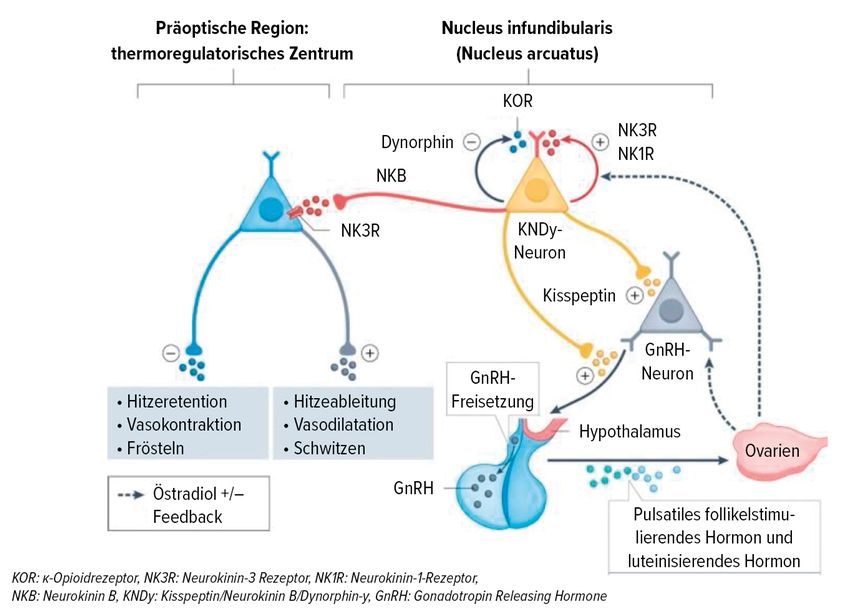
Häufig entwickeln Mammakarzinompatientinnen aufgrund der Krebstherapie extreme «hot flashes». In diesem Zusammenhang wird zurzeitder Kisspeptin-Neurokinin-B-Dynorphin(KND)-Pathway mit Recht stark thematisiert: Neurokinin-3(NK3)-Rezeptor-Antagonisten setzen direkt am Thermoregulationszentrum im Hypothalamus an und inhibieren die KND-Neurone (Abb. 1). Sie wirken demnach ausschliesslich auf die «hot flashes», in dieser Hinsicht sind sie aber nachweislich effektiv.10Allerdings muss angemerkt werden, dass die EMA (European Medicines Agency) eine Warnung veröffentlicht hat, wonach unter NK3-Antagonisten schwerwiegende Leberschäden aufgetreten sind. Vor Therapieinitiierung sollen daher Leberfunktionstests durchgeführt und die Behandlung nur unter entsprechenden Bedingungen eingeleitet werden.11
Abb. 1: Wirkmechanismus der Neurokinin-3-Rezeptor-Antagonisten am Thermoregulationszentrum im Hypothalamus (modifiziert nach Lederman S et al.)10 Das thermoregulatorische Zentrum im Hypothalamus wird durch Kisspeptin/NeurokininB/Dynorphin-y(KNDy)-Neurone innerviert. Diese Neurone werden durch das Neuropeptid Neurokinin B stimuliert, das an den Neurokinin-3-Rezeptoren wirkt, und durch Östrogen inhibiert. Abfallende Östrogenkonzentrationen während des Übergangs in die Menopause verändern die Neurokinin-3-Rezeptor-mediierte Aktivierung, was zu einer Hypertrophie von KNDy-Neuronen und zur Dysregulation des thermoregulatorischen Zentrums führt. Das thermoregulatorische Zentrum triggert Hitzefreisetzungseffektoren
Cave: Xenoöstrogene
Wenn bei einer Analyse des Hormonstatus bei einer menopausalen Frau – unabhängig davon, ob sie eine HRT erhält oder nicht – unphysiologisch hohe Östradiolspiegel im Bereich von 600–800pg festgestellt werden, muss an die externe Zufuhr von sogenannten Xenoöstrogenen gedacht werden, die v.a. in bestimmten Kosmetika und Nahrungsergänzungsmitteln enthalten sind. Sie sind Quellen für sogenannte endokrine Disruptoren, d.h., sie können mit dem endokrinen System interagieren und nachteilige Effekte mit sich bringen. Die EFSA (European Food and Safety Authority) hat eine Untersuchung von 431 Körperpflegeprodukten anhand der Herstellerangaben auf der Verpackung durchgeführt und überprüft, ob sie Stoffe enthalten, die auf der EU-Prioritätenliste für hormonell aktive Chemikalien in den Kategorien 1 oder 2 gelistet sind. Dabei wurden in 11% der untersuchten Zahnpasten und in 21% der untersuchten Bodylotions hormonell wirksame Kosemetikinhaltsstoffe identifiziert.12 Dieser Aspekt ist natürlich auch für die HRT von Bedeutung, da die endokrinen Disruptoren additive Effekte aufweisen, die sich unter Umständen kontraproduktiv auswirken können. Seit 2016 gibt es die kostenlos downloadbare ToxFox-App, die es ermöglicht, über Scannen des Barcodes zu erkennen, ob in einem definierten Kosmetik-/Pflegeprodukt hormonaktive Substanzen enthalten sind. Nicht zuletzt die Anwendung dieser App kann auch dazu beitragen, eine HRT sicherer zu machen.
«Urgent need» nach mehr Awareness
Gemäss einer in Deutschland durchgeführten Umfrage fühlt sich jede dritte menopausale Frau mittelmässig bis schlecht behandelt.13 Das unterstreicht den «urgent need»:Es ist noch mehr Awareness für diese Altersgruppe erforderlich und dringender Handlungsbedarf gegeben. Idealerweise sollte eine eigene Abteilung für Menopause etabliert werden.
Literatur:
1 Gruber CJ et al.: N Engl J Med 2002; 346: 340-52 2 Gershoni M, Petrokovski A.: BMC Biol 2017: https://doi.org/10.1186/s12915-017-0352-z 3 Zhao L et al.: Plos One 2012: doi: 10.1371/journal.pone.0031267 4 Concin N, Polterauer S.: Österr. Ärztezeitschrift. Onkologie Spezial, Ausgabe 25. November 2024. 36-42 5 Liu Y, Li C: JAMA Netw Open 2024: doi:10.1001/jamanetworkopen. 2024. 30839 6 Kotani K et al.: Atherosclerosis 2015; 242: 87-96 7 Metka Met al.: Geburtsh. und Frauenheilk. 1988; 48: 232-34 8 Sator MO et al.: Br J Obstet Fynecol 1998; 105: 100-02 9 Sator MO et al.: Lancet 1996; 348: 761-62 10 Lederman S et al.: Lancet 2023; 401: 1091-10211 https://www.ema.europa.eu/en/documents/dhpc/direct-healthcare-professional-communication-dhpc-veoza-fezolinetant-risk-drug-induced-liver-injury-new-recommendations-monitoring-liver-function-during-treatment_en.pdf 12 https://www.efsa.europa.eu/en/topics/topic/endocrine-active-substances 13 Stute P et al.: Arch Gynecol Obstet 2022; 306: 513-21
Das könnte Sie auch interessieren:
Der frühe Ultraschall hat auch in Zeiten des NIPT nicht ausgedient
Beim Ersttrimesterscreening geht es bei Weitem nicht nur um Nackenfaltenmessung und die Wahrscheinlichkeitsberechnung für Trisomien. Auch rund 50% der schweren fetalen Fehlbildungen ...
Die Kunst ärztlicher Kommunikation bei Breaking Bad News
Worte haben entscheidende Wirkungen. In Gesprächen mit Patient:innen und Angehörigen gibt es meist eine hohe Erwartungshaltung gegenüber der Ärztin, dem Arzt. Vor allem die Übermittlung ...
Was brauchen Mädchen für eine selbstbewusste Sexualität?
Die Entwicklung der eigenen Sexualität ist zentraler Bestandteil des Erwachsenwerdens. Manchen Mädchen fällt es jedoch nicht leicht, ihre Sexualität selbstbewusst und selbstbestimmt zu ...