Pathophysiologie und Diagnostik des diabetischen Fußsyndroms
Autoren:
Dr. Franz Landauer
Prof. Dr. Klemens Trieb
Universitätsklinik für Orthopädie und Traumatologie
Landeskrankenhaus Salzburg
E-Mail: f.landauer@salk.at
Das rechtzeitige Erkennen eines Charcot-Fußes kann einen langen Leidensweg für Patienten, hohe Arzt- und Krankenhauskosten und letztendlich eine Amputation vermeiden helfen. Diese Arbeit soll das Bewusstsein für die Diagnose des Charcot-Fußes und die Differenzialdiagnosen schärfen und diagnostische Schritte aufzeigen. Es werden klinische Diagnosepfade aufgezeigt und darauf basierend die Klassifikationen dargestellt. In den letzten Jahren haben sich durch neue Technologien bei der Wundbehandlung, der interventionellen radiologischen Gefäßoptimierung, der orthopädietechnischen Versorgung und der chirurgischen orthopädischen Versorgung von Charcot-Füßen viele gute Behandlungsmöglichkeiten ergeben. Die Behandlung setzt eine strukturierte Diagnose und Klassifikation voraus, wobei neben der konservativen Behandlung neue operative Konzepte ihren Platz finden.
Es ist die Frage weiterhin ungeklärt, weshalb nicht alle Patienten mit diabetischer Neuropathie einen Charcot-Fuß entwickeln. In der Pathogenese spielen sowohl inflammatorische als auch mikrotraumatische Ereignisse eine große Rolle. Wichtig ist die rasche antiinflammatorische Therapie mit dem Einleiten der in den folgenden Kapiteln gezeigten operativen und konservativen Therapiemaßnahmen.
Die Veränderungen auf mikrobiologischer Ebene, sei es nun die Verschiebung der Zytokinspiegel zugunsten der proinflammatorischen Zytokine oder der erhöhte Knochenabbau und die Gefäßschädigung über das RANK/RANKL-OPG-System, seien hier nur beispielhaft genannt.
Die Charcot-Arthropathie ist nach dem französischen Neurologen Jean-Martin Charcot (1825–1893) benannt und als progressive denervationsinduzierte Destruktion der Fuß- und Sprunggelenke dargestellt. Charcot beschrieb viele verschiedene Formen der Arthropathie, aber auch der Ataxie und Veränderungen an Knochen und Gelenken, wie sie bei der tertiären Syphilis als Tabes dorsalis vorkommen.
Die derzeit häufigste Ursache neuropathischer Veränderungen am Fuß ist der Diabetes mellitus mit der damit vergesellschafteten Neuropathie. Eine Schwierigkeit ist die unterschiedliche Benennung der Entität. Die Erkrankung selbst hat verschiedene Namen, wie zum Beispiel Charcot-Osteoarthropathie, neuropathische Osteopathie oder auch diabetische neuropathische Osteoarthropathie. Es gibt aber auch Begriffe wie diabetischer Fuß und Charcot-Fuß, die nebeneinander verwendet werden.
Differenzialdiagnostisch ist vom Charcot-Fuß das diabetische Fußsyndrom zu unterscheiden, das als Infektion und Destruktion der Weichteile bei pAVK und peripherer Neuropathie imponiert.
Die Spätform des Diabetes mellitus, manifestiert als Charcot-Fuß, wird auch als diabetische neurogene Osteoarthropathie (DNOAP) klassifiziert. Die Erkrankung zeichnet sich durch eine fatale Progredienz aus, wenn sie unerkannt und unbehandelt bleibt. Die Prävalenz der Erkrankung ist nicht sicher darstellbar. Die geschätzte Prävalenz von ca. 1% erhöht sich bei Diabetikern auf 10%, wenn eine Bildgebung durchgeführt wird. Die Erkrankung tritt meistens im 5.Lebensjahrzehnt auf, wobei mehr als 80% bereits seit mehr als 10 Jahren an einem manifesten Diabetes leiden. Eine bilaterale Form ist bei 10% der Patienten zu beobachten.
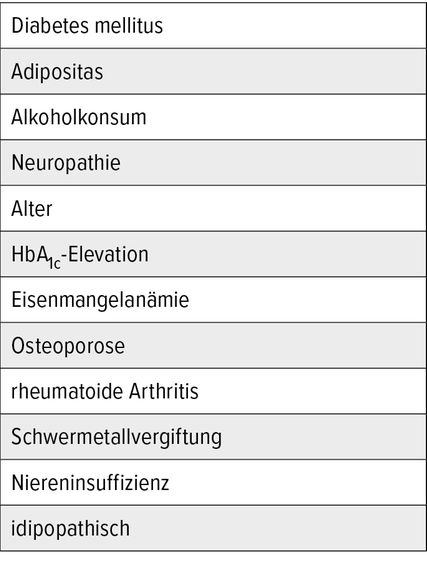
Der Charcot-Fuß ist sehr oft mit einem manifesten Diabetes mellitus vergesellschaftet und folgende Faktoren führen zu einer erhöhten Inzidenz: Fettleibigkeit, Neuropathie, Alter, Diabetes seit mehr als 5 Jahren, erhöhtes HbA1c, Niereninsuffizienz, Eisenmangelanämie, Osteoporose und rheumatoide Arthritis. In Tabelle 1 werden des Weiteren Alkoholabusus, Schwermetallvergiftung oder die idiopathische Form unterschieden.
Bei der Charcot-Osteoarthropathie ist im Vergleich zum nicht erkrankten Fuß der Gegenseite eine deutliche Progression feststellbar. Das klinische Erscheinungsbild, wie in Tabelle 2 dargestellt, zeigt die Verschlechterung der Fußarchitektur und löst weitere Charcot-Folgen aus; das sind: Mikrofrakturen, Pseudoarthrosen, Gelenksdislokationen, Fußdeformität, Hautulzerationen und ein bis zu 12-fach erhöhtes Amputationsrisiko.
Pathophysiologie
Zur Pathophysiologie ist grundsätzlich zu erwähnen, dass es 2 unterschiedliche Zugänge gibt, welche die Pathogenese der Charcot-Arthropathie erklären sollen: einerseits die neurovaskuläre, andererseits die neurotraumatische Theorie. Es ist davon auszugehen, dass beide Theorien ihre Berechtigung haben und eine Kombination der beiden Mechanismen vermutlich die zurzeit wahrscheinlichste Erklärung für die Pathogenese der Erkrankung liefert.
Neuropathische Theorie
Durch die autonome Neuropathie werden pathologische vaskuläre Reflexe ausgelöst. Dies betrifft einerseits die Innervation der glatten Muskulatur der Gefäße, welche weitergestellt werden, andererseits auch arteriovenöse Shuntbildung. Durch diese Mechanismen kommt es zur klinischen Manifestation in Form von erhöhter Temperatur, Rötung und dilatierter dorsaler Venen. Der erhöhte Blutfluss führt außerdem durch Monozyten- und Osteoklastenanreicherung zur erhöhten Knochenresorption und resultierend daraus zur Osteopenie. Das wiederum führt in Kombination mit kleinen Verletzungen zur Zerstörung der physiologischen Knochenarchitektur, und das wiederum zu den bereits genannten Folgen am Fuß.
Neurotraumatische Theorie
Der Hintergrund ist, dass durch die fehlende Sensibilität der Fuß empfindlicher für Verletzungen wird und mit der fehlenden Schonung und ständigen Belastung des bereits verletzten geschädigten Fußes die Progression der Deformität gefördert wird. Immer wieder erfolgende Mikrotraumen führen schlussendlich zu makroskopisch erkennbarer Zerstörung. Trotzdem ist die neuropathische Theorie nicht alleinig zutreffend, da nur ein kleiner Teil der Patienten mit Neuropathie einen Charcot-Fuß entwickelt und es nicht erklärbar wäre, dass nicht alle Patienten mit dieser Erkrankung auch die entsprechende Fußbeteiligung aufweisen.
Blutfluss und lokaler Knochenabbau
Auf alle Fälle ist unumstritten, dass als Folge des erhöhten Blutflusses und des Knochenabbaus die Erkrankung ausgelöst und die Progression erhalten wird. Das Ganze geschieht meist noch in Zusammenhang mit fehlerhafter Fußpflege und ungenügendem Schuhwerk in Verbindung mit Übergewicht.
Die lokale Entzündung ist der ursächliche Faktor für die Progredienz des pathophysiologischen Prozesses. Dabei kommt es zu einem Ungleichgewicht zwischen pro- und antientzündlichen Zytokinen, wodurch der Entzündungsprozess gesteigert wird. Interessant ist in diesem Zusammenhang auch die Beteiligung von Neuropeptiden. Es wird angenommen, dass das zentrale Nervensystem in unmyelinierten sensorischen Neuronen Peptide produziert und durch deren Sekretion den Entzündungsprozess beeinflusst. Es ist dies ein nichtsynaptischer, diffuser, langsamer Prozess. Capsaicin-induzierte Auslöschung von Neuropeptiden sowie Substanz P oder Calcitonin-Gen-verwandtes Peptid verursachen Knochenverlust und Frakturen. Des Weiteren wird dadurch der Ausstoß von Interleukin-10 durch Monozyten gesteigert. Ebenso spielen die sympathische Stimulation über die Katecholaminsynthese und noradrenerge Innervation des Knochengewebes und dadurch indirekt die Steuerung des Blutflusses eine Rolle. β2-adrenerge Rezeptoren werden von Osteoblasten exprimiert und über deren Stimulation durch Noradrenalin wird die Alkalische-Phosphatase-Aktivität erhöht und somit der Knochenabbau gesteigert.
Proinflammatorische Proteine
Es zeigt sich beim Charcot-Fuß eine Fehlmodulation des Immunsystems durch den Überhang von proinflammatorischen Zytokinen. Das heißt: TNFα, IL-1β, IL-6 und CD14+ Zellen sind erhöht, während die antientzündlichen Peptide IL-4 und IL-10 vermindert sind. Die Monozyten als zentrale steuernde Zellen des Immunsystems werden dadurch ständig aktiviert und stimulieren ihrerseits wieder T-Lymphozyten. Insgesamt ist auch eine verminderte Produktion von entzündungshemmenden Zytokinen zu verzeichnen. Diese ist vergesellschaftet mit einer erhöhten Widerstandsfähigkeit gegen Apoptose, hauptsächlich vermittelt durch IL-1β und TNFα. Beim Vergleich von Diabetikern mit und ohne Charcot-Neuropathie (CN) und Gesunden zeigte sich bei allen drei Gruppen eine unterschiedliche Expression von Plasma-Wachstumsfaktoren und Antioxidantien, am geringsten exprimiert in der CN-Gruppe.
RANK/RANKL/OPG-mediierte Prozesse
Der Rezeptoraktivator der nukleären Faktor-κB-Liganden (RANKL) ist ein Mitglied der Tumornekrosefaktor(TNF)-Überfamilie und der Ligand, der seinen Rezeptor (RANK) aktiviert. Durch die Aktivierung von RANK durch den RANKL kommt es über die intrazellulären Wege zur Bildung des nukleären Transkriptionsfaktors NF-κB. Das wiederum induziert Osteoklasten-Vorläuferzellen und stimuliert diese zur Differenzierung zu reifen Osteoklasten. So ist hier der zentrale Punkt für die Entwicklung der Charcot-Arthropathie gegeben, wobei es durch die Osteolyse zur Prädisposition für Mikrofrakturen und Knochenumbauvorgänge kommt. Der Gegenspieler von RANKL, das Osteoprotegerin, ist im kompetitiven Wettbewerb mit RANKL und kann so die Entzündungsprozesse verringern oder verhindern. RANKL kann biologisch auf zwei Arten wirksam werden: einerseits durch Produktion und Sekretion aus T-Zellen, Endothelzellen und Osteoklasten, andererseits durch proteolytisches Lösen von seinem Rezeptor. Neben Differenzierung löst die Bindung von RANKL an RANK auch andere intrazelluläre Signale aus. So werden in Muskelzellen von Blutgefäßen Kalzifizierungen ausgelöst und damit wird die Gefäßschädigung beim Diabetiker weiter vorangetrieben. Diese geschädigten Gefäße führen zu den bereits genannten Phänomenen wie Gefäßdilatation, Wärme und Aggravierung der Charcot-Osteoarthropathie.
Beim Charcot-Fuß liegen zusätzlich erhöhte RANKL-OPG-Verhältnisse vor, sodass die entzündlichen Faktoren in diesem Kreislauf die Überhand bekommen. Diese beiden Prozesse, Gefäßschädigung und Osteolyse, sind die Hauptproponenten der durch RANKL induzierten Progredienz der Charcot-Osteoarthropathie.
Definition/Epidemiologie des Charcot -Fußes: die diabetische Osteoarthropathie (DNOAP) und das diabetische Fußsyndrom (DFS)
Definition des Charcot-Fußes oder der diabetischen neuropathischen Osteoarthropathie ist eine aseptische Auflösung von Knochen und Gelenken mit peripherer Neuropathie. Im Zuge der komplexen pathophysiologischen Vorgänge beim Charcot-Fuß kommt es letztendlich zu einer Osteolyse und Gelenksdestruktion, das Fußlängs- oder -quergewölbe bricht ein und es kommt zu atypischen Druckbelastungen mit Ulkusgefahr. Circa 0,15–2,5% der Diabetiker erleiden eine Charcot-Arthropathie, wobei hier die Krankheit meist über 10 Jahre besteht, egal ob ein Diabetes Typ 1 oder Typ 2 vorliegt. In 30% kann eine Charcot-Arthropathie an beiden Füßen vorliegen bzw. sich ein Charcot-Fuß an der kontralateralen Seite entwickeln. Neben dem Diabetes mellitus ist die Charcot-Arthropathie auch bei alkoholischer Polyneuropathie, Niereninsuffizienz, Rückenmarksverletzungen und Neuropathie beschrieben. In 25–50% der Fälle geht beim akuten Charcot-Fuß eine Traumaanamnese voraus. In den Fällen, wo kein Trauma erhebbar ist, begünstigen vermutlich repetitive Mikrotraumen bei einem polyneuropathischen Fuß den akuten Charcot-Fuß. Die periphere sensorische Neuropathie ist eine sehr wichtige Komponente für die Entstehung des akuten Charcot-Fußes.
Das diabetische Fußsyndrom (DFS) hingegen ist eine Sammelbezeichnung diabetischer Spätschäden des Fußes mit neuropathischer (sensorische, autonome, motorische Polyneuropathie) und vaskulärer Komponente (Mikroangiopathie, Makroangiopathie). Das DFS ist weiterhin eine der Hauptkomplikationen bei Diabetes mellitus, sie ist unabhängig vom Diabetestyp und von der Art der Verletzung. Das DFS besteht aus einer Vielzahl unterschiedlicher Defektsituationen verschiedener Genese. Eine Klassifikation und die exakte Beschreibung der Läsionen sind für die strukturierte Diagnostik sowie die interdisziplinäre stadienorientierte Therapie unabdingbar. Die Hauptgefahren bei neuroischämischen diabetischen Fußläsionen sind fortschreitende Infektionen mit Sepsis, Plantarphlegmonen und folglich Majoramputationen. Ziele einer interdisziplinären Therapie des DFS sind Revaskularisation, Infektionskontrolle, Ulkusabheilung, Vermeidung von Majoramputationen sowie Erhalt von Lebensqualität, Mobilität und Selbstständigkeit.
Die Pathophysiologie des DFS ist häufig multifaktoriell. Die wesentlichen auslösenden Faktoren sind die diabetische Polyneuropathie sowie die Angiopathie, wobei man hier Mikro- von Makroangiopathie unterscheiden muss. Beim DFS sind ca. 60% rein neuropathisch, ca. 10% sind rein pAVK-bedingt und ca. 30% haben ein Mischbild aus Neuropathie und pAVK. Die Prognose ist natürlich von der Genese abhängig: ob sie rein neuropathisch, respektive auch ischämisch ist oder ein Mischbild zeigt. Neben kleinen Verletzungen, wie offenen Stellen, Brandblasen oder eingetretenen Fremdkörpern, begünstigen auch knöcherne Fehlstellungen im Vor-, Mittel- oder Rückfußbereich abnorme Druckbelastung und tragen zur Ulkusbildung bei. Dazu kommen eingewachsene Zehennägel, Fußpilze sowie Hornhautschwielen als begünstigende Faktoren für eine bakterielle Entzündung.
Klinik und Diagnostik
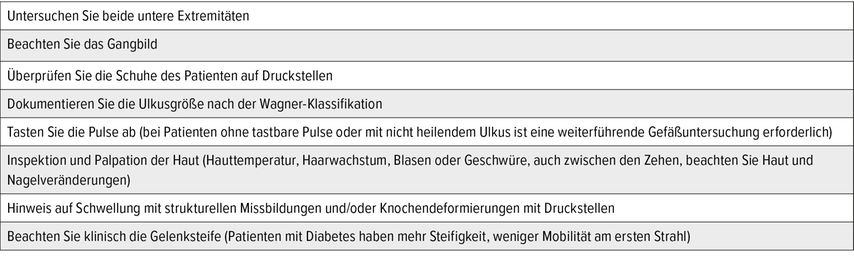
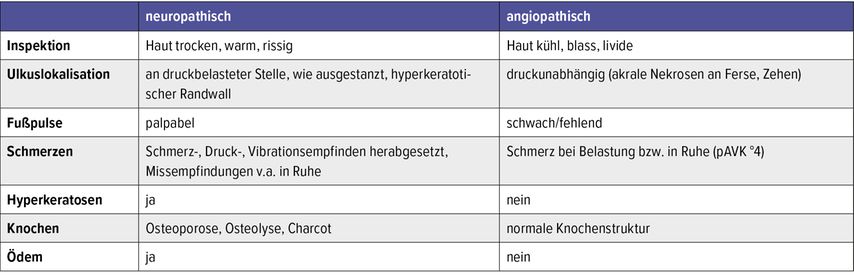
Bei der körperlichen Untersuchung ist neben der Hautbeschaffenheit auf Knochendeformierungen, Zeichen von Nervenschädigungen und Durchblutungsstörungen, Entzündungszeichen und auch auf passendes Schuhwerk zu achten. Bei neuropathischer Verdachtsdiagnose erfolgt eine detaillierte Anamnese in Bezug auf Taubheitsgefühle, Parästhesien und Missempfindungen. Die Haut soll sowohl inspiziert als auch palpiert werden, wobei das Augenmerk auf Hautschwielen, Hautturgor, Schweißbildung, Temperatur und Muskelatrophien gelegt werden soll. Ein relativ einfacher klinischer Test ist der Elevationstest: Der Fuß ist im Hängen bzw. im liegenden Zustand stark gerötet. Bei Elevation des Beines kommt es bei einem geröteten akuten Charcot-Fuß meist zu einem Rückgang der Rötung, was für die reaktive Hyperämie spricht und womit hier klinisch oft ein Erysipel ausgeschlossen werden kann. Weiters sollten auch der Achillessehnenreflex mittels Reflexhammer und das Vibrationsempfinden mittels Stimmgabel überprüft werden. Die Drucksensibilität sollte mittels Semmes-Weinstein-Monofilament getestet werden. Die Fußuntersuchung wird in Tabelle 3 dargestellt. Die Klinik zur Differenzialdiagnose neuropathisches/angiopathisches DFS ist in Tabelle 4 dargestellt.
Serologie
Es gibt derzeit kein allgemein akzeptiertes serologisches Kriterium zur Diagnose von DNOAP. Einige Studien zeigen jedoch, dass serologische Marker die Diagnose oder die Differenzialdiagnosen unterstützen oder widerlegen und so die endgültige Diagnose einengen können. Eine Leukozytose, erhöhtes C-reaktives Protein (CRP), eine erhöhte Blutsenkungsgeschwindigkeit (BSG) und eine rezente Hyperglykämie in der Anamnese sind alles systemische Reaktionenauf eine Infektion.Die Nützlichkeit dieser Entzündungsparameter für die Identifikation einer Infektion wird in der gesamten Literatur unterstützt und ist daher ein wertvolles Werkzeug zur Differenzialdiagnose des akuten Charcot-Fußes oder einer Infektion. Jüngste Studien haben beim akuten Charcot-Fuß gezeigt, dass eine Dissoziation zwischen lokaler und systemischer entzündlicher Antwort vorliegt. Eine Leukozytose, erhöhte CRP und BSG sind systemische Parameter für eine Infektion. Bei fehlenden Entzündungsparametern ist eine Infektion unwahrscheinlich und bei positiver Klinik und Röntgen spricht dies für einen Charcot-Fuß.
Wagner-Armstrong-Einteilung des DFS
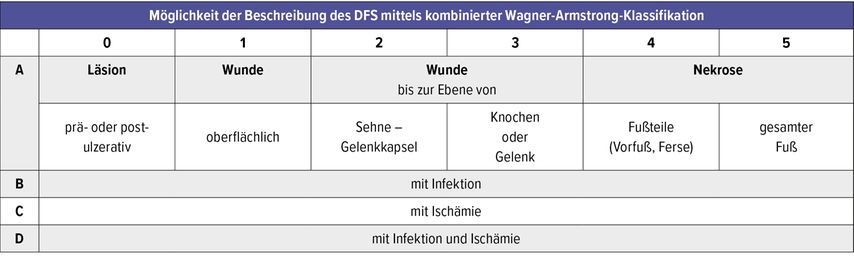
Gründe für eine einheitliche Klassifikation des DFS bestehen in der Notwendigkeit einer exakten und reproduzierbaren Beschreibung der Läsionen. Die Klassifikation des DFS erfolgt nach den Kriterien der Ausdehnung (Wagner) und dem Vorhandensein einer Ischämie und/oder Infektion (Armstrong), entsprechend den aktuellen nationalen Empfehlungen. Aus verschiedenen Vorlagen und Konzepten hat sich die von Wagner und Megitt bereits 1970 entwickelte und 1981 publizierte Klassifikation aufgrund ihrer einfachen und klaren Struktur und der klinischen Bedeutung international durchgesetzt. In Tabelle 5 ist die Wagner-Klassifikation (1–5) des DFS aufgeführt. Sie kann nach der Armstrong- Klassifikation (A–D) weiter nach Infektion und Ischämie eingeteilt werden: A=keine Infektion, keine Ischämie; B=Infektion; C=Ischämie; D=Ischämie und Infektion).
Tab. 5: Wagner-Klassifikation des DFS. Die Armstrong-Klassifikation (A–D) unterteilt die Wagner-Klassifikation (1–5) nach Infektion und Ischämie weiter ein (A = keine Infektion, keine Ischämie; B = Infektion; C = Ischämie; D = Ischämie und Infektion)
Eichenholtz-Einteilung des Charcot-Fußes
Neben Anamnese und klinischer Untersuchung stellt die radiologische Bildgebung den entscheidenden Baustein zur Diagnostik und Verlaufskontrolle des DFS und des Charcot-Fußes dar. Wie in Tabelle 6 dargestellt, wird der Charcot-Fuß in die Stadien nach Eichenholtz eingeteilt, wobei hier dem Stadium I eine besondere Bedeutung zukommt. Dieses Stadium ist mit Rötung, Ödem und Überwärmung klassifiziert. Differenzialdiagnosen wie Phlegmone, Erysipel, Thrombose und Osteomyelitis sind zu beachten und auszuschließen. In diesem Stadium ist eine schnelle und rasche Abklärung notwendig, um eine Deformierung des Fußes hinauszuzögern oder zu verhindern. Klinisch betrachtet ist das Stadium I die aktive Phase, während die Stadien II und III Phasen der Heilung darstellen. Im Stadium I kommt es zu Gelenk- und Weichteilschwellung, Knochen- und Knorpeldetritus sowie intraartikulären Frakturen und Dislokationen. Es kommt bereits in dieser Phase ohne adäquate Therapie zu einer zunehmenden Fehlstellung. Im Stadium II beginnt im Wesentlichen die Heilung. Die Nekrosen werden resorbiert, das Ödem reduziert sich, es beginnt die Fusion von Fragmenten. Das Stadium III, die Restitution, ist gekennzeichnet durch Revaskularisation und Remodeling der Knochen, mit dem Ziel, Stabilität zu schaffen. Hier können teils groteske Gelenkformationen entstehen.
Tab. 6: Klinische Stadien des Charcot-Fußes nach Eichenholtz und radiologische Kennzeichen im Nativröntgen und in der MRT-Untersuchung
Anatomische Klassifizierung
Die sehr verbreitete Klassifizierung des Charcot-Fußes wurde von Sanders et al. eingeführt. Sie ordnet die Prädilektionsstellen am Fuß in 4 Haupttypen ein, wobei Mischformen häufig sind. Vom Typ 1 nach Sanders spricht man, wenn die Metatarsophalangealgelenke betroffen sind, beim Typ 2 ist die Lisfrancsche Gelenkslinie betroffen, bei Typ 3 die Chopart-Gelenkslinie, bei Typ 4 das obere Sprunggelenk und bei Typ 5 das Subtalargelenk inkl. Calcaneus.
Bildgebung: Röntgen, MRT
Nach wie vor ist in der radiologischen Bildgebung die Einteilung nach Eichenholtz gebräuchlich und im klinischen Alltag unverzichtbar, da sie dem phasenhaften Erkrankungsverlauf einen typischen Röntgenbefund zuordnet und damit die stadienorientierten Therapiemaßnahmen begründet. Wenn sich ein Patient mit lokalisierter Schwellung, Rötung und Überwärmung am Fuß präsentiert, ist zur Primärdiagnostik eine Röntgen-Standardbildgebung notwendig (Sprunggelenk ap. und seitlich, Vorfuß ap. und seitlich, ganzer Fuß stehend seitlich). In unklaren Fällen und bei primär unauffälligem Röntgen sollte eine Röntgenkontrolle nach 2Wochen erfolgen. Die Integration von MRT-Befunden in den Kriterienkatalog ergänzt die bisherige Klassifikation unter Beibehaltung der bisherigen Stadieneinteilung. Insbesondere in der Diagnostik der entscheidenden Frühphase der Erkrankung und in der Verlaufskontrolle nach therapeutischer Intervention ist die kenntnisreich interpretierte MRT der konventionellen Röntgendiagnostik weit überlegen. Die Röntgenkontrolle hinkt dem tatsächlichen Zustand des Knochens etwas hinterher. Die MRT-Untersuchung dient zudem dem Ausschluss eines Abszesses oder Empyems. Die MRT-Untersuchung ist ein sehr sensitives Werkzeug, um einen akuten Charcotfuß von einer Osteomyelitis zu unterscheiden. Sie ist zwischen 77% und 100% sensitiv und zwischen 80% und 100% spezifisch in der Diagnostik des akuten Charcot-Fußes und der Osteomyelitis.
Weitere bildgebende Maßnahmen: Szintigrafie, Leukozytenszintigrafie etc.
Die Knochenszintigrafie ist im Gegensatz zur Leukozytenszintigrafie zur Differenzialdiagnose zwischen Charcot-Fuß und Infektion weniger hilfreich, da bei der Knochenszintigrafie in beiden Fällen eine Anreicherung vorliegt, wohingegen bei der Leukozytenszintigrafie lediglich bei positiver Infektion eine Anreicherung vorliegt. Die Differenzialdiagnose ist oft schwierig, speziell im Akutstadium kann bei Unsicherheit eine MRT-Untersuchung oder eine Leukozytenszintigrafie durchgeführt werden. Die Ganzkörperknochen- und die Granulozytenszintigrafie sind durch die MRT-Untersuchung weitgehend abgelöst worden.
Die Computertomografie (CT), insbesondere die 3D-Rekonstruktion, kann insbesondere bei Luxationszuständen hilfreich in der Vorbereitung einer operativen Intervention sein. Die Positronenemissionstomografie (PET) spielt derzeit bis auf die Anwendung an wenigen Zentren trotz ihrer guten Trennschärfe im klinischen Alltag im Wesentlichen nur eine akademische Rolle, wird aber bei weiterer Verfügbarkeit eine wichtiges Instrument in der Verlaufskontrolle darstellen. Insbesondere die Möglichkeit der artefaktarmen Darstellung bei einliegenden metallischen Implantaten sowie die Differenzierung zwischen infektiösem und rein entzündlichem Geschehen anhand des Glukosemetabolismus machen diese Technik zu einem wertvollen Instrument.
Die Sonografie mit einem 10-MHz-Schallkopf kann Sehnenpathologien wie Rupturen und Flüssigkeitsverhalte entlang der Sehnenscheiden sowie intraartikuläre Flüssigkeitsansammlungen, Gelenkerosionen und -instabilitäten aufdecken. Auch in den fortgeschrittenen Stadien ist die Sonografie bei der Häufigkeit der zu erwartenden Patientenkontakte eine hervorragende und kostengünstige Möglichkeit zur schnellen, ambulant durchführbaren Verlaufskontrolle.
Gefäßdiagnostik
Zur strukturierten Gefäßdiagnostik beim Charcot-Fuß/DFS sollte ein Algorithmus befolgt werden, an dessen Ende die invasiven bildgebenden Verfahren stehen. Die Therapie auch komplexer, mehrere Gefäßetagen betreffender Verschlussprozesse kann dadurch geplant werden. Von großer Wichtigkeit bei Patienten mit Charcot-Fuß/DFS ist die Erhebung eines kompletten Gefäßstatus beider Beine. Grundlage der weiteren Diagnostik ist die bilaterale Tastung der Leisten-, Kniekehlen- und Knöchelpulse (A.tibialis posterior und A.dorsalis pedis). Es folgt die Messung der Verschlussdrücke der Fußarterien. Bei Verdacht auf eine ischämische Läsion muss eine Gefäßdarstellung erfolgen. Zur Darstellung der Becken-, Oberschenkel- und Kniearterien eignet sich die farbkodierte Duplexsonografie (FKDS). Die FKDS der Unterschenkel- und Fußarterien ist zeitaufwendig und aufgrund der häufig vorliegenden Mediaverkalkung nicht immer aussagekräftig. Bei zusätzlichem Informationsbedarf empfiehlt sich eine Kernspinangiografie (MR-Angio) der Becken- und Beinarterien. Die Qualität dieser nichtinvasiven Methode ist perfektioniert worden, sodass eine exakte Darstellung auch kleiner arterieller Segmente an Unterschenkel und Fuß einschließlich der Strömungsdynamik vielerorts gelingt. Wegen toxischer Effekte Gadolinium-haltiger Kontrastmittel gilt die MR-Angio bei niereninsuffizienten Patienten derzeit als kontraindiziert. Die diagnostische Becken-Bein-DSA (digitale Subtraktionsangiografie) wird nur selten durchgeführt, z.B. wenn die MRT kontraindiziert ist (Dialyse, Herzschrittmacher). Die DSA ist bei kompensierter Niereninsuffizienz wegen der Gefahr der kontrastmittelinduzierten Nephropathie kontraindiziert.
Fazit für die Praxis
Diabetische Fußkomplikationen sind die häufigste Ursache atraumatischer Amputationen der unteren Extremitäten und eine der Hauptursachen für die Hospitalisierung bei Diabetikern. Fußkomplikationen haben eine negative Auswirkung auf die Gesundheit im Zusammenhang mit der Lebensqualität eines Diabetespatienten, mit der Angst vor Geschwürbildung, wiederkehrender Infektion und möglicher lebenslanger Behinderung. Es gibt derzeit keine Heilung für Diabetes, die Behandlung basiert auf der Verhütung und Bewältigung von Komplikationen. Das rechtzeitige Erkennen eines DFS oder einer Charcot-Arthropathie ist die Grundvoraussetzung für einen guten Therapieerfolg. Anschließend ist eine interdisziplinäre Zusammenarbeit von Internisten, Radiologen, Orthopäden, Dermatologen, plastischen Chirurgen und Orthopädieschuhmachern für eine gute Therapiebegleitung und Vermeidung der Unterschenkelamputation Voraussetzung.
Literatur:
bei den Verfassern
Das könnte Sie auch interessieren:
Fragilitätsfrakturen von Beckenring und Acetabulum
Weltweit zeigt sich eine steigende Inzidenz von Fragilitätsfrakturen des Beckenrings und Acetabulums. Trotzdem gibt es noch wenig Evidenz und Konsens zu Operationsindikationen und - ...
Diagnostik und Therapie der Hüftkopfnekrose
Die avaskuläre Hüftkopfnekrose repräsentiert eine devastierende und einschränkende Erkrankung des Hüftgelenks, die häufig junge Patient:innen betrifft. Die Erkennung von Risikofaktoren, ...
„Mit dem Thema Osteoporose werden niedergelassene Orthopäd:innen häufig konfrontiert“
Im Interview gibt BVdO-Präsident Priv.-Doz. Dr. Florian Sevelda eine erste Vorschau auf das Programm der diesjährigen Jahrestagung im November 2024 in Wien.