Atypische Mykobakterien
Bericht:
Dr. Norbert Hasenöhrl
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Awareness für Infektionen durch atypische Mykobakterien (NTM) ist generell wohl nicht allzu groß. Umso spannender war ein Vortrag des Linzer Infektiologen Univ.-Prof. Dr. Helmut Salzer zu diesem Thema auf dem Österreichischen Infektionskongress.
Wenn man den Stammbaum derMykobakterien betrachtet, so gibt es zweiErkrankungen, die manoft heraushebt: die Tuberkulose und die Lepra. Alles andere sind sogenannte atypische Mykobakterien, auch als nichttuberkulöse Mykobakterien oder kurz NTM bezeichnet“, begann Univ.-Prof. Dr. Helmut Salzer, Klinische Abteilung für Infektiologie und Tropenmedizin, Universitätsklinik für Innere Medizin mit Schwerpunkt Pneumologie, Kepler Universitätsklinikum Linz, seinen Vortrag.
Ein Charakteristikum der NTM ist ihre Anspruchslosigkeit an ihre Umwelt. „Was wir uns allerdings immer fragen, ist, ob NTM-Infektionen zunehmen. Wenn man die verfügbare Literatur analysiert, so scheint das tatsächlich der Fall zu sein, wie eine rezente Metaanalyse zeigte“, so Salzer.
Erkrankungsspektrum, Risikofaktoren, Pathogenität
Welches Erkrankungsspektrum können NTM nun verursachen? Im Wesentlichen sind es drei Bereiche: pulmonale, disseminierte (vor allem bei Immunsuppression vorkommende) und sonstige Infektionen.
„Die nächste Frage ist, was zu einer solchen Infektion führt. Die NTM sind ja Umweltkeime, das heißt, wir alle haben Kontakt zu ihnen, aber die meisten von uns erkranken nicht daran“, fuhr der Experte fort.
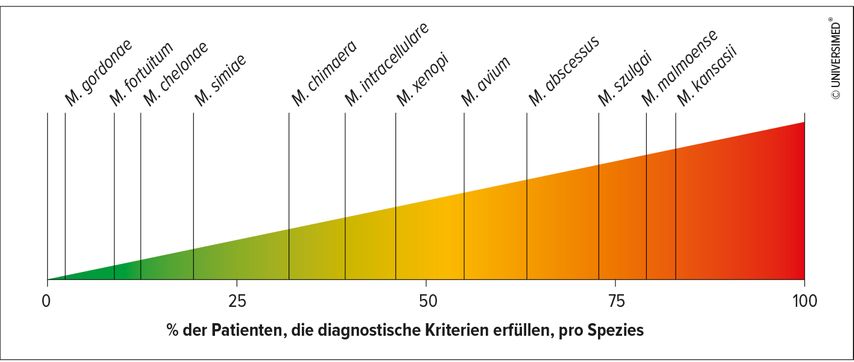
Es gibt eine Reihe beschriebener Risikofaktoren, von denen der weitaus stärkste das Vorhandensein von Bronchiektasien ist, gefolgt von niedrigem Körpergewicht, Lungengerüsterkrankungen, immunmodulatorischen Medikamenten (insbesondere TNF-alpha-Blockern), Kortikosteroiden, rheumatoider Arthritis und gastroösophagealem Reflux. „Allerdings muss man bezüglich der Bronchiektasen sagen, dass nicht immer klar ist, ob sie die Ursache oder die Folgen einer NTM-Infektion sind.“ Ein niedriger Body-Mass-Index (BMI) ist ein Risikofaktor nicht nur für das Entstehen einer NTM-Infektion, sondern auch für einen schlechten Verlauf. „Wir unterstützen unsere NTM-Patienten mit niedrigem BMI mit einer hochkalorischen Ernährung“, betonte Salzer. Was die Pathogenität der einzelnen NTM angeht, so gibt es hier ein sehr breites Spektrum, von pathogen (z.B. M. kansasii) bis nicht pathogen (z.B. M. gordonae; Abb. 1).
Diagnostik und Prognose
„Ich möchte Ihnen an dieser Stelle einen Fall schildern“, so Salzer weiter. Es handelte sich um einen 30-jährigen Mann mit „Raucherhusten“ bei inhalativem Tabakkonsum. „Eigentlich war das ein Zufallsbefund, weil der Patient für die private Zusatzversicherung ein Lungenröntgen brauchte und sich hier im Oberlappen Veränderungen fanden“, so der Experte. Aufgrund der CT bestand der Verdacht auf eine pulmonale Tuberkulose. Der Patient wurde isoliert. Das Sputum war Ziehl-Neelsen(ZN)-positiv, die PCR auf M.-tuberculosis-Komplex jedoch negativ. „Also eigentlich ein Klassiker“, kommentierte Salzer. „Es fand sich dann als Erreger M. shimoidei.“ Dies ist ein Erreger, der 1968 in Japan erstmals beschrieben wurde. Bisher sind weltweit ca. 40 Fälle publiziert.
M. shimoidei ist eng verwandt mit M. xenopi, zu dem es mehr Daten gibt. In einer kanadischen Studie mit knapp 2000 Patienten, die mit M. xenopi infiziert waren, fand sich eine 5-Jahres-Überlebensrate von knapp 60%.
In der Radiologie finden sich bei NTM-Infektionen zumeist noduläre oder kavitäre Verschattungen oder Bronchiektasien mit multiplen kleinen Noduli im Thorax-CT. „Grundsätzlich ist ein nodulär-bronchiektatischer von einem fibrokavernösen Typ zu unterscheiden“, so der Experte.
Generell haben NTM-Patienten mit Kavernen eine schlechtere Prognose. „Man muss aber sagen, dass die Dynamik von NTM-Infektionen individuell äußerst unterschiedlich sein kann und noch nicht komplett verstanden wird“, betonte Salzer. „Da gibt es stabile Verläufe über zehn Jahre und letale Ausgänge über kürzere Zeiträume.“
Mikrobiologisch werden positive Kulturen von mindestens zwei Sputa oder mindestens eine positive Kultur aus Bronchialsekret oder Bronchiallavage (BAL) oder eine transbronchiale oder andere Lungenbiopsie mit einer zu Mykobakteriose passenden Histologie (granulomatöse Entzündung oder säurefeste Stäbchen) und eine NTM-positive Kultur aus der Biopsie oder respiratorischem Sekret gefordert. „Wesentlich ist zu sagen, dass das Labor Mykobakterien nicht von selbst sucht, das muss man anfordern“, so der Experte. Als Material kommen Sputum, Bronchialsekret, spezielle Blutkulturen oder Gewebsproben (kein Formalin!) infrage. Aus dem Primärmaterial lassen sich ZN-Färbung, PCR (die aber weniger sensitiv ist als bei der klassischen Tuberkulose) oder molekulare Resistenztestungen mit ihren Limitationen durchführen.
Mehr Zeit benötigt die Kultur (die als Goldstandard anzusehen ist), für die spezielle Medien erforderlich sind. Hier lässt sich eine exakte Erregerbestimmung mit phänotypischer Resistenztestung und ggf. auch „whole genome sequencing“ machen. „Die phänotypische Resistenztestung hat in den letzten Jahren an Bedeutung gewonnen. Zum Beispiel bei Mycobacterium avium wollen wir doch unbedingt wissen, ob eine Resistenz gegen Makrolide vorliegt oder nicht“, forderte Salzer.
„Was man nicht übersehen darf, ist der Ausschluss alternativer Diagnosen“, so Salzer weiter. Hier kommt eine Reihe von Möglichkeiten, über das Bronchuskarzinom und Autoimmunerkrankungen bis hin zu Non-CF-Bronchiektasien und anderen, infrage.
Therapie
Mittlerweile wurde gezeigt, dass eine Leitlinien-gerechte Therapie eine bessere Prognose für NTM-Patienten bedeutet. „Allerdings gibt es eine Befragung von über 700 Ärztinnen und Ärzten, die ergab, dass nur 9% in Europa tatsächlich nach der gültigen Leitlinie der ATS/IDSA behandelten“, mahnte Salzer.
Die rezenteste Leitlinie stammt von 20201 und deckt die vier Erreger ab, für die es die meisten Daten gibt: M. avium complex (MAC),M. kansasii,M. xenopi und M. abscessus. M. kansasii ist relativ nah mit M. tuberculosis verwandt und zeigt auch ein ähnliches radiologisches Bild. Und die Infektion wird auch ähnlich wie Tuberkulose behandelt: Makrolid (ggf. Isoniazid) in Kombination mit Rifampicin und Ethambutol. „Meist ist der Therapieerfolg gut“, sagte der Experte.
In Österreich als NTM-Erreger am häufigsten ist MAC (ca. 40% aller NTM-Infektionen). „Hier hat das Makrolid als Therapeutikum zentrale Bedeutung“, erklärte Salzer. „Internationalen Daten zufolge sind die Outcomes bei Makrolid-resistenter MAC-Infektion deutlich schlechter als bei Makrolid-Empfindlichkeit.“ So erreichen 80% der Makrolid-sensitiven, aber nur zwischen 5% und 36% der Makrolid-resistenten MAC-Infektionen durch Therapie eine Sputumkonversion.
Laut Leitlinie sollte Azithromycin gegenüber Clarithromycin bevorzugt werden. Eine Kombination von mindestens drei Medikamenten ist erforderlich, meist Makrolid plus Ethambutol plus Rifampicin. „Allerdings wird der Einsatz von Rifampicin kontroversiell diskutiert, und es gibt auch eine Studie, in der die Kombination Clarithromycin/Ethambutol der Dreierkombination mit zusätzlichem Rifampicin nicht unterlegen war“, schränkte Salzer ein. Bei Makrolidresistenz, schwerer Erkrankung und/oder Vorliegen von Kavernen sollte man im Sinne einer Therapieeskalation zumindest für zwei bis drei Monate Amikacin i.v. dazugeben.
Eine relativ neue Option ist das inhalative liposomale Amikacin (ALIS). Indiziert ist es bei MAC-Infektion für Erwachsene mit begrenzten Behandlungsoptionen. „Diese Formulierung lässt jedoch Raum für Diskussionen, die auch zu führen sind“, führte der Experte aus.
Die aktuelle Leitlinie räumt auch die Möglichkeit ein, bei leichteren, nodulär-bronchiektatischen Formen ohne Kavernen eine intermittierende, dreimal wöchentliche Therapie zu verabreichen. Grundsätzlich gilt für die Therapiedauer, dass sie ab Kulturkonversion zwölf Monate betragen sollte.
„Es gibt übrigens inzwischen auch eine Leitlinie2 für Lungenerkrankungen durch sieben weitere NTM, also insgesamt elf“, so Salzer abschließend.
Quelle:
„Atypische Mykobakteriose – NTM“; Vortrag von Univ.-Prof. Dr. Helmut J.F. Salzer, Linz, im Rahmen vom Symposium 8 am 15. Österreichischen Infektionskongressam 24. März 2023 in Saalfelden
Literatur:
1 Daley CL et al.: Treatment of nontuberculous mycobacterial pulmonary disease: an official ATS/ERS/ESCMID/IDSA clinical practice guideline. Clin Infect Dis 2020; 71(4): e1-e36 2 Lange C et al.: Consensus management recommendations for less common non-tuberculous mycobacterial pulmonary diseases. Lancet Infect Dis 2022; 22(7): E178-E190
Weitere Literatur beim Vortragenden
Das könnte Sie auch interessieren:
Pulmonale Hypertonie: Was muss der Praktiker wissen?
Die pulmonale Hypertonie (PH) ist eine häufige klinische Manifestation einer heterogenen Gruppe von Erkrankungen, die meist durch Belastungsdyspnoe gekennzeichnet ist und hämodynamisch ...
Zukünftige pharmakologische Therapien bei COPD und Asthma
Die vielversprechenden Daten zum Einsatz von Biologika in der COPD-Behandlung, die RSV-Impfung, aber auch ganz neue Wirkstoffe zur Behandlung von Asthma und COPD wurden am SGP- ...