Psychopharmaka-Interaktionen in der Opioid-Agonisten-Therapie
Autorin:
Mag. Sonja Habib-Mayer, aHPh
Neuromed Campus, Krankenhausapotheke
Kepler Universitätsklinikum
Linz
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der Substitutionstherapie können Medikamentenwechselwirkungen mit Psychopharmaka und Begleiterkrankungen eine Herausforderung darstellen. Umso bedeutender ist das Verständnis pharmakodynamischer und pharmakokinetischer Grundlagen der Opioid-Agonisten-Therapie (OAT), um teils schwere, sogar lebensbedrohliche Interaktionen zu verhindern.
Keypoints
Folgende Neben- und Wechselwirkungen im Rahmen der OAT können durch pharmakokinetische und/oder -dynamische Interaktionen mit Psychopharmaka, Alkohol und Beikonsum von illegalen Drogen verstärkt werden:
-
Lebensbedrohliche Atemdepression mit Benzodiazepinen, Sedativa, Alkohol, illegalen Drogen
-
Übersedierung mit Benzodiazepinen, Antidepressiva, Antipsychotika, Alkohol, illegalen Drogen
-
Verstärkte Neurotoxizität mit proserotonergen Wirkstoffen, Alkohol, illegalen Drogen
-
Kardiotoxizität mit QTc-Intervall-verlängernden Substanzen, illegalen Drogen
Die in Österreich im Rahmen der Opioid-Agonisten-Therapie (OAT) eingesetzten Opioide Methadon, Levomethadon, Buprenorphin und Morphin haben aufgrund ihrer pharmakologischen Eigenschaften das Potenzial, mit etlichen Medikamenten, aber auch mit den jeweiligen Begleiterkrankungen der Klienten, Interaktionen einzugehen. Dabei kann die Pharmakokinetik wie z.B. der Phase-I-Lebermetabolismus über das CYP450-Zytochromenzymsystem betroffen sein oder Interaktionen auf der Ebene der Pharmakodynamik ablaufen (z.B. Verlängerung des QTc-Intervalls im EKG mit dem Risiko für Herzrhythmusstörungen, Überstimulation zentraler Serotoninrezeptoren, Atemdepression). Die damit einhergehende Problematik im Medikationsprozess zu beurteilen, erfordert fundierte pharmakologische Kenntnisse und stellt auch in der Substitutionstherapie durchaus eine Herausforderung dar.
Fallvignette
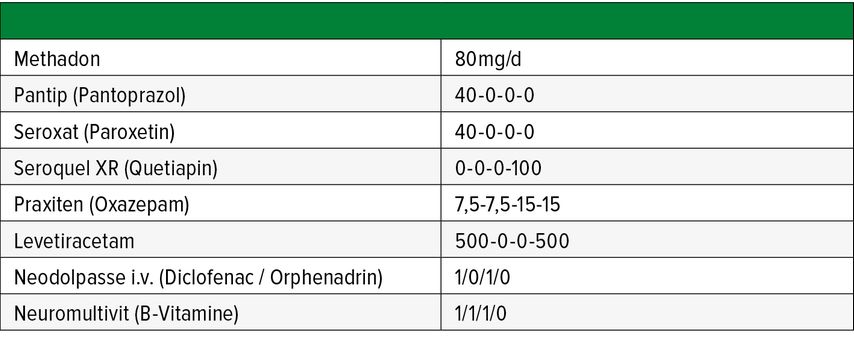
Ein im Substitutionsprogramm befindlicher 55-jähriger, männlicher Patient wird mit starken Schmerzen (Visuelle Analogskala – VAS 8) aufgrund eines Diskusprolaps (L4/L5) aufgenommen. Anamnestisch finden sich eine rezidivierende Depression, Schlafstörungen, Alkohol- und Benzodiazepinabusus. Entzugsepileptische Anfälle und ein Drogenkonsum werden von ihm negiert. Im Labor zeigen sich mittelmäßig erhöhte Leberfunktionsparameter und ein erhöhtes mittleres Erythrozyten-Einzelvolumen (MCV). Tabelle 1 zeigt die im Beispiel vorliegende Medikation des Patienten.
Tab. 1: Medikation mit Dosierungsangaben zum Fallbeispiel eines 55-jährigen, männlichen Patienten im Rahmen eines Substitutionsprogramms
Bei unzureichender Analgesie wird zusätzlich 2x tgl. Tramabene 150 mg retard (ret.) (Tramadol) verabreicht. Darauf reagiert der Patient mit massiver Unruhe, Tremor, Schwitzen und Tachykardie. Das EKG zeigt eine Verlängerung des QTc-Intervalls auf >500ms.
Was ist hier passiert?
Pharmakodynamisch kommt es zu einer Potenzierung serotonerger Nebenwirkungen (Methadon, Paroxetin, Tramadol). Pharmakokinetisch vermögen das Antidepressivum Paroxetin und Methadon die Bioaktivierung des Prodrug Tramadol via CYP2D6 zu seinem analgetisch wirksamen Metaboliten O-desmethyl-tramadol relevant zu blockieren, was neben einer verminderten Analgesie dosisabhängig auch zu vermehrter Serotonintoxizität führt. Darüber hinaus behindern sich Paroxetin und Methadon gegenseitig im Abbau, was letztendlich in Kombination mit Quetiapin auch eine Verlängerung des QTc-Intervalls und ein erhöhtes Risiko für eine Torsade-de-Pointes-Tachykardie auslöst.
Interaktionen mit Methadon, Levomethadon und Morphin
Racemisches Methadon blockiert den Serotonintransporter (SERT) am präsynaptischen Neuron und bewirkt zusätzlich eine Überstimulation der postsynaptischen 5-HT-Rezeptoren (5-HT1A, 5-HT2A). Dadurch weist Methadon dosisabhängig im Vergleich zu Buprenorphin und Morphin ein höheres Potenzial für Serotonintoxizität auf. Insbesondere in Kombination mit serotonergen Wirkstoffen wie Antidepressiva (v.a. Monoaminoxidasehemmer – MAOI, Selektive Serotonin-Wiederaufnahme-Hemmer – SSRI), Tramadol, Dextromethorphan, Lisdexamfetamin oder Drogen wie LSD oder Kokain erhöht sich das Risiko für serotonerge Nebenwirkungen.
Wirkspiegelschwankungen (Erhöhung oder Senkung) von Methadon als Substrat von CYP2B6, CYP3A und CYP2C19 können mit sogenannten „Enzyminhibitoren“ als Interaktionspartner auftreten; oder der Klient ist aufgrund einer reduzierten Enzymaktivität nicht in der Lage, Methadon entsprechend abzubauen. Beides führt zu vermehrten opioidtypischen Nebenwirkungen. Im Gegenzug bewirkt die Interaktion mit sogenannten „Enzyminduktoren“ einen Spiegelabfall von Methadon und löst damit Entzugserscheinungen aus. Manche Menschen bauen als „rapid metabolizer“ Methadon schneller ab, was ebenfalls einen Wirkverlust bedeutet und dazu führt, dass Methadon nicht über 24h wirkt.
Levomethadon wird vor allem über das Enzym CYP3A4 metabolisiert und ist nur ein schwacher Inhibitor von CYP3A. Bedingt durch den geringeren Wirkstoffeinsatz im Vergleich zu racemischem Methadon ergibt sich ein geringeres Nebenwirkungspotenzial.
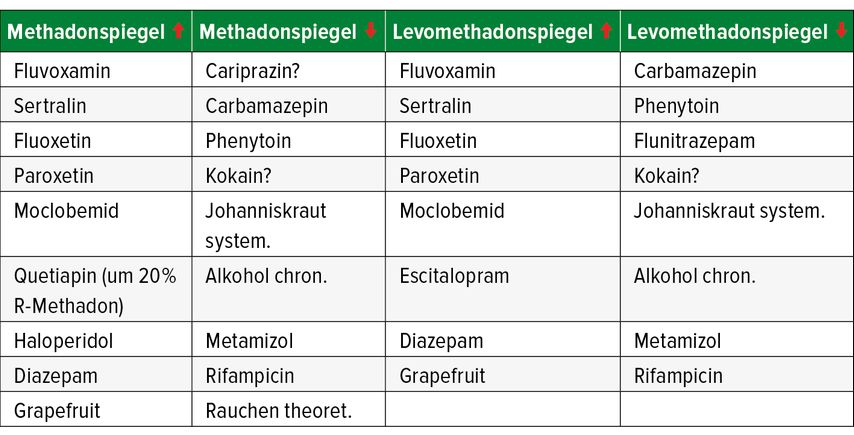
Methadon selbst wirkt als mittelpotenter Inhibitor der UDP-Glucuronosyltransferasen UGT2B4 und UGT2B7 (Phase II des Lebermetabolismus) sowie als schwacher Inhibitor von CYP2D6. Methadon und im geringeren Ausmaß Levomethadon können abhängig von der Dosishöhe und dem individuellen Risikoprofil des Klienten eine Verlängerung des QTc-Intervalls im EKG und in der Folge Herzrhythmusstörungen/Torsade-de-Pointes-Tachykardien hervorrufen (Tab. 2). Viele Klienten in der OAT erhalten aufgrund psychischer Erkrankungen auch Psychopharmaka, die je nach Wirkstoff und Dosishöhe ein unterschiedliches Potenzial für QTc-Intervall-Verlängerung haben (Tab. 3). Deshalb sollten zusätzliche Risikofaktoren wie z.B. hohe Wirkspiegel durch Inhibition des Metabolismus oder Elektrolytstörungen (Mangel an Kalium und/oder Magnesium) vermieden bzw. das individuelle Risikoprofil des Klienten beachtet werden.
Tab. 2: Beispiele für Psychopharmaka und andere Substanzen, welche relevante Wirkspiegelschwankungen (roter Pfeil nach oben = erhöht, roter Pfeil nach unten = senkt den Spiegel) von Methadon und Levomethadon verursachen können; das Ansäuern des Harns verringert die Clearance von Methadon, das Alkalisieren bewirkt eine vermehrte Elimination
Tab. 3: Verlängerung des QTc-Intervalls – Quantifizierung von Psychopharmaka und Drogen (nach www.crediblemed.org und www.mediq.ch)
Morphin wird über verschiedene UDP-Glucuronosyltransferasen (Hauptweg UGT2B7) zu Morphin 3- und Morphin 6-Glucuronid metabolisiert und überwiegend renal eliminiert. Trizyklische Antidepressiva und Benzodiazepine (Diazepam > Lorazepam > Oxazepam) blockieren hauptsächlich über UGT2B7 den Metabolismus von Morphin und steigern dessen Toxizität mit Risikoerhöhung für Atemdepression, Sedierung und Hypotonie. Morphin erniedrigt auch die Krampfschwelle.
Interaktionen mit Buprenorphin
Der Partialagonist Buprenorphin wird im Hauptweg über das Enzym CYP3A zum pharmakologisch aktiven Metaboliten Norbuprenorphin abgebaut und mithilfe von UDP-Glucuronosyltransferasen (UGT) eliminiert. Da Buprenorphin dosisabhängig hepatotoxisch wirkt, sollten in Kombination mit Agomelatin oder der Valproinsäure die Leberfunktionsparameter monitiert werden. Im Vergleich mit Methadon weist der Partialagonist ein mittleres Risiko für QTc-Intervall-Verlängerung auf und hat eine geringere Serontoninaktivität. Tabelle 4 gibt einen Überblick über Substanzen, welche zu Wirkspiegelschwankungen von Buprenorphin führen können.
Tab. 4: Beispiele für Substanzen, welche relevante Wirkspiegelschwankungen (roter Pfeil nach oben = erhöht, roter Pfeil nach unten = senkt den Spiegel) von Buprenorphin verursachen können
Literatur:
● Hara Y et al.: Morphine glucuronosyltransferase activity in human liver microsomes is inhibited by a variety of drugs that are co-administered with morphine. Drug Metab Pharmacokinet 2007; 22(2): 103-12 ● Lee HY et al.: Survey of methadone-drug interactions among patients of methadone maintenance treatment program in Taiwan. Substance Abuse Treatment Prevention And Policy 2012; 7(11): 1-12 ● Sticherling C: Methadon und QTc-Verlängerung – eine versteckte Gefahr. Swiss Medical Forum – Schweizerisches Medizin-Forum 2016; 16 (7): 157 ● Toce MS et al.: Pharmacologic treatment of opioid use disorder: a review of pharmacotherapy, adjuncts and toxicity. J Med Toxicol 2018; 14: 306-22 ● www.crediblemeds.org (letzter Zugriff: 04/23) ● www.mediq.ch (letzter Zugriff: 04/23) ● www-uptodate/drug-interactions (letzter Zugriff: 04/23)
Das könnte Sie auch interessieren:
Neues und Unpubliziertes aus der psychiatrischen Forschung und Therapie
Von 7. bis 8. November 2024 fand die 26. Jahrestagung der Österreichischen Gesellschaft für Neuropsychopharmakologie und Biologische Psychiatrie (ÖGPB) in Wien statt. Im Festsaal der ...
«Wir versuchen, gegenüber den Kindern ehrlich, aber auch sehr behutsam mit der Wahrheit zu sein»
Die Psychiaterin Roksolana Jurtschischin arbeitet im St.-Nikolaus- Kinderspital in Lwiw. Seit dem Kriegsausbruch behandelt sie mit ihren Kollegen täglich im Akkord traumatisierte Kinder ...
Entwicklungen und Trends in der Behandlung der Insomnie
Schlafstörungen betreffen einen großen Teil der Bevölkerung. Die Therapie hat sich im Laufe der Zeit grundlegend gewandelt. Heute stehen neben der kognitiven Verhaltenstherapie für ...