Zysten und Kalzifikationen in der Mamma
Autorin:
Dr. Elisabeth Ranharter
Klinisches Institut für Radiologie
Universitätsklinikum Krems
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Sowohl Zysten als auch Kalzifikationen werden häufig zufällig im Rahmen von Screening-Mammografien und -Sonografien entdeckt. Während die meisten dieser Läsionen benigne sind und keiner weiteren Abklärung bedürfen, sind die komplexen zystischen Läsionen und der polymorphe Mikrokalk weiter bioptisch abzuklären.
Zystische Läsionen
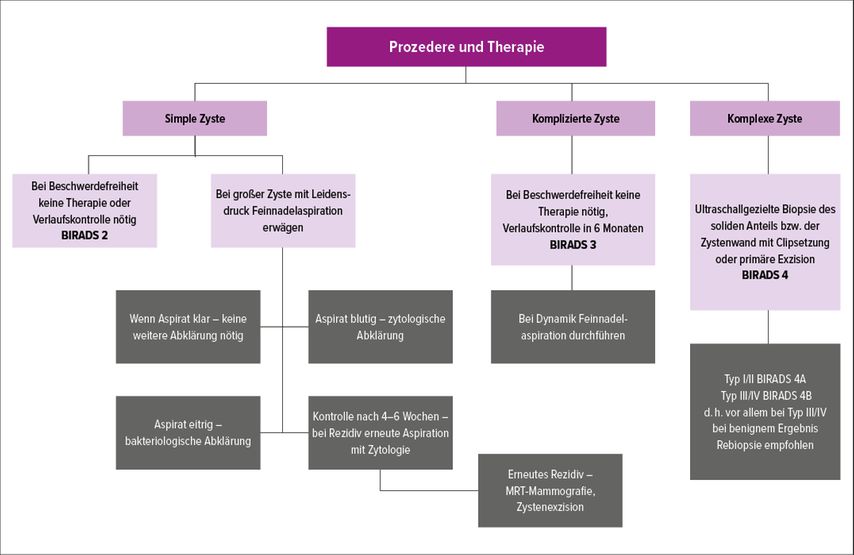
Nach ihrer Konfiguration können zystische Läsionen in simple, komplizierte und komplexe Zysten unterteilt werden.
Simple Zysten
Die simple Zyste ist eine glatt berandete Läsion mit flüssigem Inhalt und dünner Wand ohne Hinweis auf Vaskularisation oder solide Anteile. Eine Zyste entsteht durch eine Fibrose in der terminalen duktolobulären Einheit im Rahmen des zyklusbedingten Umbaus des Brustdrüsengewebes. Hierdurch kommt es zu Sekretaufstau mit lokaler Erweiterung des peripheren Milchgangs.1 Simple Zysten sind die häufigsten Raumforderungen in der Mamma mit 40%,2 oft sind sie ein benigner Zufallsbefund im Rahmen des Screenings. Jedoch können größere Zysten aufgrund des raumfordernden Effekts schmerzhaft sein. Das Auftreten liegt zwischen dem 30. und 50. Lebensjahr.1 Sie haben sehr geringes Risiko für Entartung, aufgrund dessen werden sie als BIRADS 2 klassifiziert.
Simple Zysten werden sonografisch detektiert, hier sind sie glatt berandet und mit echofreiem Inhalt und dorsaler Schallverstärkung, ohne Vaskularisation oder Septierungen. Größere Zysten können sich auch mammografisch als ovaläre Verdichtungen darstellen, die Mammografie ist hier jedoch nicht die primäre diagnostische Modalität. Natürlich lassen sich simple Zysten auch in der MRT-Mammografie darstellen, hier sind sie in T2w signalreich und zeigen keine Kontrastmittelaufnahme.
Aufgrund des fehlenden malignen Potenzials ist keine Therapie oder Verlaufskontrolle einer simplen Zyste notwendig, lediglich bei Beschwerden kann eine Zystenaspiration erwogen werden (Abb.1). Diese wird durch einen geschulten Radiologen sonografisch gezielt mittels Feinnadelaspiration durchgeführt. Bei blutiger Aspiration wird eine Zytologie angefordert, bei eitrigem Aspirat eine Bakteriologie. Nach erfolgter Drainage wird die Patientin in einem Intervall von 4–6 Wochen mit Sonografie kontrolliert, um ein Frührezidiv auszuschließen.3 Bei erneuter Zystenfüllung wird eine zweite Aspiration durchgeführt und der Inhalt zytologisch aufbereitet. Bei einem dritten Frührezidiv werden eine MRT-Mammografie und eine chirurgische Zystenexzision empfohlen.
Komplizierte Zysten
Eine komplizierte Zyste entspricht einer zystischen Läsion mit nicht komplett flüssigem Inhalt, also z.B. im Rahmen einer Einblutung oder einer Inflammation. Hier besteht oft eine Druckdolenz, bei Hautrötung muss an einen Abszess bzw. eine infizierte Zyste gedacht werden. Jedoch sollte keine Sekretion bestehen, dies wäre ein Hinweis auf eine andere Diagnose wie z.B. ein Papillom. Weiters können auch eine Galaktozele oder eine rezente Fettgewebsnekrose ursächlich für eine komplizierte Zyste sein.4 Das Malignitätsrisiko beträgt unter 1%,2 deshalb wird die komplizierte Zyste als BIRADS 3 klassifiziert. Hierdurch ergibt sich eine Kontrolle nach 6 Monaten, bei Befundkonstanz erneut nach 6 Monaten und dann 12 Monaten. Sollte sich in diesem Zeitraum keine Änderung einstellen bzw. die Zyste wieder echofrei werden, kann der Befund auf BIRADS 2 gestuft werden.
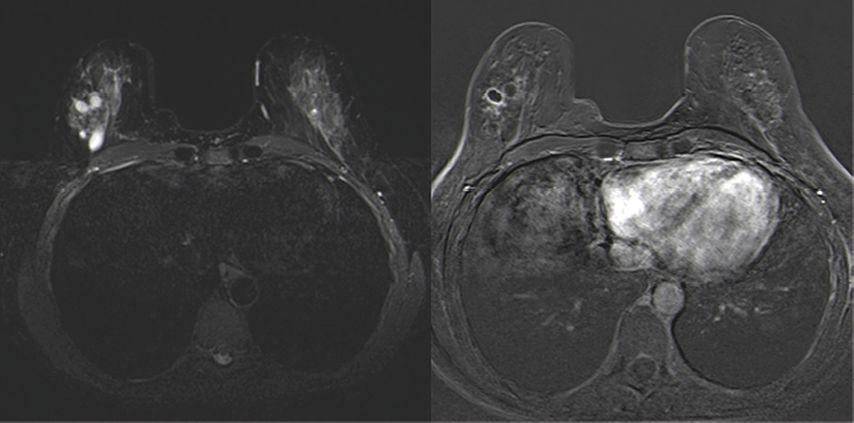
Sonografisch stellt sich diese Läsion mit nicht echofreiem Inhalt dar, es ist echoreiches Debris möglich, welches sich unter Kompression oder Lageänderung bewegt. In der Mammografie kann sich sogenannte Kalkmilch als Randverkalkung der Zyste darstellen bzw. eierschalenartige Verkalkung. Sonst ist der Zysteninhalt nur MR-morphologisch bestimmbar, hier zeigt sich je nach Dichte ein unterschiedliches Signal in T1w und T2w. Bei Inflammation ist eine Kontrastmittelaufnahme der Zystenwand möglich (Abb. 2). Die Therapie einer komplizierten Zyste ist von der Klinik abhängig und reicht von einer simplen Verlaufskontrolle über eine orale Antibiotikatherapie bis zur therapeutischen Zystenaspiration (Abb. 1).
Abb. 2: Beispiel für komplizierte Zyste. Mamma-MRT: links TIRM-Sequenz: mehrere signalreiche, hiermit seröse Zysten; rechts T1w-Subtraktion nach Kontrastmittel (KM): Eine der Zysten zeigt eine randständige KM-Aufnahme
Komplexe Zysten
Eine komplexe Zyste ist eine flüssigkeitsgefüllte Struktur mit verdickter Wand und/oder Septen und/oder soliden Anteilen. Ursächlich können sowohl benigne als auch maligne Veränderungen sein,dazu gehören die fibrozystische Mastopathie, Papillome, der Philloidestumor, aber auch die atypische duktale Hyperplasie (ADH), das DCIS und das infiltrierende Mammakarzinom.2 Insgesamt ergibt sich dadurch ein Malignitätsrisiko von durchschnittlich 40%, wobei dies von der Konfiguration der Zyste abhängig ist. Hier hilft die Einteilung nach Berg et al.,4 die am besten sonografisch oder MR-morphologisch durchgeführt werden kann:
-
Typ I, Zyste mit dicker Wand (>0,5mm) oder dicken Septen (>0,5mm) – Malignitätsrisiko (MR) 7,1%
-
Typ II, zystische Läsion mit einer oder mehr diskreten randständigen soliden Anteilen – MR 16,7%
-
Typ III, enthält gemischt zystische und solide Anteile, wobei mindestens 50% zystisch sein müssen – MR 61,1%
-
Typ IV, enthält gemischt zystische und solide Anteile, wobei mindestens 50% solide sein müssen – MR 44,8%
Aufgrund des hohen Malignomrisikos muss jede Zyste bioptisch abgeklärt werden, primär mittels sonografisch gezielter Biopsie der Zystenwand oder des soliden Anteils mit Clipsetzung. Alternativ ist auch eine chirurgische Exzision mit intraoperativem Schnellschnitt möglich.
Typ I und II werden als BIRADS 4a, Typ III und IV als BIRADS 4b klassifiziert, was vor allem bei benignem Biopsieergebnis bei Typ-III- und -IV-Zysten eine Rebiopsie rechtfertigt (Abb. 1).
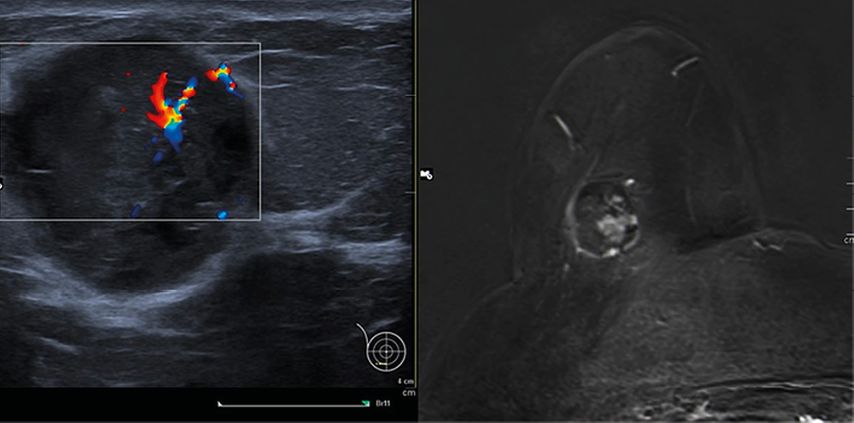
Abb. 3: Beispiel für komplexe Zyste. Links: Sonografie einer teils weichteildichten, teils zystischen Läsion mit Vaskularisation im Doppler; rechts: MRT T1w-Subtraktion nach KM: ein KM-aufnehmender Knoten im Zentrum der Zyste
Kalzifikationen
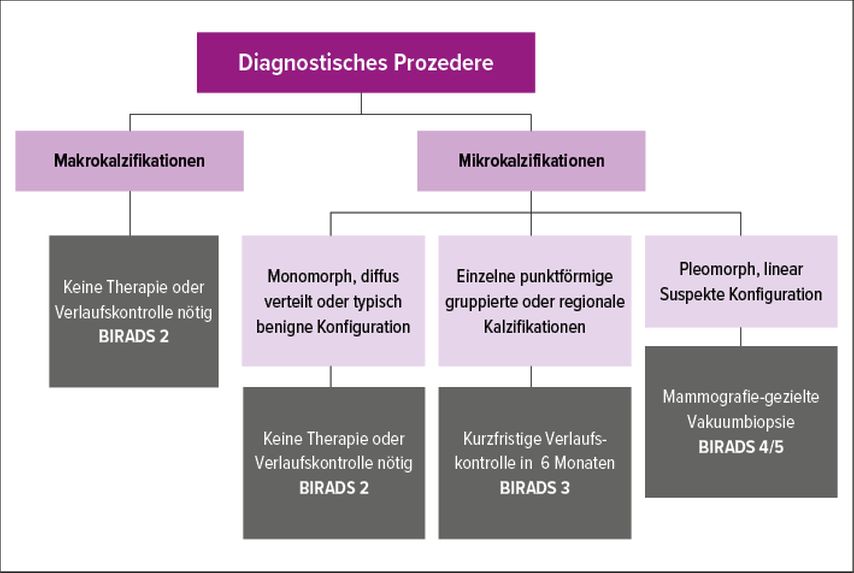
Primär unterscheidet man Mikro- von Makrokalzifikation, wobei die Grenze bei 0,5mm festgelegt wird. Alle Kalzifikationen über 0,5mm sind benigne und benötigen keine Therapie bzw. Verlaufskontrolle, also BIRADS 2. Hierzu zählen kalzifizierte Lymphknoten, kalzifizierte Fibroadenome, Hautkalzifikationen z.B. von Hautwarzen sowie größere Ölzysten.
Mikrokalzifikationen können multiple Ursachen haben, einige haben jedoch eine typische Konfiguration.
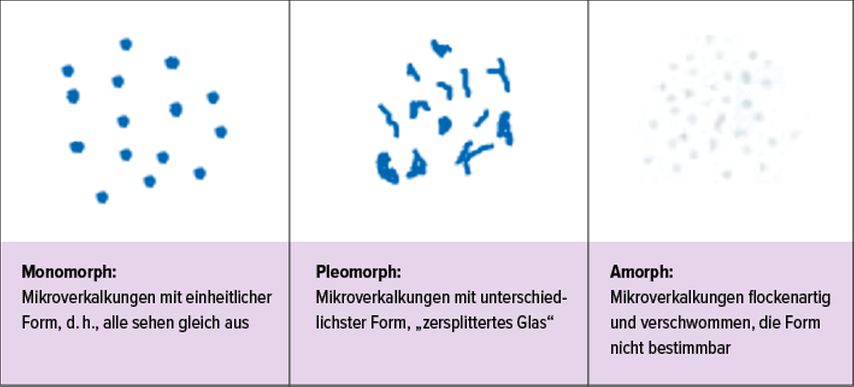
Aufgrund der Form wird zwischen monomorphem, polymorphem bzw. pleomorphem und amorphem Mikrokalk unterschieden (Abb. 4).5
Schienenartige tubuläre Kalzifikationen entsprechen intramammärer Arteriosklerose, lineare monomorphe Kalzifikationen sind typisch für die Plasmazellmastitis. Diese Kalzifikationen sind eindeutig benigne.
Pleomorpher Mikrokalk hingegen ist hochgradig suspekt, da dieser häufig im Rahmen eines DCIS oder invasiven Karzinoms auftritt. Je nach Ausdehnung ergibt sich hier ein BIRADS-4- oder -5-Befund. Aufgrund dessen muss dieser Kalk mittels Mammografie-gesteuerter Vakuumbiopsie abgeklärt werden (Abb. 6).
Amorpher Mikrokalk kann sowohl im Rahmen der Adenose als auch bei DCIS auftreten und ist je nach Ausdehnung entweder zu biopsieren (BIRADS 4) oder kurzfristig zu kontrollieren (BIRADS 3).
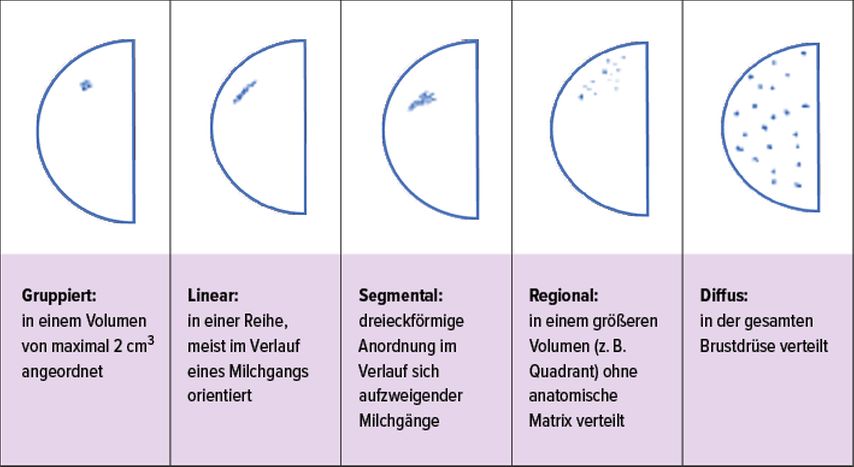
Weiters ist noch auf die Verteilung des Mikrokalks zu achten (Abb. 5).
Das Verteilungsmuster korreliert hier mit der Entstehungsursache der Mikrokalzifikationen, ist der Kalk regional oder diffus, ist die Ursache eher eine Adenose bzw. sklerosierende Adenose. Gruppierter, linearer oder segmentaler Mikrokalk entsprechen eher der Ausbreitung eines Karzinoms entlang der Milchgänge.
Hierdurch ergibt sich ein klares klinisches Prozedere (Abb. 6).
Literatur:
1 Kowalski A, Okoye E: Breast Cyst. StatPearls Publishing, 2022 2 Berg WA et al.: Cystic Breast Masses and the ACRIN 6666 Experience. Radiol Clin North Am 2010; 48(5): doi:10.1016/j.rcl.2010.06.007 3 Hamed H et al.: Follow-up of patients with aspirated breast cysts is necessary. Archives of Surgery 1989; 124(2): 253-5 4 Berg WA et al.: Cystic lesions of the breast: sonographic-pathologic correlation. Radiol 2003; 227(1): 183-91 5 D’Orsi CJ: 2013 ACR BI-RADS atlas: breast imaging reporting and data system. American College of Radiology 2014. https://books.google.at/books?id=nhWSjwEACAAJ
Das könnte Sie auch interessieren:
Verbesserung der Ästhetik ohne onkologische Kompromisse
In der Brustchirurgie existiert eine Vielzahl an unterschiedlich komplexen onkoplastischen Operationstechniken mit verschiedenen Klassifikationen. Die kritische Selektion der Patient: ...
Neue Erkenntnisse zur Kolporrhaphie
Die Kolporrhaphie ist eines der etabliertesten chirurgischen Verfahren in der Beckenbodenchirurgie, welches vorrangig zur Behandlung von Beckenorganprolaps (BOP) eingesetzt wird. Die ...
Die Kunst ärztlicher Kommunikation bei Breaking Bad News
Worte haben entscheidende Wirkungen. In Gesprächen mit Patient:innen und Angehörigen gibt es meist eine hohe Erwartungshaltung gegenüber der Ärztin, dem Arzt. Vor allem die Übermittlung ...