Infektiologische Biomarker in der Hämatologie – was ist für wen sinnvoll?
Autorin:
Univ.-Prof. Dr. Cornelia Lass-Flörl
Institut für Hygiene und Medizinische Mikrobiologie
Medizinische Universität Innsbruck
E-Mail: cornelia.lass-floerl@i-med.ac.at
Die Bestimmung verschiedener Biomarker spielt in der Infektionsabklärung invasiver Mykosen eine wichtige Rolle. Die Bewertung eines positiven Biomarkers bei Pilzinfektionen hängt von der klinischen Prätestwahrscheinlichkeit, der Spezifität/Sensitivität des Tests, dem klinischen Bild und der Dynamik der Biomarkerwerte ab. Ein positives Ergebnis sollte immer im Kontext anderer Befunde interpretiert werden, um eine invasive Pilzinfektion sicher zu diagnostizieren oder auszuschließen.
Keypoints
-
Der multimodale Ansatz: Ein positiver Biomarker sollte niemals alleinstehend bewertet werden. Stattdessen kombiniert man klinische Symptome und Risikofaktoren (z.B. Fieber bei neutropenischen Patient:innen), Bildgebung (z.B. Thorax-CT bei Verdacht auf pulmonale Aspergillose) und mykologische Methoden (z.B. Kulturen und Mikroskopie).
-
Die Kombination von Biomarkern kann eine sinnvolle Ergänzung darstellen.
-
Ergebnisse von Biomarkern sollten nicht automatisch gleichgesetzt werden mit Ergebnissen einer positiven Kultur oder einer positiven Mikroskopie; hier muss auf eine unterschiedliche Wertigkeit verwiesen werden.
Invasive Pilzinfektionen sind eine wesentliche Ursache für Morbidität und Letalität bei Patient:innen mit Abwehrschwäche.1 Die wichtigsten und häufigsten Pathogene in Europa sind Aspergillus- und Candida-Spezies. Zunehmend werden aber auch andere Vertreter wie Mucorales-, Trichosporon- und Fusarium-Spezies nachgewiesen.
Während oberflächliche Pilzinfektionen oft Blickdiagnosen sind, ist die sichere Diagnose invasiver Pilzinfektionen schwierig. Sie gelingt nur mit einer Kombination aus klinischer Befunderhebung, radiologischer Bildgebung und mikrobiologischen Nachweisverfahren.2 Letztere umfassen die Mikroskopie, Kulturverfahren sowie immunologische und molekularbiologische Ansätze. Fester Bestandteil ist der Einsatz diagnostischer Biomarker, der das Ziel hat, Mikroben zu identifizieren bzw. den Status einer Immunantwort abzuklären. Damit können Infektionen indirekt diagnostiziert werden. Die Verfahren können erregerspezifisch sein.
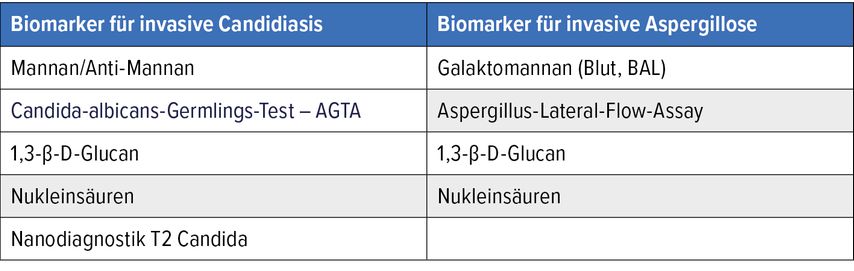
Der Unterschied zwischen diagnostischen, prognostischen und therapierelevanten Biomarkern liegt in ihrer Funktion und ihrem Zweck in der medizinischen Praxis.3 Tabelle 1 gibt einen Überblick über die auf dem Markt befindlichen kommerziell erhältlichen Biomarker für pilzliche Pathogene.
Die verschiedenenpilzlichen Biomarker
Galaktomannan
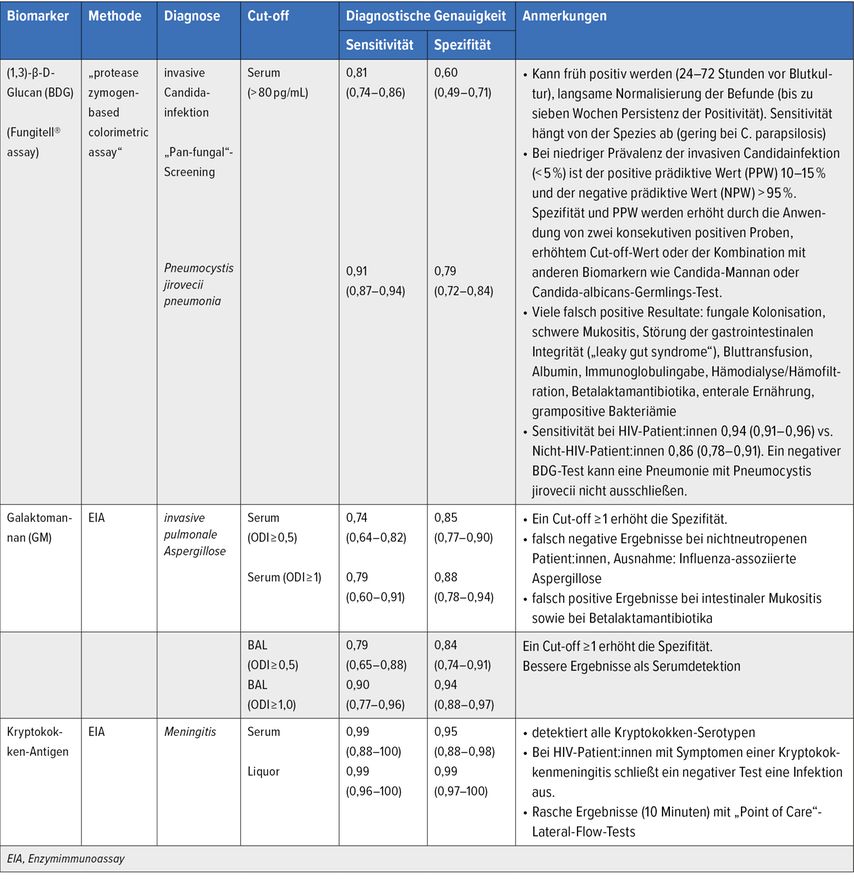
Galaktomannan (GM) ist ein Zellwandbestandteil von Aspergillus fumigatus und dient der Diagnose der invasiven Aspergillose. Häufig wird dieser Test auch „Aspergillus-Antigen-Test“ genannt.4 Das Vorhandensein von GM korreliert mit dem invasiven Wachstum von Aspergillus, Kreuzreaktionen mit anderen Pilzen wurden beschrieben. Das kinetische Profil von GM im Serum ist komplex und hängt von mehreren Faktoren (z.B. dem Vorhandensein und der Funktion von Neutrophilen) sowie von der Exposition gegenüber Antimykotika mit Aktivität gegen Aspergillus-Spezies ab. Dies erklärt unter anderem die variable Leistung von GM in unterschiedlichen Patient:innengruppen.2
1,3-β-D-Glukan
1,3-β-D-Glukan (BDG) ist ein wichtiger Zellwandbaustein vieler humanpathogener Pilze, daher kann BDG bei einer Vielzahl von Pilzinfektionen im Serum nachgewiesen werden (Candida, Aspergillus, Pneumocystis). Man spricht von einem pan-fungalen Marker. Bei Infektionen durch Mucorales und Cryptococcus fällt der Test in der Regel negativ aus.2
Kryptokokken-Antigen
Das Kryptokokken-Antigen (CrAg) ist ein etablierter diagnostischer Biomarker, der sensitiver als die Kultur ist; der Lateral-Flow-Assay (CrAg-LFA) ist am sensitivsten. Sequenzielle CrAg-Titer aus dem Liquor sollten nicht zur Überwachung des Therapieansprechens eingesetzt werden.2
Vor- und Nachteile molekular-biologischer Verfahren
Zahlreiche molekularbiologische Verfahren sind Bestandteil labordiagnostischer Untersuchungen, sollten aber immer in Kombination mit Mikroskopie und Kultur durchgeführt werden.
Die Vorteile molekularer Tests umfassen im Allgemeinen eine hohe Sensitivität und Spezifität, die Verwendung von nichtinvasiven Proben, die Detektion resistenzassoziierter Mutationen und eine schnelle Bearbeitungszeit.3,4 Die Nachteile spiegeln sich in hohen Kosten wider sowie in der Problematik, bei nichtsterilen Proben zwischen Infektion und Kolonisation zu unterscheiden.
In der Praxis wird in panfungales Breitspektrum oder pathogenspezifische Targets unterteilt. Candida-Spezies sind Bestandteil einiger am Markt befindlicher Sepsistests („panel testing“), die Datenlage ist aber nicht ganz eindeutig. Für Aspergillus belegen klinische Studien eindeutig einen Nutzen im Einsatz molekularbiologscher Diagnosemethoden.4
Metagenomische Sequenzierungen
Zunehmendes Interesse besteht an metagenomischen Sequenzierungen (metagenomische NGS-Plattform, z.B. Karius-Test), die zellfreie DNA (cfDNA) aus Plasma detektieren, um über 1250 menschliche Krankheitserreger, einschließlich Bakterien, Pilze und DNA-Viren, zu identifizieren.4 Der Begriff agnostischer Test kommt hier zur Anwendung, da keine gezielte Information spezifischer Erreger erforderlich ist.
cfDNA-Sequenzierung wurde in einer retrospektiven Studie an 114 Patient:innen untersucht, die hämatopoetische Stammzelltransplantate empfangen und eine pilzliche Pneumonie entwickelt hatten (n=75). Dabei wurden Serumproben analysiert, die innerhalb von 14 Tagen nach der Diagnose einer invasiven Schimmelpilzinfektion abgenommen wurden. Die cfDNA-Sequenzierung identifizierte Schimmelpilze bei 38 Patient:innen (Sensitivität: 51%; 95% CI: 39%–62%).
Wenn die Tests auf Proben beschränkt wurden, die innerhalb von drei Tagen nach der Diagnose einer invasiven Schimmelpilzinfektion gesammelt wurden, verbesserte sich die Sensitivität auf 61%. Die Spezifität lag bei 95% (95% CI: 82–100%). Die Rolle der cfDNA-Sequenzierung aus Plasma zur Diagnose von Pilzpneumonien bei immungeschwächten Patient:innen, bei denen routinemäßige mikrobiologische Diagnosetests wie BAL-Pilzkultur, GM und PCR negativ sind, bleibt ungewiss.4
Der Einsatz von Biomarkern ist ein wichtiges Add-on zur konventionellen Diagnostik und kann den Verdacht einer Mykose erhärten oder entkräften. Der gesicherte Nachweis einer Pilzinfektion läuft über die positive Mikroskopie bzw. Kultur aus einer sterilen Körperregion (z.B. Biopsie). Alle anderen positiven Befunde subsumieren das wahrscheinliche oder mögliche Vorliegen einer Infektion.
Tab. 2: Biomarkerdiagnostik bei invasiven Pilzinfektionen (modifiziert nach Maertens J et al.1, Pòvoa P et al.3, Lass-Förl C4)
Biomarker in der täglichen Praxis: Vor- und Nachteile
Jedes diagnostische Verfahren beinhaltet ein Restrisiko falscher Ergebnisse, die sowohl falsch positiv als auch falsch negativ sein können.5 Bei der Auswahl eines Testsystems wird daher nicht nur der finanzielle Aspekt, sondern auch die zu erwartende „Fehlerquote“ berücksichtigt.
Zur Beurteilung von Labortests ist die Validität von Tests (Fähigkeit, zwischen dem Vorliegen und dem Nichtvorliegen einer Erkrankung zu unterscheiden) wesentlich. Die Testvalidität beinhaltet zwei wichtige Komponenten: die Sensitivität (Fähigkeit, Erkrankungen anzuzeigen) und die Spezifität (Fähigkeit, Nichtvorliegen der Erkrankung aufzuzeigen). Hohe Sensitivitäten und Spezifitäten vorhandener Labortests verführen derzeit zusammen mit vergleichsweise niedrigen Preisen der Einzeltestung zu einem breiten, weitgehend unkritischen Anforderungsverhalten.5
Dabei ist es wichtig, folgende Grundpfeiler beim Einsatz von diagnostischen Tests zu berücksichtigen:
-
Sensitivität und Spezifität sind „testspezifische Eigenschaften“, die die Untersucher:innen nicht aktiv beeinflussen können. Dies gilt unter der Voraussetzung korrekter Testdurchführung und -befundung, einschließlich Prä- und Postanalytik.5,6
-
Dagegen ist der Aussagewert eines positiven Testergebnisses, der positiv prädiktive Wert (PPW), kritisch von der Prävalenz der Erkrankung im Testkollektiv abhängig – und diese können Ärzt:innen (Untersucher:innen) beeinflussen. Prädiktive Werte (Wahrscheinlichkeit) sind abhängig von der Prävalenz (Häufigkeit) der Erkrankung.5,6
-
Der positive prädiktive Wert eines labormedizinischen Testergebnisses ist direkt von der Prävalenz der Erkrankung im Untersuchungskollektiv abhängig.
-
Der klinische Aussagewert von labormedizinischen Testergebnissen ist daher von einer klaren Indikationsstellung abhängig.
-
Ergebnisse von nichtindizierten Anforderungen sind ohne fundierte Datenbasis zur Prävalenz der Erkrankung klinisch unbrauchbar und sollten daher nicht angefordert werden.
-
Tests sollten grundsätzlich nur indiziert angefordert werden, denn nur dann ist ein Testergebnis auch klinisch verwertbar.
Literatur:
1 Maertens J et al.: Breaking the mould: challenging the status quo of clinical trial response definitions for invasive fungal diseases – a debate. J Antimicrob Chemother 2024; 79(8): 1786-93 2 Lass-Flörl C et al.: Serology anno 2021 – fungal infections: from invasive to chronic. Clin Microbiol Infect 2021; 27(9): 1230-41 3 Póvoa P et al.: How to use biomarkers of infection or sepsis at the bedside: guide to clinicians. Intensive Care Med 2023; 49(2): 142-53 4 Lass-Flörl C: Diagnostic approaches for invasive mycoses: what’s hot? Dtsch Med Wochenschr 2024; 149(10): 551-9 5 Suling A, Großhennig A: Statistische Problemstellen in Publikationen von klinischen Studien erkennen – eine Lesehilfe. Teil 33 der Serie zur Bewertung wissenschaftlicher Publikationen. Dtsch Ärztebl Int 2024; 121: 634-8 6 Lass-Flörl C et al.: Invasive candidiasis. Nat Rev Dis Primers 2024; 10(1): 20
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Pract. med. Alexander Meisel
Pract. med. Alexander Meisel im Interview
AxSpA: Kommunikation ist essenziell für gute Diagnosestellung und Therapie
Die axiale Spondyloarthritis (axSpA) präsentiert sich klinisch heterogen. Es treten sowohl muskuloskelettale Manifestationen auf als auch extramuskuloskelettale wie Uveitis, Psoriasis ...