Quelles sont les lipoprotéines à l’origine de l’athérosclérose et autres maladies?
Compte-rendu:
Dre méd. Christine Adderson-Kisser, MPH
Journaliste médicale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dans la pratique clinique quotidienne et dans les scores de diagnostic, de nombreux facteurs sont utilisés pour déterminer le risque d’infarctus du myocarde, de diabète ou d’accident vasculaire cérébral. Les lipoprotéines trouvent également leur application ici. Mais savons-nous s’il existe un lien de causalité entre le facteur et la maladie, ou si nous mesurons peut-être un facteur perturbateur qui n’est pas impliqué dans la pathogenèse? Le Pr Dr méd. Arnold von Eckardstein a présenté l’état actuel des preuves dans sa présentation lors du cours du GSLA «Lipidologie clinique» à Zurich.
Keypoints
-
La causalité du C-LDL dans l’athérosclérose est bien établie scientifiquement.
-
Pour les triglycérides, des études génétiques montrent une corrélation avec le développement de l’athérosclérose, mais les résultats des études interventionnelles sont incohérents.
-
En ce qui concerne la lipoprotéine(a), des études génétiques et des modèles animaux fournissent de fortes indications sur le fait qu’elle favorise l’athérosclérose.
-
Le C-HDL n’est pas un facteur de risque causal, de sorte que les traitements visant à augmenter le C-HDL ne sont pas indiqués, d’autant plus qu’un taux élevé de C-HDL est associé à une mortalité accrue.
Une observation dans une étude épidémiologique ne prouve aucun lien de causalité, même si elle est faite sur des milliers de personnes, a déclaré le Pr Dr méd. Arnold von Eckardstein, de l’Institut de chimie clinique de l’Hôpital universitaire de Zurich, en rappelant les règles d’évaluation de la causalité. La méthode de référence pour vérifier la causalité est l’étude interventionnelle randomisée contrôlée (ERC) en aveugle. Les «confounders», soit les facteurs de confusion susceptibles d’influencer les résultats, sont dans ce cas répartis uniformément entre les groupes d’étude par randomisation et donc éliminés dans une large mesure. La potentielle causalité inversée dans les études observationnelles, c’est-à-dire que ce n’est pas la modification d’un facteur qui provoque la maladie, mais la maladie qui modifie le facteur, est également éliminée grâce à la conception des ERC.
«Si l’on constate un facteur de risque pour une maladie dans des études observationnelles, il est essentiel de s’assurer au préalable qu’il existe bien un lien de causalité pour le développement de traitements médicamenteux destinés à influencer favorablement ce facteur. Alors que l’on a longtemps tenté de vérifier la plausibilité biologique par des essais sur des cultures cellulaires et des modèles animaux, la stratégie de la randomisation mendélienne s’impose de plus en plus aujourd’hui. Le principe de base réside dans la répartition aléatoire par l’hérédité d’allèles parentaux codant pour un facteur de risque ou de protection donné. D’un point de vue génétique, les mutations dans ces allèles peuvent ainsi avoir un lien de causalité avec un risque accru ou réduit de développer une maladie»,1 a expliqué l’expert.
À titre d’exemple, A. von Eckardstein a cité quelques marqueurs qui ont été associés à un risque accru d’infarctus du myocarde dans des études observationnelles. «Seule l’étude des variants génétiques de ces facteurs portant sur leur influence sur le risque d’infarctus du myocarde a permis de déterminer si l’effet était réellement causal ou non. Un variant génétique entraîne à la fois une modification du facteur qu’il code et une modification du risque de maladie. Des liens de causalité génétiques avec l’athérosclérose ont ainsi pu être démontrés pour le cholestérol LDL (C-LDL), les triglycérides, la lipoprotéine(a) (LP[a]) et même l’indice de masse corporelle. En revanche, les études de randomisation mendélienne n’ont pas permis d’établir de lien de causalité génétique pour le cholestérol HDL (C-HDL), ni pour la protéine C-réactive (CRP), l’homocystéine, le fibrinogène ou la phospholipase A2 associée aux lipoprotéines (Lp-PLA2). La génétique nous aide donc à répondre à la question du lien de causalité entre les facteurs et les maladies – et, en fin de compte, à déterminer si un facteur donné constitue un point de départ utile pour un traitement»2, a déclaré l’expert.
Mais qu’en est-il des preuves appuyant ou rejetant un lien de causalité entre différentes lipoprotéines et le risque d’athérosclérose et autres maladies? Et quelles connaissances sur les risques de maladie liés à la correction des facteurs de risque pouvons-nous acquérir grâce aux études génétiques?
C-LDL: bien étudié, généralement responsable
C-LDL et risque d’infarctus du myocarde
Le C-LDL, tout comme le non-C-HDL et l’ApoB, présente une relation positive avec le risque d’infarctus du myocarde dans les études observationnelles: plus le taux de C-LDL est élevé, plus le risque est accru. Celui-ci a pu être abaissé dans des ECR par des agents visant à diminuer le LDL (statines, inhibiteurs de la PCSK9, ézétimibe, acide bempédoïque). Les études génétiques ont également montré que les variants génétiques qui augmentent ou diminuent le C-LDL présentent un lien très étroit avec le risque d’infarctus du myocarde; en raison de la longue durée médiane d’observation de 52 ans, ce lien est même beaucoup plus fort que dans les études observationnelles et les ECR avec une période de suivi de 12 et 5 ans. «Même dans les modèles animaux, qui sont un critère important dans la vérification de la plausibilité, on constate que l’athérosclérose ne se développe que si l’on induit une hypercholestérolémie»3, a ajouté l’intervenant.
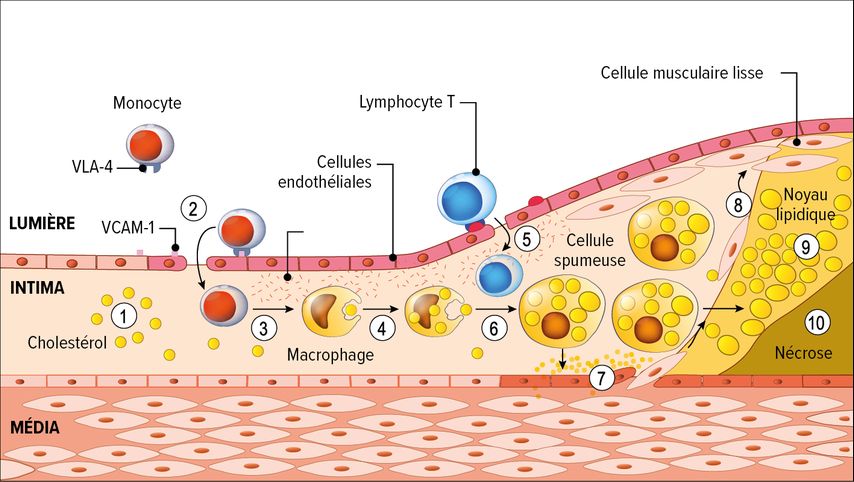
Un taux élevé de C-LDL est donc une condition nécessaire, mais pas suffisante, pour le développement de l’athérosclérose. Cela s’explique par le catabolisme des LDL: en temps normal, les LDL sont absorbées et éliminées à 95% par les récepteurs des LDL (LDLR) du foie, et seule une toute petite partie est éliminée par d’autres cellules, principalement des macrophages, via des récepteurs «scavenger». Si la voie hépatique est perturbée, par exemple par des mutations dans le gène du LDLR, comme dans le cas de l’hypercholestérolémie familiale, ou par la régulation à la baisse du LDLR liée à l’alimentation, il en résulte une hypercholestérolémie et donc une absorption accrue de LDL modifiées par des enzymes ou oxydation dans les macrophages. «Comme les récepteurs ‹scavenger› responsables de l’absorption ne sont jamais régulés à la baisse, contrairement au LDLR, et qu’ils sont donc quasiment toujours actifs, les macrophages absorbent les LDL de manière quasiment illimitée», a déclaré A. von Eckardstein. Le développement de l’athérosclérose fonctionne également de cette manière (Fig. 1): les LDL, conjointement avec des facteurs tels qu’une pression artérielle élevée ou une hyperglycémie, activent l’endothélium, ce qui entraîne l’absorption des LDL par la paroi artérielle (1) et la migration des monocytes dans l’intima (2), où ils sont transformés en macrophages (3). Par l’intermédiaire des récepteurs «scavenger», ils absorbent les LDL oxydées (4) et deviennent des cellules spumeuses (6) qui provoquent une réaction inflammatoire massive produisant des cytokines et des facteurs de croissance. Cela entraîne la poursuite de la migration des leucocytes (5) ainsi que la prolifération des cellules musculaires lisses de la média, qui migrent vers l’intima (7, 8) et s’y transforment en cellules du tissu conjonctif. En formant un capuchon fibreux, elles tentent de recouvrir le foyer inflammatoire. «C’est ce que nous voyons ensuite à l’imagerie sous forme de plaque ou de capuchon fibreux, de plus en plus souvent avec des calcifications», a expliqué A. von Eckardstein. «Mais cela ne suffit pas pour provoquer un infarctus du myocarde. Ce n’est que lorsque la plaque est dissoute par les protéases des macrophages et finit par se déchirer que le contact du sang avec le tissu conjonctif entraîne l’activation des thrombocytes et du facteur tissulaire, et donc la formation d’un thrombus. Cela conduit alors à une occlusion vasculaire et donc cliniquement à un infarctus. Les LDL participant de manière déterminante, directement ou indirectement, à toutes les étapes de l’athérogenèse, elles sont également considérées, à juste titre, comme le facteur principal.4 On peut pratiquement considérer que la causalité est prouvée, car les ECR, la randomisation mendélienne et les modèles animaux ont donné des résultats cohérents, et l’efficacité d’une réduction du taux de LDL par des médicaments a été systématiquement confirmée», a-t-il ajouté.5
Fig.1: Développement de l’athérosclérose: le C-LDL (1) comme facteur déclencheur des processus dans l’intima vasculaire
C-LDL et risque de diabète
Toute une série d’autres maladies sont également liées au C-LDL. Une relation inverse a été observée concernant le diabète: de faibles taux de LDL augmentent le risque de diabète. Des ECR portant sur la réduction du taux de LDL par des statines ont confirmé cette observation. L’incidence du diabète a augmenté de 9% par rapport au placebo et de 12% en cas de réduction intensive par rapport à une réduction modérée du taux de LDL. Cette corrélation n’a pas été observée pour les autres agents visant à diminuer le LDL, l’ézétimibe, les inhibiteurs de la PCSK9 et l’acide bempédoïque.6 «Une explication pourrait être que l’ézétimibe et les inhibiteurs de la PCSK9 ont toujours été ajoutés aux statines, c’est-à-dire que les personnes atteintes de prédiabète l’avaient peut-être déjà développé sous traitement par une statine. Une autre explication réside dans le mécanisme pathologique des traitements médicamenteux: les statines régulent le LDLR à la hausse, et ce non seulement dans les cellules hépatiques, mais aussi dans les cellules du corps entier. C’est le cas des cellules bêta du pancréas, dans lesquelles l’absorption accrue de LDL entraîne une augmentation du taux de cholestérol, ce qui perturbe la sécrétion d’insuline. Chez les personnes en bonne santé, cela n’a pas d’effet clinique majeur, mais cela peut être suffisant pour provoquer un diabète manifeste chez celles souffrant d’un syndrome métabolique et d’une résistance déjà accrue à l’insuline», a déclaré A. von Eckardstein. «Les inhibiteurs de la PCSK9 n’agissent en revanche que sur les cellules hépatiques, indirectement aussi l’ézétimibe via l’inhibition de l’absorption du cholestérol dans l’intestin – les cellules bêta du pancréas ne sont pas influencées.7 Dans le cas de l’acide bempédoïque, l’absence d’effet sur le risque de diabète peut être due au fait qu’il s’agit d’une prodrogue qui doit d’abord être activée par une enzyme, et que les cellules bêta ne disposent pas de cette enzyme», a-t-il ajouté.
Les résultats des études génétiques et des modèles animaux suggèrent un lien de causalité entre le taux de LDL et le diabète, qu’il ne faut pas nier selon l’expert. Néanmoins, le rapport bénéfice-risque doit toujours être pris en compte: une étude génétique a montré qu’une augmentation expérimentale d’un écart-type du taux de LDL réduisait le risque de diabète de 10%, mais augmentait en même temps le risque cardiovasculaire de 60%. Pour A. von Eckardstein, le bénéfice de la réduction du taux de C-LDL l’emporte donc clairement sur l’athérosclérose et ses complications.8
C-LDL et risque d’accident vasculaire cérébral
Une relation inverse a également été observée en ce qui concerne l’AVC hémorragique. Ici aussi, les études interventionnelles et les études génétiques indiquent fortement un lien de causalité. «Les données d’études montrent clairement que plus le C-LDL augmente, plus le risque d’AVC ischémique augmente et celui d’AVC hémorragique diminue. Cela ne semble pas positif au premier abord, mais ne constitue pas une raison suffisante pour s’opposer à une réduction du taux de LDL par des médicaments. En effet, si l’on considère la rareté de l’AVC hémorragique, les bénéfices de la réduction du taux de LDL et donc de la prévention des AVC ischémiques dépassent largement le risque d’AVC hémorragique existant à des taux de LDL plus faibles»,9 a fait remarquer l’intervenant.
C-LDL et risque de stéatose hépatique ou de calculs biliaires
En ce qui concerne le critère d’évaluation clinique de la stéatose hépatique, aucune augmentation du risque n’a été observée sur le plan épidémiologique en fonction du taux de LDL, mais elle a été observée sous certains médicaments (mipomersen, lomatipide). Par la suite, des études mendéliennes ont montré que cela dépendait des gènes. Seuls les variants qui réduisent la production de lipoprotéines contenant de l’ApoB augmentent le risque de stéatose hépatique, et non ceux qui augmentent le catabolisme des lipoprotéines contenant de l’ApoB. Dans les ERC, le traitement par l’ézétimibe a augmenté le risque de cholélithiase. Les variants génétiques qui, comme l’ézitimibe, inhibent l’absorption du cholestérol dans l’intestin, sont également associés à un risque accru de calculs biliaires.
C-LDL et risque de cancer
En ce qui concerne les cancers, les études observationnelles ont montré un risque accru pour les personnes présentant un faible taux de LDL, mais ni les études interventionnelles et génétiques ni les modèles animaux n’ont permis d’établir un lien de causalité. «On suppose que le faible taux de LDL n’est pas la cause du cancer, mais une conséquence de celui-ci», selon l’interprétation d’A. von Eckardstein.
C-LDL et risque de démence/mortalité
En ce qui concerne la démence, il n’y a aucune preuve d’un lien avec les taux de LDL, alors qu’une relation parabolique (en forme de J) a été observée pour la mortalité: une mortalité élevée a été constatée aussi bien en cas de taux de LDL faibles qu’élevés. Les résultats des études interventionnelles et génétiques indiquent un lien de causalité uniquement pour les taux de LDL élevés, mais pas pour les taux faibles, et confirment l’effet protecteur d’une réduction du taux de LDL dans ce domaine.
Triglycérides: facteur déclencheur avéré de l’athérosclérose et autres maladies?
«En ce qui concerne les triglycérides, des études épidémiologiques observationnelles ont également montré des liens avec l’infarctus du myocarde, le diabète, la stéatose hépatique, la mortalité ainsi que la pancréatite aiguë», a expliqué A. von Eckardstein. «S’agissant de la causalité, nos connaissances sont toutefois encore loin d’être aussi avancées que pour le C-LDL. Dans le cas de l’athérosclérose, si les résultats des études génétiques indiquent une causalité,10 les études interventionnelles visant à réduire les triglycérides – que ce soit par la prise de fibrates, d’acides gras oméga-3 ou de niacine – ont donné des résultats très incohérents. Nous trouvons une explication possible dans les modèles animaux, car nous avons observé que l’effet potentiel sur le développement de l’athérosclérose dépend beaucoup du gène que l’on modifie», a-t-il souligné Ce concept est actuellement testé avec des médicaments qui inhibent la production de l’ApoC3 ou de l’angiopoïétine-like 3 (ANGPTL3) et réduisent ainsi les triglycérides.
Dans le cas de la pancréatite aiguë, la causalité a été démontrée dans des études génétiques, en particulier dans l’exemple du syndrome de chylomicronémie familiale.10 Il n’existe cependant aucune donnée issue d’études interventionnelles ou de modèles animaux à ce sujet. «À mon avis, l’hypertriglycéridémie est un facteur de risque sous-estimé pour le développement d’une pancréatite aiguë – probablement l’un des plus importants avec l’alcool et les maladies des voies biliaires», a-t-il ajouté.
Les études génétiques suggèrent une causalité, mais il n’existe aucune donnée issue d’études interventionnelles ou de modèles animaux. En ce qui concerne la stéatose hépatique, il n’existe pas non plus d’études interventionnelles; dans les études génétiques et les modèles animaux, le lien dépend des gènes.
Lipoprotéine(a): fortes indications fournies par les études génétiques, manque de données d’ERC
Des taux élevés de lipoprotéine(a) (Lp[a]) augmentent également le risque de maladies athérosclérotiques. Les études génétiques chez l’homme et les modèles animaux génétiques indiquent toutes deux une causalité. Des études sont en cours sur l’efficacité de la réduction de la Lp(a) dans la prévention de l’athérosclérose. Les risques de sténose aortique, d’insuffisance cardiaque et de mortalité concomitante sont également plus élevés en cas de Lp(a) élevée. Ces relations sont causales d’un point de vue génétique.
Le risque de thrombose veineuse, pour laquelle la Lp(a) est considérée comme un facteur de risque chez les enfants, n’a pas pu être corrélé avec les taux de Lp(a) chez les adultes, que ce soit dans le cadre d’études épidémiologiques ou génétiques. Là encore, il n’existe aucune donnée issue d’études interventionnelles ou de modèles animaux.
En ce qui concerne le risque de diabète, des études épidémiologiques ont observé une relation inverse avec la Lp(a) – des taux élevés avaient un effet protecteur. Cela a également été démontré génétiquement: Les variants du gène LPA, qui augmentaient le risque d’athérosclérose, avaient un effet protecteur en ce qui concerne le diabète.
«Dans les études d’association pangénomiques, qui identifient les principaux gènes prédisposant à l’infarctus du myocarde, le gène LPA occupe la deuxième place, et même la première place en cas de sténose aortique», a ajouté l’intervenant.
Les études de randomisation mendélienne ont également indiqué un lien de causalité avec l’AVC ischémique, mais pas avec l’AVC hémorragique ni avec les démences.11
«La Lp(a) est une molécule de type LDL qui partage avec elle des mécanismes très similaires et a donc un effet pro-athérogène. De plus, l’Apo(a) lui confère probablement des propriétés inhibitrices de la fibrinolyse, ce qui lui octroie un effet prothrombotique supplémentaire. De plus, les phospholipides oxydés se trouvent pour la plupart dans la Lp(a), ce qui déclenche les effets pro-inflammatoires»12, a expliqué l’intervenant concernant le mécanisme pathologique possible. Sur le plan thérapeutique, des traitements par ARN injectables (oligonucléotides antisens et petits ARN interférents [siRNA]) font actuellement l’objet d’études cliniques et pourraient réduire la Lp(a) de 80 à 90%, de même que des petites molécules orales qui réduisent également la Lp(a).13
Le C-HDL est-il vraiment toujours «bon»?
«Le C-HDL a une relation inverse avec l’infarctus du myocarde, mais seulement jusqu’à un niveau intermédiaire. Des taux élevés de C-HDL n’impliquent pas une réduction du risque. Ils augmentent même le risque de mortalité. Dans les études cliniques, l’augmentation du C-HDL n’a pas permis de prévenir les événements cardiovasculaires», a expliqué A. von Eckardstein. Cela pourrait être dû aux médicaments utilisés: les inhibiteurs de la CETP administrés ici influencent très fortement l’augmentation du HDL, ce qui pourrait avoir entraîné des taux situés dans la zone de risque élevé de la courbe parabolique du HDL, en particulier chez les personnes qui, au début de l’étude, se situaient déjà dans la zone de risque modéré ou faible du HDL. Les études génétiques n’ont en outre pas indiqué de lien de causalité. Dans les modèles animaux, les liens dépendaient des gènes.
«Nous avons en tout cas pu observer très clairement sur le plan épidémiologique que le risque d’infarctus du myocarde ne diminue plus à partir d’un certain taux de C-HDL, mais que la mortalité augmente en revanche. L’induction de l’augmentation la plus forte possible du HDL par des médicaments, comme cela a été fait par des inhibiteurs de la CETP dans des études, ne peut donc pas être l’objectif. Les fibrates et l’acide nicotinique ne sont pas non plus des médicaments appropriés, car ils ont plutôt peu d’influence sur le C-HDL. Ils ont un effet plus important sur les triglycérides», a-t-il expliqué.
Il existe également un lien observable entre les HDL et diverses maladies. Ainsi, les personnes ayant un faible taux de HDL présentent un risque accru de diabète. Le lien s’est avéré causal dans les études interventionnelles et génétiques ainsi que dans les modèles animaux. C’est pourquoi le HDL a été intégré comme paramètre dans la quasi-totalité des scores de risque de diabète.
La relation entre le C-HDL et les maladies rénales chroniques ainsi que les infections est parabolique. Les données issues d’études génétiques et de modèles animaux indiquent un lien de causalité. Aucune étude interventionnelle n’a été menée dans ce domaine à ce jour. Une relation inverse entre le C-HDL et certaines maladies auto-immunes, telles que les maladies inflammatoires chroniques de l’intestin, a également été observée et des données issues de modèles animaux suggèrent un lien de causalité possible. Aucune étude interventionnelle ni étude génétique n’a toutefois été menée dans ce domaine.
Le risque accru de dégénérescence maculaire liée à l’âge chez les personnes ayant un taux élevé de C-HDL montre également que les taux élevés de HDL n’ont pas toujours un effet protecteur. Des études génétiques et des modèles animaux indiquent également un lien de causalité. En ce qui concerne le risque de maladie d’Alzheimer, une relation parabolique a de nouveau été observée, pour laquelle les études génétiques ont fourni des données hétérogènes. Les résultats obtenus sur des modèles animaux rendent cependant un lien de causalité plausible entre un faible taux de C-HDL et le risque de démence.14
Pour conclure, A. von Eckardstein a donné plusieurs explications possibles à l’échec des interventions sur le C-HDL dans la prévention et le traitement cardiovasculaire: outre une éventuelle absence de lien de causalité, une causalité inversée est également envisageable. Cela signifie que les faibles taux de C-HDL pourraient être la conséquence de certaines maladies et non l’inverse. Il serait également concevable que le C-HDL ne soit qu’un «spectateur» non impliqué sur le plan physiopathologique, abaissé quasiment en marge par d’autres facteurs entraînant un risque accru d’athérosclérose. «Avec la mesure du C-HDL, il est probable que nous nous concentrions tout simplement sur le mauvais biomarqueur. Il existe en effet de nombreuses sous-classes de HDL, qui contiennent à leur tour des centaines de protéines et de lipides. Le nombre de molécules par particule varie toutefois fortement: si une particule HDL contient environ 1000 molécules de cholestérol, lequel n’est pas du tout impliqué dans la fonction biologique du HDL, les protéines et les lipides qui déterminent la fonction sont présents beaucoup moins souvent. La sphingosine-1-phosphate, par exemple, n’est présente avec une molécule que dans environ une particule HDL sur dix. L’instrument de mesure ‹cholestérol› que nous utilisons actuellement est donc totalement inadapté pour mesurer l’efficacité biologique du HDL», a-t-il conclu.
Source:
1er cours GSLA en lipidologie clinique, 18 et 19 janvier 2024, Zurich
Littérature:
1 Benn M et al.: Cardiovasc Res 2018; 114: 1192-208 2 McPherson et al.: Circ Res 2016; 118: 564-78 3 Ference BA et al.: Eur Heart J 2017; 38: 2459-72 4 Borén J et al.: Eur Heart J 2020; 41: 2313-30 5 Tokgözoğlu L et al.: Eur Heart J 2022; 43: 3198-208 6 Preiss D et al.: JAMA 2011; 305: 2556-64 7 Perego C et al.: Biochim Biophys Acta Mol Basis Dis 2019; 1865: 2149-56 8 Tragante V et al.: Hum Genet 2016; 135: 453-67 9 Sun L et al.: Nat Med 2019; 25: 569-74 10 Pedersen SB et al.: JAMA Intern Med 2016; 176: 1834-42 11 Larsson SC et al.: Circulation 2020; 141: 1826-8 12 Tsimikas S: J Am Coll Cardiol 2017; 69: 692-711 13 Nicholls SJ et al.: JAMA 2023; 330: 1042-53 14 von Eckardstein A et al.: Dtsch Med Wochenschr 2023; 148: 627-35
Das könnte Sie auch interessieren:
Séquelles cardiopulmonaires à long terme après une infection sévère par le SARS-CoV-2
Le SARS-CoV-2 a entraîné une crise sanitaire mondiale et a posé des défis considérables aux systèmes de santé.1 Si le Covid-19 était initialement considérée comme une maladie ...
Importance de la médecine nucléaire dans le diagnostic de l’amylose cardiaque
Les techniques d’imagerie de médecine nucléaire utilisant des traceurs ayant une affinité pour l’amyloïde se sont imposées comme l’examen de référence non invasif pour le diagnostic de ...
Syndrome post-Covid-19: résultats de l’étude COVIDOM basée sur la population générale
Les lésions pulmonaires résiduelles et l’inflammation des voies respiratoires font partie des séquelles à long terme les plus fréquentes après une forme aiguë légère du Covid-19. L’étude ...