Quelles sont les substances qui pourraient changer la donne?
Compte-rendu:
Mag. Dre méd. Anita Schreiberhuber
Journaliste médicale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Une conférence passionnante sur le thème «New drugs on the horizon» a eu lieu le dernier jour de l’UEG Week de l’United European Gastroenterology à Vienne. La place des substances disponibles à ce jour, leur évolution vers une plus grande sélectivité et une meilleure tolérance, ainsi que les nouvelles substances susceptibles d’élargir et d’enrichir le paysage thérapeutique des maladies inflammatoires chroniques de l’intestin ont été abordées.
Fig. 1: Sreedhar Subramanian a présenté un excellent résumé sur le développement des médicaments contre les MICI dans le cadre de l’UEG Week à Vienne
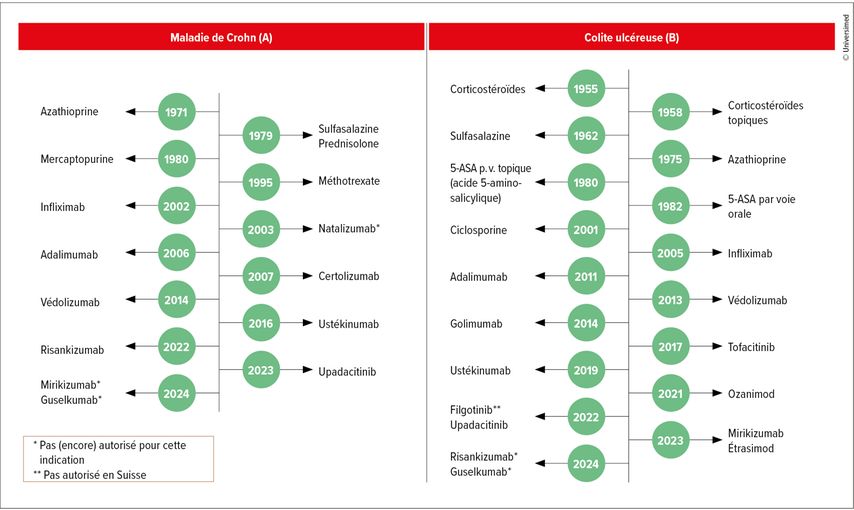
Après une certaine stagnation entre 2017 et 2020, un nombre considérable de substances ont été approuvées au cours des dernières années, en particulier pour la colite ulcéreuse (CU)», a déclaré le Dr Sreedhar Subramanian, Cambridge University Hospitals NHS Foundation Trust, Royaume-Uni, qui a fait le point sur le statu quo et les médicaments en cours de développement dans le traitement des maladies inflammatoires chroniques de l’intestin (MICI). Ce n’est que récemment qu’il a publié, avec ses collègues, une revue qui présente clairement les derniers développements (Fig. 2).1
Fig. 2: Délai d’autorisation des traitements de la maladie de Crohn et de la colite ulcéreuse (modifiée selon Noor NM et al. 2024)1
Anticorps anti-TL1A
«Depuis deux décennies, on essaie d’inhiber la cytokine ‹TNF-like› 1A (TL1A) en tant que structure cible, qui, comme le facteur de nécrose tumorale (TNF), est étudiée dans de nombreuses entités pathologiques», a rapporté S. Subramanian, qui a notamment mis en avant l’anticorps monoclonal tulisokibart comme substance prometteuse dans cette classe. On pense que cette molécule inhibe des voies de signalisation modulatrices cruciales impliquées dans l’inflammation et la fibrose.1
Les résultats des études de phase II sur la maladie de Crohn (MC)2 et la CU3 sont en tout cas encourageants. Dans l’étude sur la CU menée chez des patient·es prétraité·es (dont 50% avaient déjà reçu des traitements avancés), le tulisokibart a été étudié dans deux cohortes. La cohorte 2 comprenait uniquement des patient·es dont le test génétique était positif (n=43) et dont on pensait qu’il·elles étaient plus susceptibles de répondre au traitement, tandis que la cohorte 1 comprenait des patient·es indépendamment de leur statut génétique (n=135). Les sujets ont été randomisés selon un schéma 1:1:1 pour recevoir du tulisokibart (1000 ou 500mg au jour 1 et aux semaines 2, 6 et 10) ou un placebo (PBO). La différence dans le critère d’évaluation primaire de rémission clinique (RC) n’était pas aussi importante que prévu entre la cohorte 1 et le PBO ou la cohorte 2 et le PBO, et était respectivement de 26 par rapport à 1% ainsi que de 32 par rapport à 11%. S. Subramanian a supposé que la différence moins marquée pouvait être due à l’effet placebo dans la cohorte 2. Les résultats concernant les critères d’évaluation secondaires de réponse au PBO étaient également similaires.3 Il reste maintenant à voir quels seront les résultats de l’étude de phase III. Les études de phase III sur la MC (NCT064300801) et la CU (NCT0605 2059) sont déjà en cours.
ABX464 (obéfazimod) – régulation à la hausse du MiR
ABX464 pourrait vraiment changer la donne: cette molécule «first-in-class» administrée par voie orale module de manière sélective la régulation à la hausse du microARN 124 (miR-124) anti-inflammatoire. In vitro, la régulation à la hausse de miR-124 a entraîné une réduction des cytokines pro-inflammatoires, y compris les interleukines (IL) comme l’IL-17, qui sont largement impliquées dans les processus inflammatoires, et agit donc en quelque sorte comme un «frein physiologique à l’inflammation».4 L’étude de phase IIb en double aveugle menée chez des patient·es atteint·es de CU sur 48 semaines a également apporté la preuve du concept, en démontrant non seulement une excellente efficacité, mais aussi une bonne tolérance. Les patient·es atteint·es de CU modérée à sévère et résistant ou ne répondant pas au traitement antérieur ont été randomisé·es selon un schéma 1:1:1:1 pour recevoir trois doses différentes d’ABX464 (100, 50 ou 25mg 1x/j) ou le PBO. Toutes les doses d’ABX464 ont entraîné une amélioration significative de la maladie par rapport au PBO, mesurée par la modification du score de Mayo à la semaine 8 (critère d’évaluation primaire). Les céphalées étaient l’effet indésirable (EI) rapporté le plus fréquemment.5 La substance est actuellement examinée de manière plus approfondie dans l’étude de phase III ABTEXT-1 (NCT05507203) aux doses de 50 et 25mg par rapport au PBO.
Le guselkumab dans la MC et la CU
Contrairement aux nouveaux mécanismes mentionnés jusqu’à présent, le mécanisme d’action du guselkumab6, un anticorps humain dirigé contre l’IL-23, est déjà connu dans les indications déjà autorisées du psoriasis et de l’arthrite psoriasique, mais le guselkumab est également efficace dans la CU et la MC, comme l’ont confirmé les études QUASAR7,8 ainsi que GALAXI-2 et 3.9 Dans l’indication de la CU, la substance a déjà été autorisée par l’agence américaine FDA (Food and Drug Administration) en septembre 202410, l’autorisation de l’EMA (European Medicines Agency) devrait suivre, selon l’expérience, quelques mois plus tard.
Inhibiteurs de JAK et TYK2
Certains inhibiteurs de JAK (iJAK) pour le traitement des MICI sont en cours de développement, et S. Subramanian a particulièrement mis en avant le brepocitinib, car il cible en partie la JAK1, mais surtout la tyrosine kinase2 (TYK2). La «small molecule» est testée avec le ritlécitinib dans l’étude de phase IIa PIZZICATO par rapport au PBO, sur 64 semaines, chez 244 patient·es atteint·es de MC et présentant une réponse inadéquate, une perte de réponse ou une intolérance aux corticostéroïdes, aux immunosuppresseurs ou aux agents biologiques. Une signification statistique a été démontrée pour le brepocitinib par rapport au PBO à la semaine 12 pour les critères d’évaluation suivants: amélioration du CDAI (Crohn’s Disease Activity Index), rémission selon le CDAI (CDAI <150), réponse CDAI-100 et réponse clinique, ainsi que rémission de la diarrhée et des douleurs abdominales. La tolérance dans ce délai très court a également été jugée acceptable.11
«Les inhibiteurs sélectifs de TYK2, déjà utilisés en dermatologie, sont encore plus intéressants. Les iTYK2 présentent un profil de sécurité encore meilleur, car ils interfèrent avec moins de voies de signalisation», a rapporté S. Subramanian, expliquant qu’il existe deux types d’iTYK2: ceux orthostériques et ceux allostériques, et que seuls les derniers sont hautement sélectifs. Il a cité TAK-279 (zasocitinib) comme étant un iTYK2 prometteur. Cet inhibiteur de tyrosine kinase est déjà évalué par rapport au PBO dans le cadre d’études de phase II dans les indications de la MC(NCT06233461) et de la CU (NCT06254950).
Les modulateurs du récepteur de la S1P1 peuvent être hautement sélectifs
Il convient également de faire une distinction claire entre les substances actives de cette classe en fonction du nombre de cibles qu’elles bloquent: alors que l’ozanimod s’attaque au récepteur 5 de la sphingosine-1-phosphate (S1PR5) et à S1PR1, et l’étrasimod à S1PR5, S1PR4 et S1PR1, le tamuzimod est hautement sélectif du S1PR1 et est donc porteur d’espoir, y compris en termes de tolérance. Les premières données de phase II dans l’indication de la CU pour le critère d’évaluation primaire, à savoir le taux de RC à la fin de la phase d’induction à la semaine 13, étaient déjà prometteuses: avec des taux de RC de 28% à la dose de 60mg et de 24% à la dose de 30mg, le tamuzimod était significativement supérieur au PBO, avec 11% (p=0,018 et p=0,014, respectivement).12 Les résultats concernant la phase d’entretien à la semaine 52 étaient tout aussi convaincants: les taux de RC étaient identiques pour les deux doses, avec respectivement 50 et 50 par rapport à 18,2% sous PBO, et les taux de rémission endoscopique s’élevaient à 43,8 (30mg) et 46,1 (60mg) par rapport à 18,2%. La tolérance a également continué d’être jugée bonne.13
Traitements combinés
Les résultats des études DUET-CD et DUET-UC (NCT05242471 et NCT05242484), qui examinent pour la première fois la combinaison de deux anticorps monoclonaux – l’inhibiteur du TNFα golimumab et l’anticorps anti-IL-23 guselkumab – en phase d’induction et d’entretien, sont attendus avec impatience. Dans les deux études, les patient·es sont randomisé·es dans l’un des six groupes suivants: PBO, guselkumab, golimumab, guselkumab+golimumab à forte dose, guselkumab+golimumab à dose modérée ou guselkumab+golimumab à faible dose.
En outre, de nombreux anticorps bispécifiques sont en cours de développement clinique. Par exemple, le lutikizumab, administré par voie intraveineuse et sous-cutanée, est en cours d’évaluation par rapport à l’adalimumab dans une étude de phase II (NCT06257875) chez des patient·es atteint·es de CU.
Conclusion
«Tous les résultats d’études encourageants que nous avons observés n’ont pas conduit à une percée de la substance en question», a déclaré S. Subramanian en attirant l’attention sur le fait que des données de phase II remarquables ne sont pas nécessairement prometteuses pour des données de phase III positives, comme on l’a vu avec l’agoniste du TLR9 cobitolimod. Cette substance a donné des résultats convaincants en termes d’efficacité et de tolérance dans l’étude d’induction de phase II CONDUCT chez des patient·es atteint·es de CU localisée du côté gauche.14 L’étude de phase III CONCLUDE (NCT04985968) a toutefois été interrompue prématurément, car le comité de surveillance et de suivi des données indépendant a conclu que le critère d’évaluation primaire d’un taux de RC significativement plus élevé par rapport au PBO à la semaine 52 ne serait très probablement pas atteint.15
S. Subramanian a déclaré «more of the same» en référence au fait que certaines préparations issues de classes de substances déjà connues, comme d’autres iJAK et modulateurs du récepteur de la S1P1, sont en cours de développement clinique, ce qui, selon lui, se justifie dans la mesure où elles s’accompagnent d’une meilleure tolérance que celles actuellement disponibles.
Source:
Session «What’s new in IBD in 2024?», présentation «New drugs on the horizon», UEG Week, 15 octobre 2024, Vienne
Littérature:
1 Noor NM et al.: Review article: Novel therapies in inflammmatory bowel disease – an update for clinicians. Aliment Pharmacol Ther 2024; 60: 1244-60 2 Feagan BG et al.: DOP87 the anti-TL1A antibody PRA023 demonstrated proof-of-concept in Crohn’s disease: phase 2a APOLLO-CD study results. J Crohns Colitis 2023; 17(1): i162-4 3 Sands BE et al.: Phase 2 trial of anti-TL1A monoclonal antibody tulisokibart for ulcerative colitis. N Engl J Med 2024; 391: 1119-29 4 Apolit C et al.: ABX464 (obefazimod) upregulates miR-124 to reduce proinflammatory markers in inflammatory bowel diseases. Clin Transl Gastroenterol 2023; 14: e00560 5 Vermeire S et al.: ABX464 (obefazimod) for moderate-to-severe, active ulcerative colitis: a phase 2b, double-blind, randomised, placebo-controlled induction trial and 48 week, open-label extension. Lancet Gastroenterol Hepatol 2022; 7: 1024-35 6 https://www.ema.europa.eu/en/medicines/human/EPAR/tremfya ; zuletzt aufgerufen am 3.11.2024 7 Rubin DT et al.: Cumulative response to guselkumab through week 24 of induction in patients with moderately to severely active ulcerative colitis: results from the phase 3 QUASAR induction study. Am J Gastroenterol 2023; doi: 10.14309/01.ajg.0000953252. 60704.b9 8 Rubin DT et al.: The efficacy of guselkumab as maintenance therapy in patients with moderately to severely active ulcerative colitis: results from the phase 3 QUASAR maintenance study. DDW 2024; Abstract #759 9 Panaccione R et al.: Efficacy and safety of guselkumab therapy in patients with moderately to severely active Crohn’s disease: results of the Galaxi 2 & 3 phase 3 studies. ACR 2024; Abstract # 1136 10 https://www.medcentral.com/gastroenterology/fda-expands-guselkumabs-indication-for-induction-and-maintenance-treatment ; dernier accès le 3.11.2024 11 Vermeire S et al.: OP09 Oral ritlecitinib and brepocitinib in patients with moderate to severe active Crohn’s disease: data from the PIZZICATO umbrella study. J Crohns Colitis 2024; 18(1): i16 12 Sands BE et al.: Efficacy and safety of the oral selective sphingosine-1-phosphate-1 receptor modulator VTX002 in moderately to severely active Ulcerative Colitis: results from a randomised, double-blind, placebo-controlled, phase 2 trial. JCC 2024; 18(1): i4-5 13 Danese S et al.: Efficacy and safety of tamuzimod in moderately to severely active ulcerative colitis through 52 weeks: phase 2 long-term extension data. UEG 2024; Abstract #LB14 14Atreya R et al.: Cobitolimod for moderate-to-severe, left-sided ulcerative colitis (CONDUCT): a phase 2b randomised, double-blind, placebo-controlled, dose-ranging induction trial. Lancet Gastroenterol Hepatol 2020; 5: 1063-75 15 https://www.hcplive.com/view/cobitolimod-phase-3-program-discontinued-for-ulcerative-colitis-treatment ; dernier accès le 3.11.2024
Das könnte Sie auch interessieren:
Séquelles cardiopulmonaires à long terme après une infection sévère par le SARS-CoV-2
Le SARS-CoV-2 a entraîné une crise sanitaire mondiale et a posé des défis considérables aux systèmes de santé.1 Si le Covid-19 était initialement considérée comme une maladie ...
Importance de la médecine nucléaire dans le diagnostic de l’amylose cardiaque
Les techniques d’imagerie de médecine nucléaire utilisant des traceurs ayant une affinité pour l’amyloïde se sont imposées comme l’examen de référence non invasif pour le diagnostic de ...
Syndrome post-Covid-19: résultats de l’étude COVIDOM basée sur la population générale
Les lésions pulmonaires résiduelles et l’inflammation des voies respiratoires font partie des séquelles à long terme les plus fréquentes après une forme aiguë légère du Covid-19. L’étude ...