Ein Leitlinien-Update für die rheumatologische Praxis
Bericht: Mag. pharm. Irene Senn, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die aktualisierten Leitlinien spiegeln wichtige Neuerungen in der Diagnose und Therapie der Osteoporose wider. Die österreichische Leitlinie der ÖGKM bietet eine fundierte Grundlage mit praxisnahen Empfehlungen. Ergänzend dazu behandelt die DVO-Leitlinie wichtige Aspekte für ältere, multimorbide Patienten mit rheumatologischen Begleiterkrankungen. Für spezifische Fragestellungen zur Glukokortikoid-induzierten Osteoporose liefert die ECTS-Leitlinie detaillierte Therapieempfehlungen.
Die Österreichische Osteoporose-Leitlinie im Überblick
Die von der Österreichischen Gesellschaft für Knochen- und Mineralstoffwechsel (ÖGKM) erarbeitete Leitlinie zur Osteoporose wurde im Oktober 2024 aktualisiert.1 Sie basiert auf den NOGG-Guidelines (UK) und bietet auf 70 Seiten praxisnahe Empfehlungen für Prävention, Diagnose und Therapie.
Diagnostischer≠therapeutischer Schwellenwert
Osteoporose ist eine systemische Skeletterkrankung, gekennzeichnet durch reduzierte Knochenmasse und gestörte Mikroarchitektur. Die Diagnose stützt sich auf eine DXA-Messung mit einem T-Score von ≤–2,5. „Wichtig ist jedoch, dass dieser diagnostische Schwellenwert nicht zwangsläufig mit dem therapeutischen Schwellenwert gleichzusetzen ist“, betonte Assoc. Prof. OA Priv.-Doz. Dr. Roland Kocijan.
Eine niedrige Knochendichte allein stellt nicht immer eine Therapieindikation dar. Ist jedoch bereits eine osteoporotische Fraktur bei geringem Trauma aufgetreten, muss jedenfalls – unabhängig von der Knochendichte – eine Therapie eingeleitet werden. Denn eine rezente Fraktur ist auch der stärkste Prädiktor für eine zukünftige Fraktur, wie Kocijan betonte. Das Risiko für eine erneute Fraktur steigt in den ersten beiden Jahren um das Zwei- bis Vierfache.
Risikofaktoren abseits des Knochenstoffwechsels
Neu in der Leitlinie ist der Fokus auf Risikofaktoren, die zwar nicht direkt den Knochenstoffwechsel betreffen, jedoch das Sturzrisiko erhöhen. Dazu zählen u.a. Immobilität, ein S.p. apoplektischem Insult und eine chronische Hyponatriämie (≤135mmol/l). „Menschen, die häufig stürzen, sind diejenigen, die auch häufig frakturieren“, erläuterte Kocijan. Ab 65 Jahren sollte daher eine gezielte Sturzanamnese erfolgen, bei über 70-Jährigen zusätzlich einfache physikalische Tests wie der Chair-Rising-Test oder der Timed-up-and-go-Test.
Kalzium, Vitamin D und Proteine
Die Basistherapie der Osteoporose beruht auf einer ausreichenden Zufuhr von Kalzium und Vitamin D. Die Leitlinie empfiehlt eine tägliche Aufnahme von 1000mg Kalzium, vorzugsweise über die Ernährung, sowie 800IE Vitamin D. Angesichts der hohen Prävalenz eines Vitamin-D-Mangels in Österreich wurde die Vitamin-D-Substitution in der aktualisierten Leitlinie bewusst verankert – ein Aspekt, der in vielen anderen osteologischen Empfehlungen bislang fehlt. Ein Vitamin-D-Spiegel von mehr als 50ng/ml wird jedoch nicht empfohlen, da höhere Dosen keine zusätzlichen osteologischen Vorteile bieten.
Erstmals findet auch die Proteinsubstitution Eingang in die Leitlinie. Personen über 65 Jahre wird eine tägliche Proteinzufuhr von 1g/kg Körpergewicht empfohlen. Dies stärkt die Muskelkraft, fördert den Muskelaufbau und wirkt einer Sarkopenie entgegen.
FRAX®-Score zur Risikobewertung
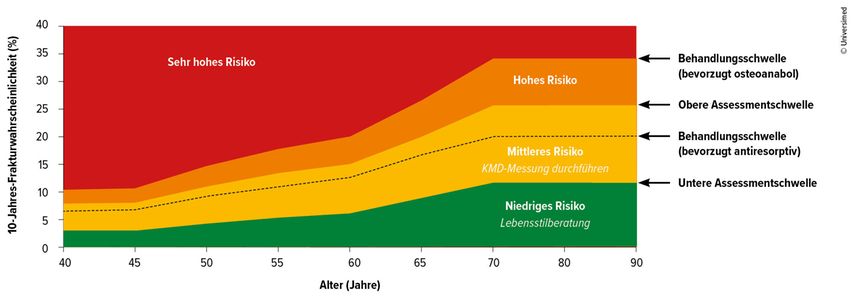
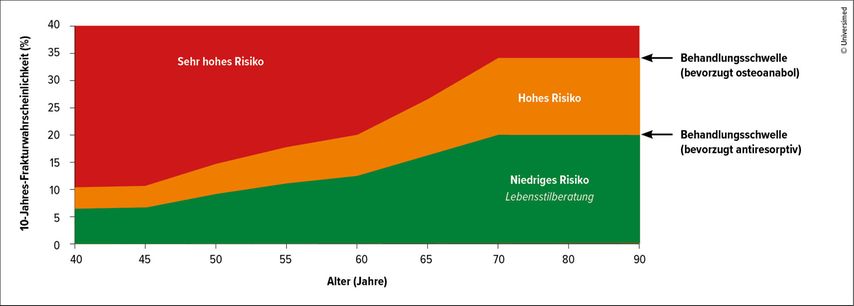
Der FRAX®-Score ist ein bewährtes Instrument zur Abschätzung des 10-Jahres-Frakturrisikos. Er berechnet die Wahrscheinlichkeit für „major osteoporotic fractures“ (MOF, z.B. Wirbelkörper-, Schenkelhals-, Unterarm- oder Oberarmfrakturen) sowie für Hüftfrakturen anhand klinischer Risikofaktoren und – optional – der Knochendichte des Schenkelhalses. Die aktualisierte Leitlinie bringt hier wesentliche Änderungen: Statt fixer Grenzwerte (bisher 20% für MOF und 5% für Hüftfrakturen) erfolgt die Risikobewertung nun altersabhängig über ein gestaffeltes System (Abb. 1).
Der FRAX®-Score wird zunächst ohne Knochendichtemessung berechnet, Ergebnisse im gelben Zwischenbereich erfordern eine zusätzliche DXA-Messung für die Therapieentscheidung (Abb. 1a). Für Patienten mit hohem Risiko (rotes Feld) empfiehlt die Leitlinie eine antiresorptive Therapie. Bei sehr hohem Risiko (dunkelrotes Feld) sollte eine osteoanabole Therapie in Erwägung gezogen werden. Der FRAX®-Rechner ist online verfügbar unter www.sheffield.ac.uk/FRAX.
Abb. 1a: FRAX®-basierte Assessment-, Risiko- und Interventionsschwellen. FRAX: Fracture Risk Assessment Tool, KMD: Knochenmineraldichte. KMD ist in dieser Abbildung nicht berücksichtigt
Abb. 1b: FRAX®-basierte Interventionsschwellen für Österreich. Entspricht Abb. 1a ohne das gelbe Feld. KMD ist in dieser Abbildung nicht berücksichtigt; es wird davon ausgegangen, dass bei der Mehrzahl der Patienten vor der Einschätzung des 10-Jahres-Frakturrisikos mittels FRAX® eine KMD-Messung durchgeführt wurde
Therapie der Osteoporose
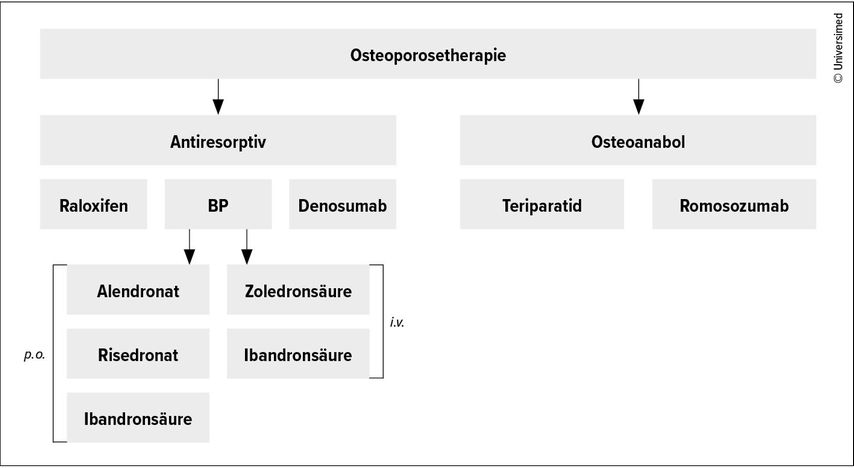
Nach einer vertebralen oder hüftnahen Fraktur ist eine unmittelbare Therapieeinleitung zwingend erforderlich. Patienten, die unter oraler Bisphosphonat-Therapie stabil sind, sollten diese fortsetzen. Nach mehrjähriger oraler antiresorptiver Vorbehandlung mit Alendronat kann auf eine antiresorptive Therapie mit Denosumab oder Zoledronat umgestellt werden. Einen generellen Überblick über die verfügbaren Therapieoptionen bietet Abb. 2.
Denosumab: Rebound-Effekte vermeiden
Ein abrupter Therapieabbruch von Denosumab kann zu einem Rebound-Effekt mit raschem Knochenverlust und erhöhtem Frakturrisiko führen. Um dies zu verhindern, ist bei Therapieende eine Konsolidierung mit Zoledronat erforderlich. Die erste intravenöse Zoledronat-Gabe sollte 6 Monate nach der letzten Denosumab-Injektion erfolgen. Anschließend werden die Knochenumbaumarker (z.B. Serum-CTX) nach 3 bis 6 Monaten kontrolliert, um zu entscheiden, ob eine weitere Zoledronat-Infusion notwendig ist. Bei einem Switch von Denosumab zu Teriparatid kann die Denosumab-Therapie vorübergehend fortgeführt werden, um einen iatrogenen Rebound-Effekt zu vermeiden. Detaillierte Empfehlungen hierzu finden sich in der entsprechenden Leitlinie der ECTS.2
Osteoanabole Therapie bei Hochrisikopatienten
Für Patienten mit sehr hohem Frakturrisiko empfiehlt die Leitlinie wie bereits erwähnt eine primäre osteoanabole Therapie. Postmenopausale Frauen profitieren hierbei von Teriparatid oder Romosozumab, bei Männern mit sehr hohem Risiko kommt Teriparatid zum Einsatz. Nach Abschluss der osteoanabolen Behandlung ist eine sofortige antiresorptive Therapie zwingend erforderlich, um die erzielten Effekte aufrechtzuerhalten (nach 12 Monaten bei Romosozumab bzw. 24 Monaten bei Teriparatid). Die größte Wirksamkeit zeigt die osteoanabole Therapie bei nicht vorbehandelten Patienten – der Effekt auf die Knochendichte ist hier am stärksten.
Die DVO-Osteoporose-Leitlinie fürRheumatologen
Die kürzlich aktualisierte S3-Leitlinie des Dachverbands Osteologie (DVO) zur Prophylaxe, Diagnostik und Therapie der Osteoporose bringt wichtige Neuerungen für die Rheumatologie.3 Ein Schwerpunkt liegt auf der präziseren Risikobewertung, auf differenzierten Therapieempfehlungen und der Berücksichtigung rheumatologischer Risikofaktoren.
Neuer Risikorechner
Ein Kernstück der DVO-Leitlinie ist der Frakturrisikorechner, der das 3-Jahres-Frakturrisiko berechnet – im Unterschied zu den 10-Jahres-Modellen in der österreichischen Leitlinie. Der Rechner berücksichtigt 33 Risikofaktoren, darunter auch rheumatologische Erkrankungen. Die Risikokalkulation ermöglicht es Rheumatologen, Patienten besser zu stratifizieren und eine gezielte Diagnostik und Therapie einzuleiten. Das Modell ist wesentlich umfassender als der FRAX®-Score, der zudem stärker auf das langfristige Risiko fokussiert. „Das DVO-Modell bietet meines Erachtens wesentliche Vorteile bei multimorbiden und älteren Patienten“, so die Einschätzung von OA Dr. Bernhard Rintelen. Der Risikorechner ist bislang nur in Tabellenform verfügbar; ein elektronisches Tool ist in Diskussion.
Rheumatologische Risikofaktoren
Die rheumatoide Arthritis (RA) ist ein zentraler Risikofaktor für Wirbelkörper- und Hüftfrakturen, insbesondere bei hoher Krankheitsaktivität, positivem Rheumafaktor oder erosiven Gelenkveränderungen. Eine begleitende Therapie mit Glukokortikoiden (GC) verstärkt das Risiko zusätzlich. „Bei rheumatischen Erkrankungen wie der RA müssen wir also das Frakturrisiko stets im Blick behalten“, verdeutlichte Rintelen.
Auch die axiale Spondyloarthritis (axSpA) wurde im Risikorechner berücksichtigt, da sie mit einem erhöhten Risiko für Wirbelkörperfrakturen einhergeht. Neue Studien zeigen, dass axSpA-Patienten trotz normaler Knochendichte an der Wirbelsäule mikrostrukturelle Schwächen aufweisen können, was sich in einem erniedrigten Trabecular Bone Score (TBS) widerspiegelt.4
Der systemische Lupus erythematodes (SLE) gilt zwar klar als Risikofaktor für Osteoporose, wird in der Leitlinie jedoch nur kurz erwähnt. Dies liegt daran, dass verfügbare Studien häufig junge Patientenkohorten (<50 Jahren) untersuchen, die nicht der Zielgruppe der Leitlinie entsprechen. Zudem berücksichtigen die Daten oft Kofaktoren wie GC-Therapien oder Begleiterkrankungen nur unzureichend. Dennoch empfiehlt die Leitlinie eine frühzeitige osteologische Abklärung bei SLE-Patienten, auch vor dem 50. Lebensjahr.
Diagnostik: Fokus auf DXA und TBS
Für die Basisdiagnostik empfiehlt die Leitlinie weiterhin die DXA-Messung der Knochendichte an der Lendenwirbelsäule und der Hüfte (total hip). Ergänzend bietet der TBS wertvolle Informationen zur mikroarchitektonischen Qualität des Knochens. Besonders bei RA-Patienten, die häufig eine GC-Therapie benötigen, kann ein erniedrigter TBS ein Hinweis auf ein erhöhtes Frakturrisiko sein, selbst bei unauffälligen DXA-Werten.
Therapieschwellen und differenzierte Therapieempfehlungen
Die aktualisierte DVO-Leitlinie definiert basierend auf dem Frakturrisiko klare Therapieschwellen:
-
Ab 3–5% Frakturrisiko in 3 Jahren: Therapie sollte erwogen werden.
-
Ab 5%: Therapie soll empfohlen werden.
-
Ab 10%: Therapie mit osteoanabolen Substanzen soll eingeleitet werden.
Für Patienten mit sekundärer Osteoporose, wie RA oder axSpA, ist die differenzialtherapeutische Auswahl entscheidend. Neben Bisphosphonaten und Denosumab können osteoanabole Substanzen gezielt eingesetzt werden – abhängig von der individuellen Risikokonstellation. Romosozumab wurde als zweite osteoanabole Substanz neu in die Leitlinie aufgenommen und mit Triple-A-Klassifizierung zur Frakturrisikosenkung für vertebrale, nonvertebrale und proximale Femurfrakturen gelistet. Der Wirkstoff bietet Hochrisikopatienten, insbesondere bei Wirbelkörper- und Hüftfrakturen, eine effektive Behandlungsoption.
Die aktualisierte Glukokortikoid-Leitlinie der ECTS
Die Glukokortikoid-induzierte Osteoporose (GIOP) ist die häufigste Form der sekundären Osteoporose. Die neue Leitlinie der European Calcified Tissue Society (ECTS) bietet praxisnahe Empfehlungen zur Prävention, Diagnostik und Therapie und richtet sich an Spezialisten sowie behandelnde Ärzte anderer Fachrichtungen.5
Bereits niedrige Dosen erhöhen Risiko
Patienten mit langfristiger systemischer Glukokortikoid(GC)-Therapie weisen ein erhöhtes Frakturrisiko auf. Eine aktuelle japanische Registerstudie zeigt, dass bereits niedrige Dosen (1–2,5mg Prednisolon-Äquivalent pro Tag über 90 Tage) das Risiko für Frakturen signifikant steigern.6 Das Frakturrisiko nimmt dosisabhängig sowohl für Schenkelhals- als auch für Wirbelkörperfrakturen zu, wobei geschlechtsspezifische Unterschiede zu beachten sind.
Besonderheiten in der Pathophysiologie der GIOP
Die GIOP unterscheidet sich in mehreren Aspekten von primären Osteoporoseformen. Ein zentraler Mechanismus ist die Hemmung der Osteoblastenaktivität, die zu einer verminderten Knochenneubildung führt. Zusätzlich fördern GC die Apoptose von Osteozyten, was die Stabilität des Knochengewebes weiter beeinträchtigt. Morphologisch zeichnet sich die GIOP durch eine Verdünnung der Trabekelstruktur aus. „Frakturen treten bei GIOP oft bei höheren Knochendichtewerten als bei anderen Formen der Osteoporose auf. Und das hat durchaus praktische Konsequenzen“, erläuterte Univ.-Prof. Dr. Peter Pietschmann. Kritisch ist zudem der rasche Beginn der Erkrankung – häufig innerhalb weniger Monate nach Start der GC-Therapie. Positiv ist, dass die GIOP teilweise reversibel sein kann, wenn die GC-Therapie reduziert oder beendet wird und geeignete Maßnahmen ergriffen werden.
Prävention und allgemeine Maßnahmen: für wen?
Alle Patienten, die länger als 3 Monate GC erhalten, sollten frühzeitig über das Risiko für eine GIOP aufgeklärt werden. Eine strukturierte Anamnese, einschließlich der Erfassung von Größenverlust, Rückenschmerzen und einer Frakturhistorie, ist essenziell, da viele Wirbelkörperfrakturen unerkannt bleiben.
Die allgemeinen Maßnahmen zur Prävention entsprechen weitgehend denen bei primärer Osteoporose. Zusätzlich ist die optimale Behandlung der zugrunde liegenden Erkrankung von großer Bedeutung. Ein angestrebtes Ziel ist es, die (rheumatologische) Grunderkrankung mittels DMARDs so weit zu kontrollieren, dass Glukokortikoide nicht mehr benötigt werden.
Diagnostische Empfehlungen: wen screenen?
Die ECTS-Leitlinie gibt klare Empfehlungen, welche Patienten spezifisch untersucht werden sollten. Im Fokus stehen Frauen und Männer ab 50 Jahren sowie jüngere Patienten mit einem hohen Frakturrisiko, etwa bei Fragilitätsfrakturen in der Anamnese oder bei Begleiterkrankungen und Medikamenten, die eine Osteoporose fördern können.
Die Basisdiagnostik umfasst unter anderem die Messung der Knochendichte an der Lendenwirbelsäule und der proximalen Femurregion mittels DXA. „Bei der GIOP gibt es jedoch oft Situationen, in denen sofort mit einer spezifischen Behandlung begonnen werden sollte, ohne auf das Ergebnis der DXA-Messung zu warten“, erläuterte Pitschmann. Ergänzend wird ein Vertebral Fracture Assessment (VFA) empfohlen, um klinisch unerkannte Wirbelkörperfrakturen zu identifizieren.
Therapieindikationen: wen behandeln?
Eine Therapie ist gemäß ECTS-Leitlinie bei Frauen und Männern über 50 Jahre indiziert, bei denen eine Indikation für eine orale GC-Therapie über 3 Monate oder mehr besteht, wenn mindestens einer der folgenden Faktoren vorliegt:
-
Vorhandensein einer Fragilitätsfraktur
-
T-Score der Lendenwirbelsäule oder Hüfte ≤ –1,5
-
GC-Dosis von ≥7,5mg Prednisolon-Äquivalent/Tag
-
Alter ≥70 Jahre
-
Ein GC-angepasster FRAX®-Wert, der die länderspezifischen Schwellen überschreitet
„Das bedeutet, dass bei einem 75-jährigen Patienten, der 20mg Glukokortikoid pro Tag über 3 Monate oder mehr erhält, bereits eine Indikation zur spezifischen Behandlung besteht – unabhängig vom Ergebnis der Knochendichtemessung“, verdeutlichte Pietschmann.
Therapieoptionen: womit behandeln?
Die konkreten Therapieempfehlungen der ECTS-Leitlinie stratifizieren nach Alter und Risiko.
Frauen und Männer ab 50 Jahren:
-
Mittleres Risiko (keine Fraktur in den letzten 2 Jahren): Alendronat oder Risedronat
-
Hohes Risiko (Fraktur in den letzten 2 Jahren): Zoledronsäure oder Denosumab
-
Sehr hohes Risiko (Alter ≥70 Jahre mit kürzlicher Hüft-, Becken- oder Wirbelkörperfraktur): Teriparatid
Prämenopausale Frauen und Männer unter 50 Jahren:
-
Supplementierung von Kalzium und Vitamin D
-
Patienten mit T- oder Z-Scores ≤ –2 bzw. einer Frakturhistorie sollten zur weiteren Risikoeinschätzung an einen Knochenspezialisten überwiesen werden.
Therapieoptionen im Vergleich
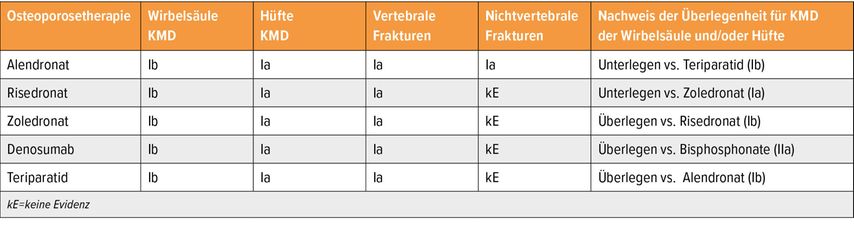
Für die Behandlung der GIOP sind fünf Präparate zugelassen, deren Wirksamkeit gut untersucht ist. Sie steigern die Knochendichte (KMD) an Wirbelsäule und Hüfte und reduzieren das Risiko für vertebrale und nichtvertebrale Frakturen (Tab. 1).
Tab. 1: Vergleich der Wirksamkeit und Evidenz der fünf zugelassenen Osteoporosetherapien bei GIOP (mod. nach Gregson CL et al.)10
Die Effektivität verschiedener Osteoporosetherapien wurde in einigen direkten Head-to-Head-Studien untersucht:
-
Zoledronat vs. Risedronat: Die HORIZON-Studie zeigte, dass parenterales Zoledronat eine stärkere Zunahme der Knochendichte an Lendenwirbelsäule und Oberschenkelhals bewirkte als Risedronat. Dieser Vorteil wurde in Behandlungs- und Präventionsgruppen bestätigt.7
-
Teriparatid vs. Alendronat: Teriparatid zeigte in einer direkten Vergleichsstudie eine stärkere Zunahme der Knochendichte an Lendenwirbelsäule und Oberschenkelhals und reduzierte die Rate radiologischer Wirbelkörperfrakturen signifikant stärker als Alendronat.8
-
Denosumab vs. Risedronat: Denosumab bewirkte eine signifikant stärkere Zunahme der Knochendichte an Lendenwirbelsäule, Hüfte und Oberschenkelhals. Diese Unterschiede waren bereits nach 6 Monaten sichtbar und blieben nach 12 und 24 Monaten signifikant.9
Fazit
Die Detektion, Prävention und Therapie der Glukokortikoid-induzierten Osteoporose (GIOP) ist eine zentrale Aufgabe der Rheumatologie. Besonders wichtig ist, dass bei Patienten unter GC-Therapie eine Indikation zur spezifischen Osteoporosetherapie auch unabhängig von der Knochendichte bestehen kann. Für die Behandlung stehen fünf Wirkstoffe zur Verfügung, deren Einsatz sich an Alter und Risikoprofil der Patienten orientiert.
Quelle:
Jahrestagung der Österreichischen Gesellschaft für Rheumatologie & Rehabilitation (ÖGR), 28.–30. November 2024, Wien
Literatur:
1 Dimai HP et al.: Osteoporosis-definition, risk assessment, diagnosis, prevention and treatment (update 2024): Guidelines of the Austrian Society for Bone and Mineral Research. Wien Klin Wochenschr 2024; 136(Suppl 16): 599-668 2 Tsourdi E et al.: Fracture risk and management of discontinuation of denosumab therapy: a systematic review and position statement by ECTS. J Clin Endocrinol Metab 2020; 106(1): 264-281 3 Dachverband Osteologie (DVO): Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern ab dem 50. Lebensjahr – Leitlinie des Dachverbands der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften e.V. 2023; AWMF Reg-Nr. 183/001 4 Saisirivechakun P et al.: Prevalence of low trabecular bone score and its association with disease severity and activity in patients with axial spondyloarthritis. Sci Rep 2023; 13(1): 16258 5 Paccou J et al.: Prevention and treatment of glucocorticoid-induced osteoporosis in adults: recommendations from the European Calcified Tissue Society. Eur J Endocrinol 2024; 191(6): G1-G17 6 Iki M et al.: Average daily glucocorticoid dose, number of prescription days, and cumulative dose in the initial 90 days of glucocorticoid therapy are associated with subsequent hip and clinical vertebral fracture risk: a retrospective cohort study using a nationwide health insurance claims database in Japan. Osteoporos Int 2024; 35(5): 805-818 7 Gregson CL et al.: UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos 2022; 17(1): 58 8 Reid DM et al.: Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet 2009; 373(9671): 1253-63 9 Saag KG et al.: Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med 2007; 357(20): 2028-39 10 Saag KG et al.: Denosumab versus risedronate in glucocorticoid-induced osteoporosis: a multicentre, randomised, double-blind, active-controlled, double-dummy, non-inferiority study. Lancet Diabetes Endocrinol 2018; 6(6): 445-54
Das könnte Sie auch interessieren:
Psoriasis-Arthritis: Es kann noch mehr erreicht werden
Erlauben es die aktuell verfügbaren Therapieoptionen, Psoriasis-Arthritis (PsA) so zu adressieren, dass sie für Patientinnen und Patienten keine Belastung mehr darstellt? „Treat to ...
CAR-T-Zell-Therapie beim systemischen Lupus – ein neuer Meilenstein?
Seit dem Jahr 2021 wird die CAR-T-Zell-Therapie auch in der Behandlung von Autoimmunerkrankungen eingesetzt – dies stellt ein relativ neues Anwendungsfeld dieser Methode außerhalb der ...
Neues Verständnis von PMR und LVV
Im Jahr 2024 wurden die Polymyalgia rheumatica (PMR) und die Großgefäßvaskulitis (LVV) erstmals in einer Leitlinie als Spektrumserkrankungen beschrieben. Diese Klassifikation eröffnet ...