Psoriasis-Arthritis: Es kann noch mehr erreicht werden
Bericht:
Ines Schulz-Hanke
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Erlauben es die aktuell verfügbaren Therapieoptionen, Psoriasis-Arthritis (PsA) so zu adressieren, dass sie für Patientinnen und Patienten keine Belastung mehr darstellt? „Treat to target“ ist die Devise und das Therapieziel ist – international und national häufig akzeptiert – die „minimal disease activity“ (MDA). Ein Vortrag auf dem DGRh über die 2024 gewonnenen Erkenntnisse zeigte, warum eine Weiterentwicklung von Therapieoptionen möglich und sinnvoll ist.
Um die eingangs erwähnte minimale Krankheitsaktivität (MDA) zu erreichen, seien 5 von 7 definierten Kriterien zu erfüllen, führte Prof. Dr. med. Frank Behrens, Frankfurt, aus. Würden alle 7 Kriterien erfüllt, dann entspreche dies dem Zustand „very low disease activity“ (VLDA), und damit dem geringsten Risiko für kardiovaskuläre Ereignisse und radiografische Progression. Eine VLDA schütze am besten vor direkten Krankheitsfolgen, aber vor auch assoziierten Erkrankungen.1 Diese Kriterien sind wie folgt:
-
Anzahl der schmerzhaften Gelenke ≤ 1
-
Anzahl der geschwollenen Gelenke ≤ 1
-
PASI-Score ≤ 1 oder BSA-Score ≤ 3
-
Schmerzintensität auf der visuellen Analogskala (VAS; 0–100) Score ≤ 15
-
Krankheitsaktivität insgesamt VAS-Score ≤ 20
-
HAQ-Score ≤ 0,5
-
Anzahl schmerzhafter Enthesen ≤ 1
Globale Registerdaten sowie solche aus den USA und Schweden zeigten allerdings: Selbst eine MDA erreichen nur ein Drittel bis zu 40% (Schweden) im Praxisalltag. Und selbst dann hätten Betroffene noch immer ein geschwollenes oder ein druckschmerzhaftes Gelenk, eine schmerzhafte Enthese, keine erscheinungsfreie Haut.2–4 „Reicht uns das? Und wenn es uns nicht reicht, was können wir tun, um das zu optimieren, und welche Bedeutung hat es?“, fragte Behrens. Zu berücksichtigen sei darüber hinaus die erhöhte Mortalität von PsA-Patientinnen und -Patienten – im Wesentlichen eine Folge kardiovaskulärer Ereignisse. Bei PsA wiesen alle Bereiche der großen Gefäße verglichen mit gesunden Kontrollen inflammatorische Signale auf.5 Dies sei keine allgemeine Folge chronisch-entzündlicher Erkrankungen, denn bei atopischer Dermatitis bestehe dieser Zusammenhang beispielsweise nicht.
Das „window of opportunity“
Insbesondere bei der axialen Spondyloarthritis verzögere sich die Diagnose oft infolge des Rückenschmerzes, weil dieser ein so häufiges Symptom sei. Doch auch bei PsA komme es zur Diagnoseverzögerung und hier könne sie – insbesondere bei Menschen mit enthesialer Manifestation – 40 Monate erreichen, wie Behrens betonte.6 Dies sei beachtlich, da gerade der enthesiale, also der extrakapsuläre muskuloskelettale Entzündungsprozess bei PsA häufig früher auftrete und erst später die Synovitis, das klassische geschwollene Gelenk.
Die Diagnoseverzögerung zu verkürzen könne sich jedoch nur dann lohnen, wenn Betroffene von einer früheren Therapie profitierten. Da die Datenlage hierzu bisher uneinheitlich gewesen sei, habe eine Studie von 2024 auf die Frage, ob eine „vernünftige Therapie“ innerhalb eines Jahres beginnen müsse, um das angestrebte Therapieziel zu erreichen, eine Antwort geliefert: Ja. Tatsächlich sei der Anteil der Behandelten, die eine MDA erreichen, bei einem Therapiebeginn innerhalb des ersten Jahres signifikant höher als bei einem Start jenseits dieses Zeitraums. Die entstehenden Nachteile ließen sich durch eine Eskalation aller Therapien nicht aufholen. Man müsse also tatsächlich von einem Gelegenheitsfenster ausgehen und mit der Therapie innerhalb von 3 bis 6 Monaten beginnen, keinesfalls erst nach einem Jahr.6 Deswegen sei es essenziell, die Diagnoseverzögerung zu reduzieren, so Behrens.
Psoriasis behandeln, um Arthritis zu verhindern?
Da die kutane Psoriasis der Gelenkbeteiligung meist vorausgehe, werde seit mehreren Jahren diskutiert, ob sich durch eine gute Behandlung der Hautpsoriasis verhindern lasse, dass Betroffene eine Gelenkbeteiligung entwickeln. Da sehr viele pathophysiologische Gemeinsamkeiten zwischen den beiden Formen bestünden, sei es naheliegend, dass eine Normalisierung der gemeinsamen Pathomechanismen durch eine immunmodulierende Schuppenflechtetherapie einer Arthritis verbeugen könnte – dass also das Konzept der „disease interception“ funktioniere.
Über den Zeitpunkt des Therapiebeginns, der eine echte „disease interception“ ermöglicht, bestünde noch keine Einigkeit. Abwägungen dazu hätten 2023 die EULAR, die PAMPA-Studie (Preventing Arthritis in a Multicentre Psoriasis At-Risk Cohort) sowie die Arbeitsgruppe um José Cher geliefert.7 Einem Konsensus-Beschluss zufolge soll die „disease interception“ beginnen, wenn Erkrankte mit Schuppenflechte bereits subklinische Entzündungszeichen der Gelenke aufweisen, entweder in Form proinflammatorischer Biomarker oder als in der Bildgebung bereits sichtbare Veränderungen. Tatsächlich liefen bereits Studien mit Patientinnen und Patienten, die nach diesen Kriterien ausgewählt wurden.
Behrens formulierte allerdings Bedenken, ob in dieser Klientel die Gelenkerkrankung nicht bereits vorliege und eine echte Verhinderung dann noch möglich sei. Möglicherweise behandle man vielmehr eine sehr milde PsA und verhindere „nur“ eine klinisch evidente schwere Erkrankung. Vorzuziehen sind seiner Ansicht nach Verhinderungsstudien, die einsetzen, wenn der Patient nur eine Schuppenflechte und sicher nichts am muskuloskelettalen System habe. Blieben in diesem Fall unter einer Behandlung PsA-Erkrankungszeichen klinisch und in der Bildgebung aus, dann wäre es das, was man sich wünsche würde.
Große Kohorten und Registerdaten gäben bereits jetzt Auskunft über die jährliche Wahrscheinlichkeit des Neuauftretens von Arthritis bei Patienten mit Schuppenflechte unter unterschiedlichen Therapiemodalitäten. Doch seien die bisher vorliegenden Publikationen zur PsA-Verhinderung bei Menschen mit Schuppenflechte nicht aussagekräftig, da es sich um prospektive Observationsstudien, retrospektive Studien oder Post-hoc-Analysen großer Kohorten handle. Aus ihnen lasse sich bisher nur ableiten, dass mild erkrankte Patienten, die auch eine milde topische Therapie bekommen, wahrscheinlich „das geringere Risiko haben, Arthritis zu entwickeln“.8
Methotrexat: mit oder ohne?
Für die Wirksamkeit von Methotrexat (MTX) bei PsA fehle die Evidenz für die Effizienz von MTX-DMARD-Kombinationen. In einer randomisierten Studie sei untersucht worden, ob eine MTX-Gabe die Wirkung einer IL-23-Inhibition (Ustekinumab) bei MTX-vorbehandelten bzw. -naiven PsA-Erkrankten beeinflusse. Unabhängig davon, ob aktuell MTX gegeben und dann abgesetzt werde oder die Kombination neu initiiert werde, beeinflusse dies am Ende einer IL-23-Inhibition das mittlere DAS28-Ergebnis nicht. Darüber hinaus lasse sich aus der klassischen Nichtunterlegenheitsstudie ableiten, dass die Monotherapie mit dem Biologikum Ustekinumab einer Kombinationstherapie sicher nicht unterlegen war.9
Dass diese Evidenz fehle, zeige auch die Auswertung der Daten aus dem RABBIT-SpA-Register durch das Deutsche Rheuma-Forschungszentrum.10 Diesen Daten zufolge würden noch 20–40% der PsA-Patientinnen und -Patienten in Deutschland kombiniert mit MTX behandelt, wobei sich die Kombinationshäufigkeit für die verschiedenen DMARDs etwas unterschiede. Bei Certolizumab werde danach am seltensten MTX zugegeben, bei Tofacitinib am häufigsten, da Tofacitinib nur in Kombination mit MTX für die PSA zugelassen sei.
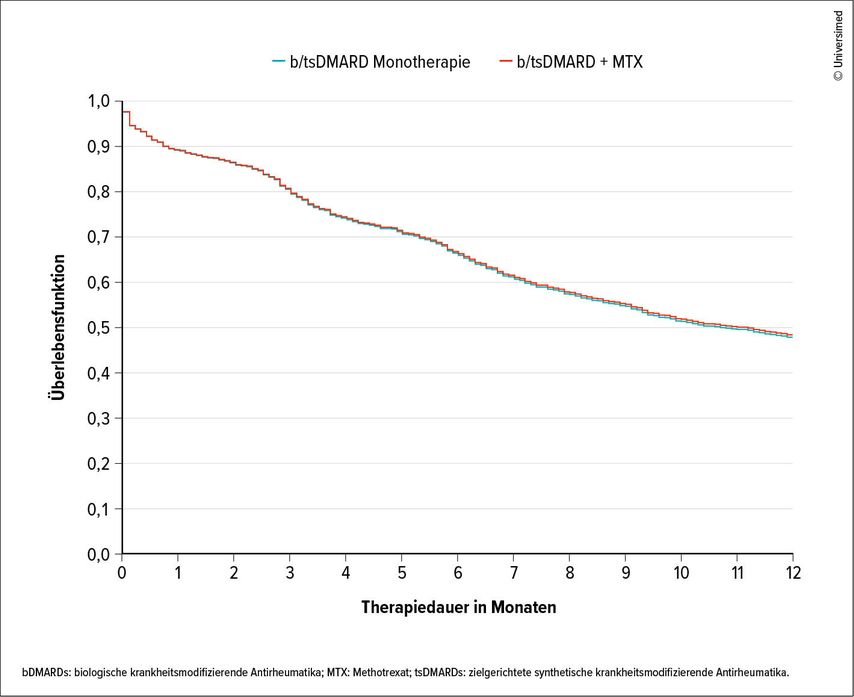
Im Versorgungsalltag unterscheidet sich die Wirksamkeit zwischen Mono- und Kombinationstherapie mit MTX nicht, wie Behrens anhand der Überlebensfunktion zeigte (Abb. 1).10 Dies lasse sich nicht nur für die Gesamtgruppe aller biologischen und „targeted synthetic DMARDs“ darstellen, sondern auch für die Kombination aus TNF und MTX.
Abb. 1: Arzneimittelpersistenz, angepasst an den Status des Patienten/der Patientin als bionaiv oder nicht bionaiv.
Eine Ausnahme hinsichtlich der kombinierten MTX-Therapie formulierte Behrens: Eine bereits bestehende MTX-Gabe solle erst ausgesetzt werden, wenn ein neu initiiertes Biologikum bereits wirke, um einen etwaigen MTX-Resteffekt nicht zu verlieren. Funktioniere das Biologikum, könne man MTX weglassen.
Oligo- und polyartikuläre Beteiligung
Die EULAR unterscheide bezüglich der Therapie zwischen oligo- und polyartikulärer PsA: Bei Menschen mit oligoartikulärer PsA (≤ 3 geschwollenen Gelenken) sei der Einstieg in eine DMARD-Therapie danach weniger dringend.11 Neue Einsichten brächte nun eine erste Studie ausschließlich zur oligoartikulären PsA, die Patientinnen und Patienten mit > 4 geschwollenen Gelenken ausgeschlossen hatte und in der die mittlere Anzahl geschwollener oder druckschmerzhafter Gelenke bei 2,6 bzw. 3,2 lag.12 Üblicherweise arbeite man in Studien mit 10 geschwollenen und 20 druckschmerzhaften Gelenken, um die Effektivität hinsichtlich der MDA-Kriterien sicher belegen und eine zufällige Schwankung ausschließen zu können.
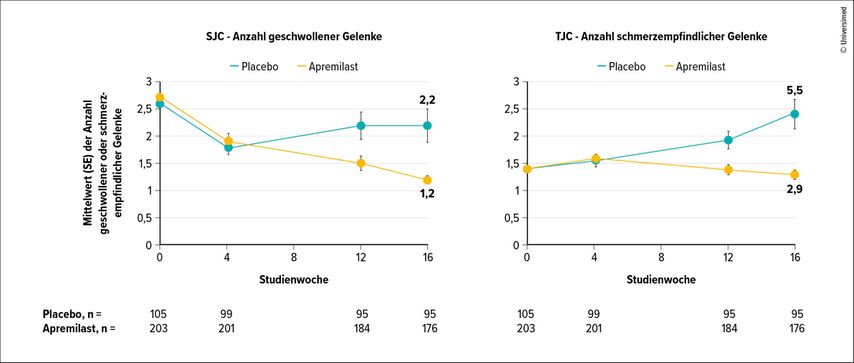
Die Studienteilnehmenden mit oligoartikulärer PsA erhielten randomisiert entweder Placebo oder den PDE-4-Inhibitor Apremilast. Dieser erzielte hinsichtlich der Gelenkkriterien für MDA auch bei ihnen einen hochsignifikanten Effekt. Die Ansprechraten hinsichtlich der Gelenkkriterien unterschieden sich um 18,5 %.12 Die Verlaufsbeobachtung über 16 Wochen habe gezeigt, dass die PsA bei Patientinnen und Patienten unter Placebo fortschreite: Die Zahl der geschwollenen und der druckschmerzhaften Gelenke nahm zu. Abbildung 2 zeigt die Verlaufsbeobachtung der oligoartikulären PsA unter Placebo vs. Apremilast anhand der Zahl der geschwollenen (SJC) bzw. schmerzhaften Gelenke (TJC).
Abb. 2: Verlaufsbeobachtung der oligoartikulären PsA unter Placebo vs. Apremilast anhand der Zahl der geschwollenen (SJC) bzw. schmerzhaften Gelenke (TJC) (mod. nach Gossec L et al.)12
Mit Blick auf das für die PsA bestehende Gelegenheitsfenster müssten Patientinnen und Patienten mit oligoartikulärer Beteiligung suffizient behandelt werden, wenn sie das Therapieziel MDA nicht erreicht haben. Dies gelte auch für die Domänen Schmerz, Patient’s Global Assessment of Disease Activity (PtGA), Health Assessment Questionnaire-Disability Index (HAQ-DI) und Leeds Enthesitis Index (LEI).
Das beste Wirkprinzip für die Psoriasisarthritis?
Der TNF-Blocker gelte wohl noch immer als State of the Art und als das vielleicht potenteste Medikament für die muskuloskelettalen arthritischen Manifestationen. Eine neue Netzwerk-Metaanalyse habe nun jedoch die Frage beleuchtet, ob der TNF-Blocker besser sei als eine IL-17- oder IL-23-Inhibition oder ob gegebenenfalls eines dieser Wirkprinzipien überlegen sei.13 Tatsächlich habe sie gezeigt, dass sich für die IL-17- oder IL-23-Inhibition hinsichtlich des ACR-50-Ansprechens eher ein Vorteil gegenüber der TNF-Blockade ergebe, also hinsichtlich eines harten Arthritis-Kriteriums, das weder Haut noch Enthesitis bewerte. Es sei also gewiss kein Nachteil, wenn man IL-17- oder IL-23-Blocker gegen muskuloskelettale Manifestation einsetze. Die Einschätzung, dass ein TNF-Blocker bei Arthritis viel potenter sei, lasse sich so nicht halten, so Behrens. Darüber hinaus gebe es auch randomisierte Head-to-Head-Studien mit den beiden IL-17-Blockern Ixekizumab und Secukinumab, die keine Überlegenheit gezeigt hätten.
Die IL-23-Blocker stünden unter Verdacht, langsamer zu wirken, was bei Ustekinumab – allerdings mit 45mg absolut unterdosiert – tatsächlich zu beobachten gewesen sei. Die neuen IL23p19-Antikörper Risankizumab und Guselkumab erreichten ihr Plateau zwar nicht zu Monat 6. Danach setze jedoch ein Ansprechen ein und letztlich habe die Netzwerk-Metaanalyse keinen signifikanten Nachteil für die IL-23-Blocker im ACR-50-Ansprechen gegenüber der IL-17-Inhibition ergeben.13 Zwar gebe es auch Studien, die einen etwas abweichenden Trend ausweisen, keine der Analysen habe jedoch bisher ein klar überlegenes Wirkprinzip identifiziert.
Persistenz und Adhärenz
In der Vergangenheit habe man immer wieder beobachtet, dass Ustekinumab sich durch eine hohe Persistenz und Adhärenz auszeichnet. Die Therapien liefen lange und wurden nicht abgesetzt, obwohl man von einer weniger starken Wirksamkeit bei Arthritis ausging.
In der Dermatologie habe sich zudem eine sehr hohe Persistenz von IL-17- oder IL-23-Hemmern bei der Schuppenflechte zeigen lassen. Die Daten wiesen ein sehr starkes „drug survival“ für die IL-23-Inhibitoren nach, unter anderem für Risankizumab und Guselkumab, die für die PsA infrage kommen. Die sehr gute Persistenz bei der Schuppenflechte sei jedoch nicht nur wegen der Sicherheit dieser Wirkstoffe so gut, sondern auch aufgrund ihrer Wirksamkeit. Dies sei ein weiteres Beispiel dafür, dass das Wirkprinzip der IL-23-Blockade funktioniere und sehr sicher sei – wenn auch nur als indirekter Vergleich zur TNF-Inhibition.14
Ein besseres molekulares und zelluläres Verständnis
Um die Therapie zu optimieren, könne man versuchen, Patientinnen und Patienten molekular oder zellulär zu stratifizieren. Mittels Durchflusszytometrie und Immunphänotypisierung aus peripherem Blut habe sich feststellen lassen, ob Erkrankungen Th-17- oder TH-1-getrieben waren. In einer (nicht randomisierten und verblindeten) japanischen Studie hatten Forschende 2020 bei einem TH-1-Zell-prädominanten Typ einen IL-23-Blocker gegeben, beim TH-17-Zell-prädominanten Typ einen IL-17-Blocker, bei hohen Th1/Th17-Werten einen IL-17i oder TNFi und bei niedrigen Th1/Th17-Werten einen TNFi. Dies habe gezeigt, dass eine derartige Stratifizierung die ACR-20-Response deutlich steigern kann, und zwar von 55% auf bis zu 80% innerhalb von 6 Monaten.15 Sollten sich diese Ergebnisse in der aktuell laufenden randomisierten, verblindeten Studie bestätigen, dann hätte man ein einfaches Stratifizierungssystem.
Die Biomarker-gesteuerte Therapie, die sich zukünftig auch auf Fettstoffwechselprodukte oder Chemokine des Arachidonsäure-Metabolismus stützen könnte, werde sicherlich in Zukunft die Responserate deutlich steigern können, schloss Behrens.
Quelle:
„WIN PsA“, Vortrag von Prof. Frank Behrens, Berlin, im Rahmen der Session „WIN RA, axSpA und PsA” anlässlich des Deutschen Rheumatologie-Kongresses 2024 (DGRh), Düsseldorf
Literatur:
1 Smolen JS et al.: Rheumatoid arthritis. Ann Rheum Dis 2018; 77(1): 3-17 2 Zardin-Moraes M et al.: Predictors of remission in early rheumatoid arthritis. J Rheumatol 2020; 47(6): 839-46 3 Ogdie A et al.: Patient-reported outcomes in psoriatic arthritis: results from a phase 3 trial [abstract]. Arthritis Rheumatol 2021; 73(Suppl 9): Abstract 1344 4 Theander E et al.: Prevalence and clinical characteristics of primary Sjögrenʼs syndrome in a defined population. Ann Rheum Dis 2014; 73(2): 407-13 5 Kleinrensink NJ et al.: Safety of biologics in early inflammatory arthritis. Ann Rheum Dis 2023; 82(1): 16-7 6 Snoeck Henkemans SVJ et al.: Window of opportunity in psoriatic arthritis: the earlier the better? RMD Open 2024; 10(1): e004062 7 Lopez-Medina C et al.: Axial spondyloarthritis treatment outcomes in real-world settings. Rheumatology (Oxford) 2024; 10.1093/rheumatology/keae399 8 Watad A et al.: Immune-related adverse events in rheumatology: management strategies. Rheumatol Ther 2024; 11(4): 963-76 9 Koehm M et al.: Advances in psoriatic arthritis treatment pathways. Lancet Rheumatol 2023; 10.1016/S2665-9913(22)00329-0 10 Regierer AC et al.: No difference in clinical parameters and drug retention in PsA patients receiving b/tsDMARD monotherapy versus combination with methotrexate: data from the RABBIT-SpA registry. RMD Open 2024; 10(3): e004389 11 Gossec L et al.: EULAR recommendations for the management of rheumatoid arthritis: 2024 update. Ann Rheum Dis 2024; 83(4): 706-19 12 Gossec L et al.: New insights in psoriatic arthritis management. Ann Rheum Dis 2024; 10.1136/ard-2024-225833 13 Mease PJ et al.: Evaluating the efficacy of biologics with and without methotrexate in the treatment of psoriatic arthritis: a network meta-analysis. RMD Open 2024; 10(1): e003423 14 Sarah ET et al.: Comparative efficacy of targeted DMARDs in rheumatoid arthritis. Rheumatol Drugs 2024; 84(5): 565-78 15 Miyagawa I et al.: Risk of malignancy in rheumatoid arthritis treated with biologics: a meta-analysis. Rheumatology (Oxford) 2019; 58(2): 336-44
Das könnte Sie auch interessieren:
Ein Leitlinien-Update für die rheumatologische Praxis
Die aktualisierten Leitlinien spiegeln wichtige Neuerungen in der Diagnose und Therapie der Osteoporose wider. Die österreichische Leitlinie der ÖGKM bietet eine fundierte Grundlage mit ...
CAR-T-Zell-Therapie beim systemischen Lupus – ein neuer Meilenstein?
Seit dem Jahr 2021 wird die CAR-T-Zell-Therapie auch in der Behandlung von Autoimmunerkrankungen eingesetzt – dies stellt ein relativ neues Anwendungsfeld dieser Methode außerhalb der ...
Neues Verständnis von PMR und LVV
Im Jahr 2024 wurden die Polymyalgia rheumatica (PMR) und die Großgefäßvaskulitis (LVV) erstmals in einer Leitlinie als Spektrumserkrankungen beschrieben. Diese Klassifikation eröffnet ...