Abklärung von Lungenrundherden
Autorin:
Dr. med. Kathleen Jahn
Kaderärztin
Klinik für Pneumologie
Universitätsspital Basel
E-Mail: kathleen.jahn@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Lungenkrebs ist die häufigste Todesursache bei Malignomerkrankungen vor Brustkrebs und kolorektalen Karzinomen. Die sorgfältige und guidelinekonforme Abklärung von inzidentalen Lungenrundherden stellt die Grundlage für das weitere optimale Procedere bei Vorliegen eines Bronchuskarzinoms dar.
Weltweit sind circa 2 Millionen Patienten jährlich von Lungenkrebs betroffen.1 Als Lungenrundherd wird eine Läsion von <3cm Grösse bezeichnet, die vollständig von Lungenparenchym umgeben ist.2 Grössere Läsionen bezeichnet man als Masse.
Anatomische und radiologische Einordnung
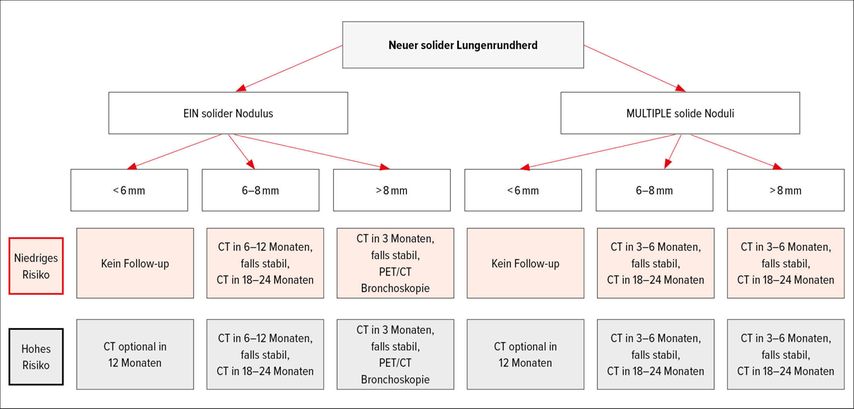
Wird ein Rundherd detektiert, wird dieser in Grösse und Dichte beschrieben. Die revidierten Fleischner-Kriterien zur radiologischen Beurteilung von inzidentalen Lungenrundherden unterscheiden neuerdings zwei Hauptsektionen: solide versus subsolide Noduli (Abb. 1).
Abb. 1: Algorithmus für die radiologische Abklärung eines inzidentalen Lungenrundherds mit Unterteilung in solide und subsolide Lungenrundherde (adaptiert nach den Guidelines der Fleischner Society 2018)
Subsolide Noduli teilt man weiterführend ein in vollständig milchglasartige Läsionen («ground glass nodules») und partiell milchglasartige Veränderungen, die neben dem Milchglas auch einen soliden Anteil aufweisen. Solide Noduli treten zahlenmässig am häufigsten auf. Bei einer Grösse von >8mm wird bei singulären Rundherden eine direkte Abklärung empfohlen. Bei kleineren Läsionen sollte, wie im Schema dargestellt, eine guidelinekonforme Follow-up-Kontrolle vorgenommen werden.
Bei einem subsoliden Nodulus wird ab einer Grösse von >6mm und bei vorbestehender Risikokonstellation eine direkte Abklärung empfohlen, da es sich hierbei häufig um alveolär wachsende Bronchuskarzinome handelt.
Des Weiteren können bereits computertomografische Hinweise auf einen malignen Prozess vorliegen. Dazu werden eine Spikulierung/Ausziehung der Läsion, eine unregelmässige Begrenzung, pleurale Einziehungen, Kavitierung etc. gezählt. Hingegen kann ein runder, verkalkter Nodulus eher als benigne eingestuft werden (Abb. 2).
Differenzialdiagnostisch sind die Ursachen solitärer Rundherde breit gefächert. Pulmonale Malignome sind am ehesten Adenokarzinome, Plattenepithelkarzinome und grosszellige Karzinome. Ausserdem ist an pulmonale Metastasen zu denken (Karzinome von Lunge, Mamma, Kolon, Niere, Haut, Sarkome). Eher selten sind Karzinoide, da sie in erster Linie endobronchial wachsen und nur in 20% intraparenchymatös gelegen sind.
Gutartige Befunde sind zu ca. 10% Hamartome, welche häufig eine typische popcornartige Verkalkung aufweisen. Weitaus häufiger (80%) sind frische oder residuelle infektiöse Prozesse wie zum Beispiel St.n. Tuberkulose oder Histoplasmose und andere mykobakterielle und fungale Infekte. Auch septische Prozesse können v.a. kavitierende Noduli ausbilden, die jedoch meist nicht solitär auftreten. Seltener sind arteriovenöse Malformationen, Rundatelektasen oder inflammatorische Läsionen aus dem rheumatologischen Formenkreis, wie beispielsweise der Morbus Wegener mit häufig einschmelzenden nodulären pulmonalen Läsionen.
Staging
Zum Staging bei Verdacht auf ein Bronchuskarzinom erfolgt eine PET-CT mit der Frage nach Fernmetastasierung und lokoregionären Lymphknotenmetastasen. Die meisten pulmonalen malignen Manifestationen zeigen ein gesteigertes FDG-Uptake, sodass eine gute Aussage über das Befallsmuster getätigt werden kann. Nierenzellkarzinom und bronchoalveloäre Karzinome machen dabei eine Ausnahme, da diese Typen einen niedrigen bis negativen FDG-Umsatz aufweisen.
Sollte kein PET-CT zur Verfügung stehen, kann auf eine CT des Abdomens/Beckens ausgewichen werden.
Funktionelle Abklärung
Im Anschluss an die Indikationsstellung zur weiterführenden Abklärung eines solitären pulmonalen Rundherdes sollte stets eine funktionelle Standortbestimmung zur Evaluierung der pulmonalen Kapazität in Hinblick auf nachfolgende diagnostische Schritte und mögliche therapeutische Massnahmen erfolgen. Sowohl vor einer möglichen Operation als auch vor dem Beginn einer Chemo- oder Immuntherapie ist es wichtig, die Funktionalität der Lunge abschätzen zu können, um die prätherapeutische Einschränkung für die Auswahl der optimalen Therapieform am interdisziplinären Board zu ermöglichen.
Dafür wird eine Lungenfunktion mit Spirometrie und Bodyplethysmografie durchgeführt. Sollte sich kein Normalbefund ergeben, d.h. das FEV1 und die Diffusionskapazität <80% sein, benötigt man eine zusätzliche Spiroergometrie zur Bestimmung der effektiven Sauerstoffaufnahme (VO2max), der Wattleistung, des Gasaustausches und der Suche nach möglichen limitierenden Faktoren von kardialer, pulmonaler und extrapulmonaler Seite.
Die Festlegung des Resektionsausmasses erfolgt guidelinekonform (Abb. 3).3 Sollte trotz der Spiroergometrie keine abschliessende Aussage getroffen werden können oder die Belastungsuntersuchung nicht durchführbar sein, wird die Diagnostik um eine Ventilationsperfusionsszintigrafie (SPECT) ergänzt. Nachfolgend kann kalkuliert das Resektionsausmass berechnet werden (Abb. 3).
Abb. 3: Algorithmus für die funktionelle Abklärung (adaptiert nach von Groote-Bidlingmaier F et al.)9
Interventionelle Diagnoseschritte
Die definitive Diagnosestellung erfolgt meist mit einer Bronchoskopie (Abb. 4). Dies ist eine sehr komplikationsarme Intervention, die unter Propofol durchgeführt wird. Nach der Inspektion des Bronchialsystems wird die Läsion gezielt angegangen und es kann dann mittels Lavagierung (BAL), Nadelaspiration und Bürstenzytologie sowie Entnahme transbronchialer Biopsien (TBB) Material für die pathologische Aufarbeitung asserviert werden. Dabei besteht das höchste periinterventionelle Risiko bei der TBB mit einem Pneumothoraxrisiko von 5%.
Das Staging der Lymphknotenstationen erfolgt mit einem linearen endoskopischen Ultraschall (EBUS), der es ermöglicht, die angrenzenden, im PET suspekten mediastinalen und hilären Lymphknotenstationen zu punktieren.4,5 Auch hier liegt das Komplikationsrisiko im unteren einstelligen Bereich. Man geht dabei von der vom Tumor am weitesten entfernten Lymphknotenstation (meist kontralateral) aus, um das korrekte Stadium zu detektieren.
Als weitere endoskopische Asservierungsmöglichkeiten der pulmonalen Läsion können die elektromagnetische Navigation und auch der radiale Ultraschall genutzt werden.6–8 Bei der Navigation wird auf Basis der Thorax-CT durch Nutzung einer Software eine virtuelle Endoskopie generiert. Nachfolgend wird parallel über ein Magnetfeld die Magnetsonde durch den Untersucher in «real-time» via Endoskop in die Läsion navigiert. Der Katheter wird platziert und direkt in der Läsion belassen, sodass eine rasche zeitoptimierte, sichere Materialgewinnung durchgeführt werden kann. Beim radialen Ultraschall wird die Sonografiesonde ebenfalls via Endoskopie und unter zusätzlicher Nutzung der Durchleuchtung im Bereich der Läsion platziert und dann sonografisch unterstützt die Läsion dargestellt und nachfolgend das Material gewonnen. Beide Untersuchungsoptionen sind v.a. hilfreich bei kleineren Läsionen, die mit der herkömmlichen Durchleuchtung nicht darstellbar sind.
Sollte dennoch keine affirmative Diagnosestellung erfolgen, ist als nächster Schritt eine CT-gesteuerte Punktion möglich, welche verglichen mit der bronchoskopischen Methode ein deutlich höheres Pneumothoraxrisiko von 30% aufweist. Das Risiko der Tumoraussaat im Stichkanal ist dabei mit 0,05% zu vernächlässigen.
Sollte auch dies ohne abschliessende Entitätsklärung bleiben, ist eine videoassistierte Resektion notwendig, die minimalchirurgisch erfolgen kann. In circa 12% ist dabei eine Konversion in eine Thorakotomie notwendig. Der Vorteil bei dieser Methode ist, dass man nach Lokalisation und Eingrenzung der pulmonalen Läsion ausreichend grosse Gewebefragmente erhält, die der histologischen Aufarbeitung zugeführt werden können. Nach Erhalt der abschliessenden Diagnose der Pathologie inkl. Markerprofil etc. sollte an einem interdisziplinären Board durch die involvierten Fachrichtungen das optimale weitere Procedere festgelegt werden.
Literatur:
1 Siegel RL et al.: Cancer statistics, 2020. CA Cancer J Clin 2020; 70: 7-302 MacMahon H et al.: Guidelines for management of incidental pulmonary nodules detected on CT images: from the Fleischner Society 2017. Radiology 2017; 284: 228-43 3 Schmid A et al.: Design and validation of an interpretative strategy for cardiopulmonary exercise tests. Respirology 2007; 12: 916-23 4 Bugalho A et al.: Diagnostic value of endobronchial and endoscopic ultrasound-guided fine needle aspiration for accessible lung cancer lesions after non-diagnostic conventional techniques: a prospective study. BMC Cancer 2013; 13: 130 5 Vaidya PJ et al.: Diagnostic value of core biopsy histology and cytology sampling of mediastinal lymph nodes using 21-gauge EBUS-TBNA needle. J Cancer Res Ther 2016; 12: 1172-7 6 Loo FL et al.: The emerging technique of electromagnetic navigation bronchoscopy-guided fine-needle aspiration of peripheral lung lesions: promising results in 50 lesions. Cancer Cytopathol 2014; 122: 191-9 7 Lamprecht B et al.: Electromagnetic navigation bronchoscopy (ENB): increasing diagnostic yield. Respir Med 2012; 106: 710-5 8 Muñoz-Largacha JA et al.: Navigation bronchoscopy for diagnosis and small nodule location. J Thorac Dis 2017; 9(Suppl 2): S98-103 9 von Groote-Bidlingmaier F et al.: Functional evaluation before lung resection. Clin Chest Med 2011; 32: 773-82
Das könnte Sie auch interessieren:
Transition von Jugendlichen mit Asthma
Etwa 85% der Patient:innen mit angeborenen Erkrankungen oder Krankheiten, die im Kindesalter auftreten, werden erwachsen. Das heisst, dass auch ihre medizinischen Bedürfnisse sich ...
Lungenkrebsscreening: erste Erfahrungen aus Zürich aus radiologischer Perspektive
Lungenkrebs ist weltweit und in der Schweiz eine der häufigsten krebsbedingten Todesursachen. Internationale Studien zeigen, dass Früherkennungsprogramme mittels Niedrigdosis- ...