Pulmonale Karzinoide bei Kindern und Jugendlichen
Autor:
Damian Bergmann
Facharzt für Kinder- und Jugendmedizin
Pädiatrische Pulmologie
Universitätsklinik Tübingen
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nachdem bereits zwei Jahre zuvor die gleiche Symptomatik aufgetreten, aber nicht weiterführend abgeklärt worden war, stellte sich eine 15-jährige Patientin mit Hämoptysen, Husten sowie einem seitendifferenten Auskultationsbefund in der Notfallambulanz vor.
Keypoints
-
Pulmonale Karzinoide sind seltene Tumoren im Kindesalter, aber sie bilden mit den pleuropulmonalen Blastomen die häufigsten primären soliden pulmonalen Tumoren in dieser Altersklasse.
-
Bei Kindern überwiegen die typischen Karzinoide, die durch ihr endobronchiales Wachstum symptomatisch werden. Die Diagnose wird durch die unspezifische Symptomatik erschwert.
-
Aufgrund des neuroendokrinen Ursprungs kann es zu paraneoplastischen Syndromen kommen, dafür steht die spezifische radiologische und laborchemische Diagnostik zur Verfügung.
-
Die Therapie der Wahl ist die chirurgische Resektion des Tumors und der benachbarten Lymphknoten.
-
Hämoptysen stellen eine Notfallsituation dar, die eine weitere Abklärung erfordert.
-
Persistierende therapierefraktäre Atelektasen/Dystelektasen sollten zeitnah (innert <6 Monaten9) abgeklärt werden.
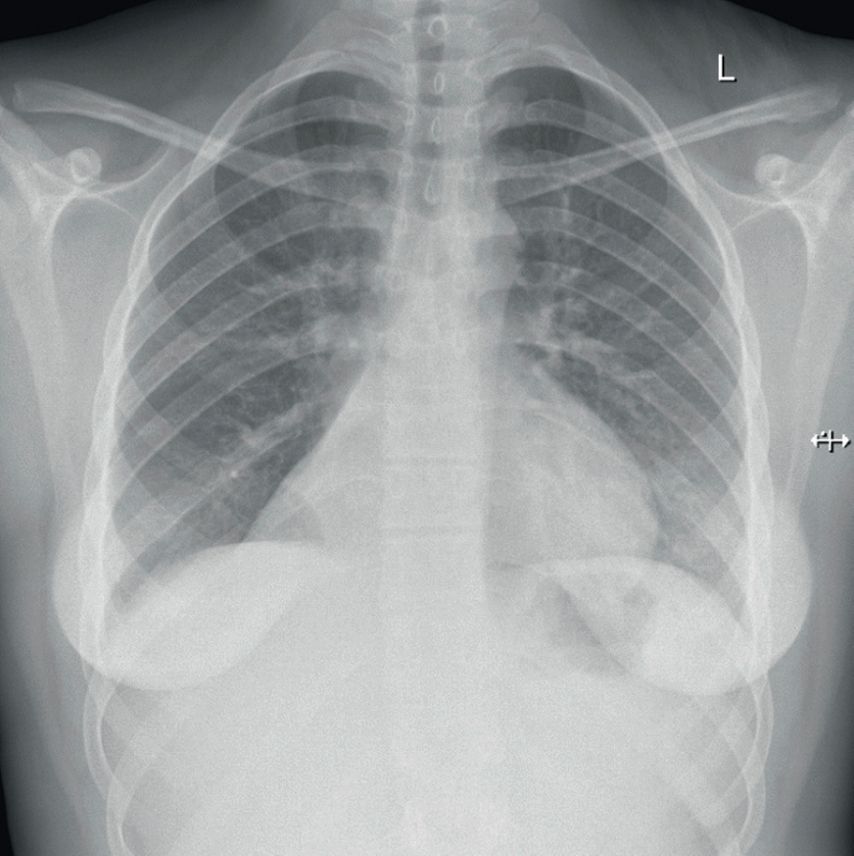
In der daraufhin angefertigten Röntgen-Thoraxaufnahme zeigten sich Zeichen einer zentralen Pneumonie sowie der Verdacht auf eine Komplettatelektase des rechten Unterlappens (Abb.1).
Zwei Jahre zuvor war die Patientin mit der gleichen Symptomatik in einer anderen Kinderklinik aufgenommen worden. Auch hier hatte sich in der radiologischen Diagnostik eine Atelektase im Bereich des rechten Unterlappens gezeigt. Die empfohlene weiterführende Diagnostik zur Abklärung des Befundes wurde damals nicht wahrgenommen.
Weitere diagnostische Abklärung
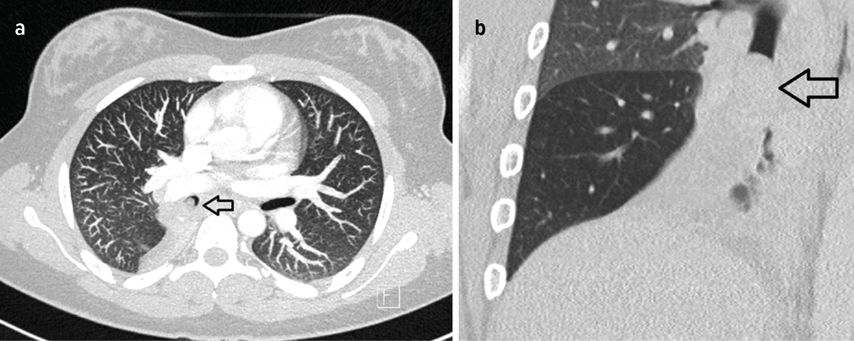
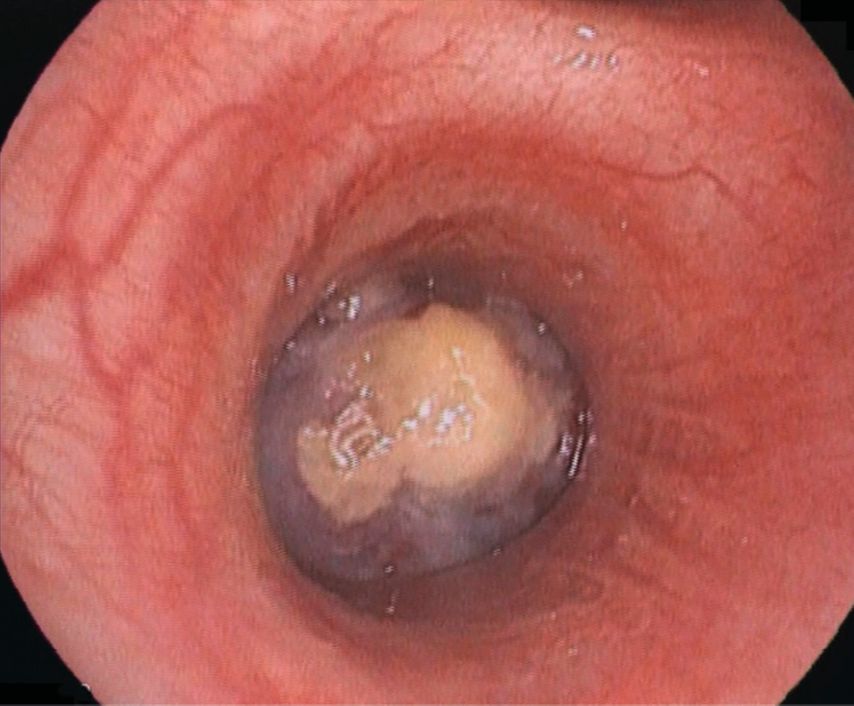
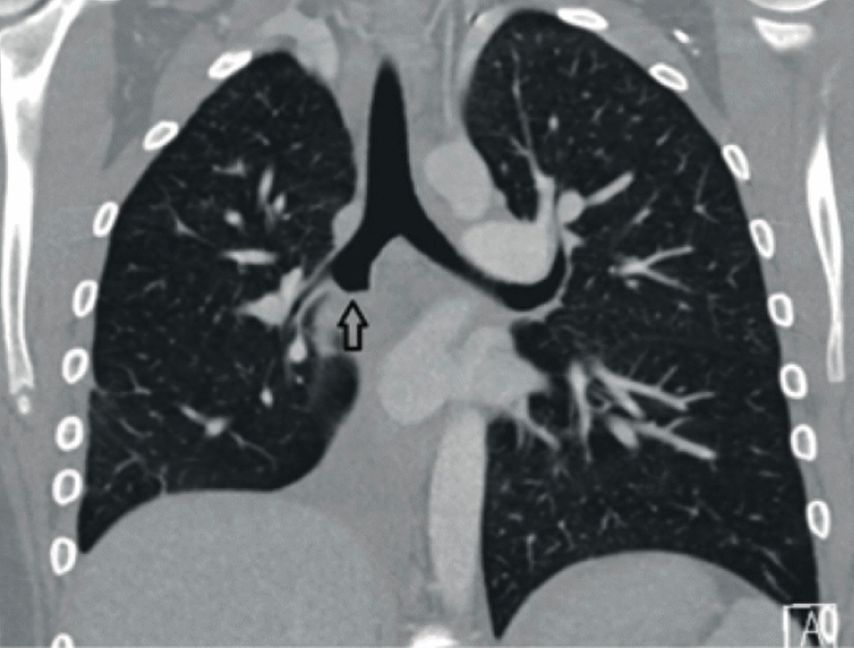
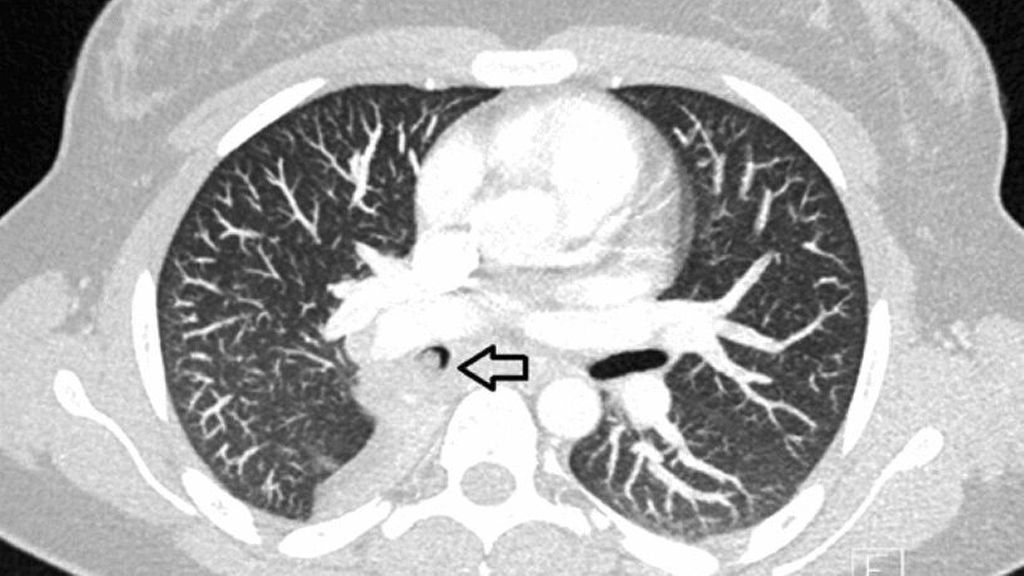
Bei der aktuellen Vorstellung wurde eine intravenöse antibiotische Behandlung initiiert, daraufhin sistierten die Hämoptysen. Thoraxsonografisch zeigte sich aber eine Persistenz der Unterlappenatelektase. In der daraufhin durchgeführten CT-Thoraxaufnahme ergab sich der Verdacht auf einen Komplettverschluss des distalen Anteils des rechten Bronchus intermedius (Abb. 2). Zur weiteren Abklärung des Befunds wurde eine flexible Bronchoskopie durchgeführt, hier zeigte sich der Befund einer endobronchialen Raumforderung (Abb. 3) mit Komplettverlegung des Bronchus, zudem waren in der endobronchialen Ultraschalluntersuchung (EBUS) suspekte Lymphknoten zu erkennen. In der gleichen Sitzung wurden aus Tumor und Lymphknoten Biopsien entnommen.
Abb. 2: a: CT-Thorax, Transversalschnitt, Tumor mit Pfeil markiert, b: CT-Thorax, Frontalschnitt, Tumor mit Pfeil markiert (rechte Lunge)
Abb. 3: Flexible Bronchoskopie, rechtsseitig, dendistalen Bronchus intermedius verlegender Tumor
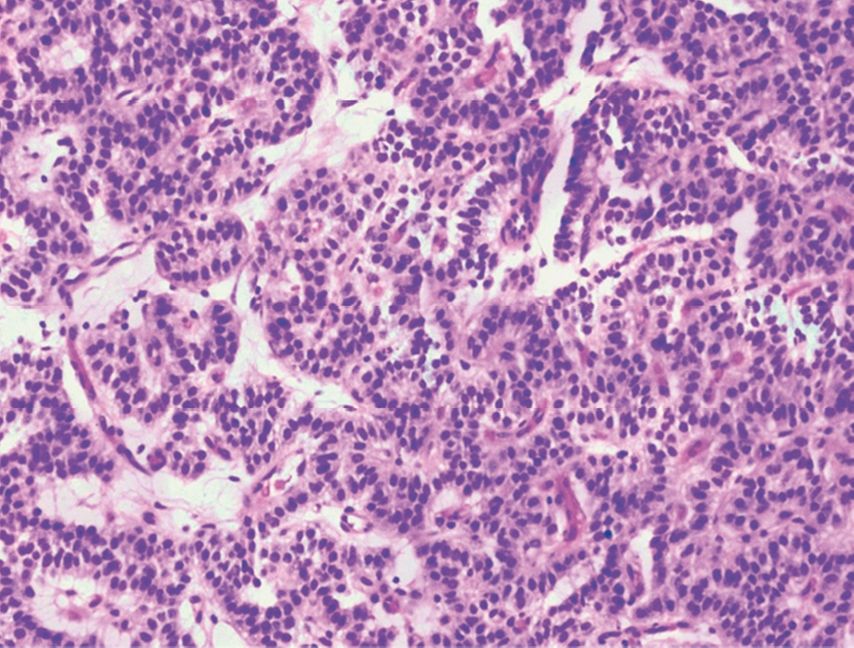
Der pathologische Befund der entnommenen Biopsien bestätigte die Verdachtsdiagnose eines typischen Karzinoid-Tumors (Abb. 4). Aus der laborchemischen Diagnostik sowie der klinischen Präsentation der Patientin ergab sich kein Hinweis auf ein begleitendes paraneoplastisches Syndrom.
Abb. 4: Histologie, HE-Färbung, 20-fach: typisches Karzinoid
Tumorresektion
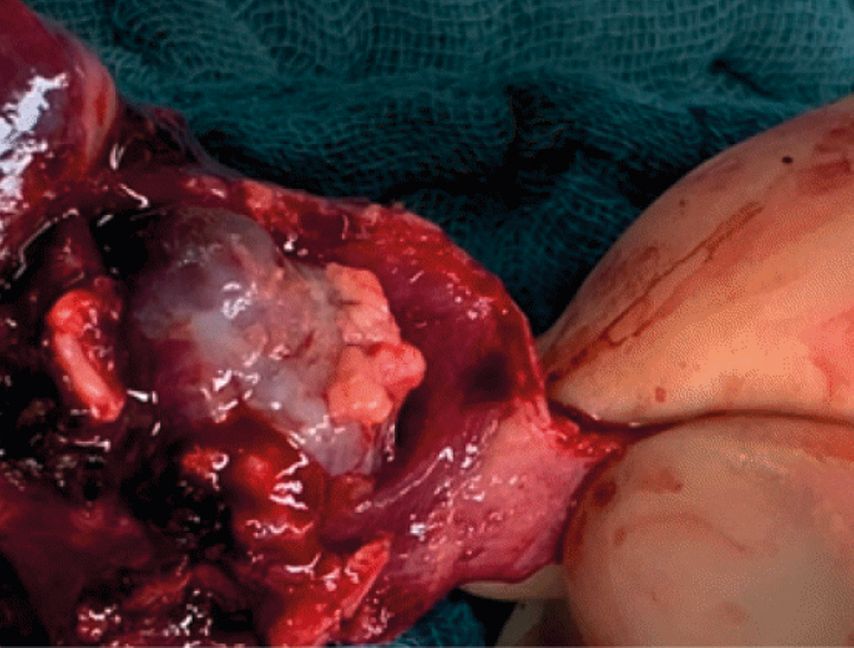
Aufgrund der Mitbeteiligung des rechten Mittellappenbronchus erfolgten in unserem Fall, bei suspekten Mediastinal-Lymphknoten, die komplikationslose Entfernung des rechten Mittel- und Unterlappens sowie eine mediastinale Lymphadenektomie (Abb. 5). Der postoperative Verlauf gestaltete sich komplikationslos. In den bisherigen Verlaufskontrollen zeigt sich kein Anhalt für ein Rezidiv (Abb. 6).
Diskussion
Pulmonale Karzinoide sind zwar seltene Tumoren im Kindesalter, jedoch mit einem Anteil von 63–80% die häufigsten soliden primären pulmonalen Malignome bei Kindern und Jugendlichen.1 Im Kleinkindalter überwiegen die pleuropulmonalen Blastome.2 Die respiratorischen Symptome (Husten, Hämoptysen, rekurrierende Infektionen, obstruktive Bronchopneumonien) sind oftmals unspezifisch und abhängig von der Grösse und Lokalisation des Tumors.3,4
Die im Kindesalter häufigeren zentralen Karzinoide werden meist durch ihr endobronchiales Wachstum symptomatisch, während die selteneren peripheren Karzinoide häufiger Zufallsdiagnosen sind.4,5 Es stehen z.B. durch die Empfehlungen der European Neuroendocrine Tumor Society (ENETS) Algorithmen für eine Stufendiagnostik zur Verfügung.6,7
Aufgrund des neuroendokrinen Ursprungs der Tumoren kann es durch die Sezernierung von ACTH und Serotonin zu paraneoplastischen Syndromen kommen (Karzinoid-Syndrom 0,7%, Cushing-Syndrom 1–6%).8 Es besteht eine Assoziation zum MEN-1-Syndrom.
Da die Tumoren Somatostatinrezeptoren tragen, stehen mit der Somatostatinrezeptor-PET/CT bzw. der Somatostatinrezeptorszintigrafie spezifische radiologische Methoden für Staging- und Verlaufsuntersuchungen zur Verfügung.5
Therapie- und Nachsorge-Empfehlungen
Die aktuelle Therapie der Wahl sind die vollständige chirurgische Resektion des Tumors sowie aufgrund des vermehrten Auftretens von Lymphknotenmetastasen in circa 27%2 die Resektion benachbarter Lymphknoten.
Nach kompletter Resektion bronchopulmonaler Karzinoide zeigen sich rezidivfreie 5-Jahres-Überlebensraten von über 80%. Dabei ist die Prognose abhängig von dem Differenzierungsgrad und der Lymphknotenmetastasierung. Typische Karzinoide haben mit einem 10-Jahres-Überleben von über 80% die beste Prognose.6
Die Empfehlungen der ENETS zur Nachsorge bestehen aus Bildgebung (CT) nach drei und sechs Monaten sowie jährlich für zwei weitere Jahre, dann im Verlauf Röntgen-Thoraxaufnahmen jährlich und CT alle drei Jahre sowie regelmässigen Bestimmungen des Chromogranin A.7
Dank:
Besonderer Dank gilt Dr. med. Tatjana Manuylova und Dr. med. Justus Lieber, Universitätsklinik Tübingen, für die Bereitstellung der Abbildungen 4 und 5.
Literatur:
1 Potter SL et al.: Pediatric bronchial carcinoid tumors: a case series and review of the literature. J Pediatr Hematol Oncol 2019; 41: 67-70 2 Dishop MK et al.: Primary and metastatic lung tumors in the pediatric population. A review and 25-year experience at a large children’s hospital. Arch Pathol Lab Med 2008; 132: 1079-1103 3 Moraes TJ et al.: Pediatric pulmonary carcinoid: a case report and review of the literature. Pediatr Pulmonol 2003; 35: 318-22 4 Eber M, Midulla F: ERS handbook Paediatric Respiratory Medicine. 2nd Edition. Sheffield: European Respiratory Society, 2021. 683-4 5 Prosch H: Pulmonale Karzinoide. Radiologe 2017; 57: 397-406 6 Kaifi JT: The diagnosis and treatment of bronchopulmonary carcinoid. Dtsch Arztebl Int 2015; 112: 479-85 7 Caplin ME: Pulmonary neuroendocrine (carcinoid) tumors: European Neuroendocrine Tumor Society expert consensus and recommendations for best practice for typical and atypical pulmonary carcinoids. Ann Oncol 2015; 26: 1604-20 8 Detterbeck FC: Management of carcinoid tumors. Ann Thorac Surg 2010; 89: 998-1005 9 Romagnoli V et al.: Middle lobe syndrome in children today. Paediatr Respir Rev 2014; 15: 188-93
Das könnte Sie auch interessieren:
Chronische Atemwegserkrankungen in einem sich verändernden Klima
Die global steigenden Temperaturen und zunehmenden Hitzewellen haben einen negativen Einfluss auf die Luftqualität, vor allem in Städten. Die Atemwege und die Lunge als Eintrittspforten ...
Pathobiologie und Genetik der pulmonalen Hypertonie
Für die 7. Weltkonferenz für pulmonale Hypertonie (World Symposium on Pulmonary Hypertension; WSPH) 2024 beschäftigten sich zwei Task-Forces aus 17 internationalen Experten allein mit ...