Interessante Daten zu neuen Therapieoptionen
Autor:innen:
Dr. med. Martina Bertschinger
Kantonsspital Winterthur
E-Mail: martina.bertschinger@ksw.ch
Prof. Dr. med. Urban Novak
Inselspital Bern
E-Mail: urban.novak@insel.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Am hämatologischen Jahreskongress der American Society of Hematology (ASH) wurden Updates von Studien wie TRIANGLE und POLARIX präsentiert, ohne dass sich hierbei grundlegende neue Aspekte ergeben hätten. Neue interessante Daten gab es unter anderem zur chemotherapiefreien Therapie bei Mantelzell- und follikulärem Lymphom und zu einem CD22-gerichteten CAR-T-Zell-Konstrukt.
Keypoints
-
Die Hinzunahme des monoklonalen Anti-CD19-Antikörpers Tafasitamab zu Lenalidomid und Rituximab führt zu einem verlängerten PFS bei rezidiviertem/refraktärem follikulärem Lymphom.
-
Ein PFS-Benefit durch die chemotherapiefreie Therapie mit Ibrutinib und Rituximab ist beim unbehandelten Mantelzelllymphom festzustellen.
-
Der Vorteil der Rituximab-Maintenance bei Patient:innen mit Mantelzelllymphom bestätigt sich.
-
Ein CD22-gerichtetes CAR-T-Zell-Konstrukt kann als Therapieansatz nach Versagen einer CD19-gerichteten CAR-T-Zell-Therapie eingesetzt werden.
Update der InMIND-Studie zur Therapie mit Tafasitamab
In der Late-Breaking-Abstract-Session präsentierte Laurie Sehn die Resultate der InMIND-Studie.1 Es handelt sich um eine doppelblinde, randomisierte, placebokontrollierte Phase-III-Studie. Eingeschlossen wurden Patient:innen mit follikulärem Lymphom Grad 1–3A oder Marginalzonenlymphom in gutem Allgemeinzustand (ECOG-PS 0–2) und mit mindestens einer vorhergegangenen Therapielinie, inklusive Anti-CD20-Antikörper. Die Stratifizierungsfaktoren waren Patient:innen mit Frührezidiven innerhalb von 24 Monaten (POD24), Refraktärität gegenüber Anti-CD20-Antikörpern und Anzahl vorhergegangener Therapielinien (1 vs. ≥2). Nach Randomisierung erhielten die Patient:innen in beiden Armen den Immunmodulator Lenalidomid (12 Zyklen) und Rituximab für 5 Zyklen als Standardtherapie.2 Im experimentellen Arm wurde zusätzlich Tafasitamab für 12 Zyklen verabreicht, der Kontrollarm erhielt Placebo. Der primäre Endpunkt war das progressionsfreie Überleben (PFS).
548 Patient:innen wurden eingeschlossen, in beiden Gruppen hatten zwei Drittel der Patient:innen ein follikuläres Lymphom Grad 1 oder 2, rund ein Drittel hatte ein POD24 nach der letzten Therapie.
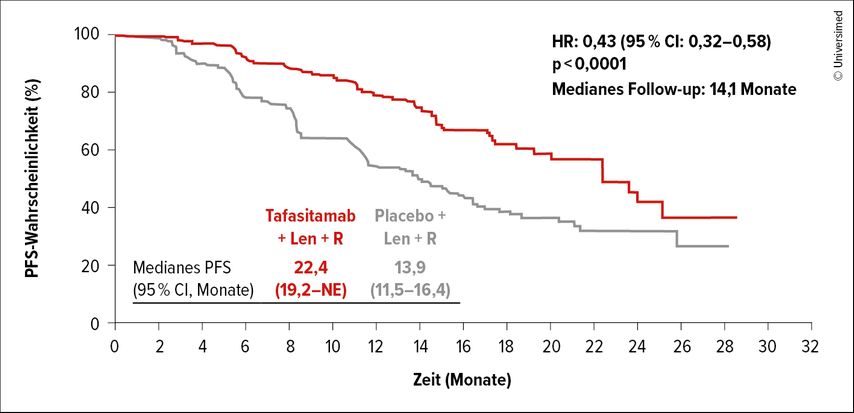
Der primäre Endpunkt, das mediane PFS, konnte mit der Hinzunahme von Tafasitamab signifikant verlängert werden (22,4 vs. 13,9 Monate, HR: 0,43, p<0,0001) (Abb. 1). Dieser Benefit war in allen Subgruppen vorhanden, inklusive der Hochrisikokategorien (POD24, refraktär auf Anti-CD20-Antikörper und ≥2 Therapielinien). Auch die sekundären Endpunkte, die Ansprechdauer (21,2 vs. 13,6 Monate, HR: 0,47, p<0,0001) und die Zeit bis zur nächsten Therapie (NR vs. 28,8 Monate, HR: 0,45, p<0,0001), waren signifikant länger. Bezüglich des medianen Gesamtüberlebens (OS) sind die Daten nicht reif.
Abb. 1: Kaplan-Meier-Kurve mit Darstellung des signifikant verlängerten PFS für Patient:innen mit r/r follikulärem Lymphom unter Lenalidomid/Rituximab plus Tafasitamab (mod. nach Sehn LH 2024)1
Die Kombination mit Tafasitamab war insgesamt gut verträglich (ähnliche Anzahl an Grad-1- oder -2-Nebenwirkungen). Im experimentellen Arm kam es häufiger zu Grad-3-Pneumonien (8,4 vs. 5,1%) und Covid-19 (5,8 vs. 2,2%).
Zusammengefasst konnte in der placebokontrollierten Phase-III-Studie InMIND eine signifikante Verlängerung des PFS bei guter Verträglichkeit gezeigt werden. Diese Kombination könnte daher zu einem neuen Standard in der Rezidivtherapie des follikulären Lymphoms ab der zweiten Linie werden.
Chemotherapiefreie Kombinationstherapie beim unbehandelten Mantelzelllymphom
In Phase-III-Studien wie TRIANGLE3 oder SHINE4 wurde gezeigt, dass Bruton-Tyrosinkinase-Inhibitoren (BTKi) hochwirksame Medikamente in der Therapie des Mantelzelllymphoms sind.
Die ENRICH-Studie verglich randomisiert das chemotherapiefreie Regime Ibrutinib und Rituximab mit gängigen Immun-Chemotherapie-Kombinationen.5
Eingeschlossen wurden Patient:innen >60 Jahre mit gutem Performance-Status (ECOG 0–2), welche für eine Hochdosistherapie mit autologer Stammzelltransplantation (HD mit ASCT) ungeeignet waren. Der Standardarm bestand aus einer Rituximab-Chemotherapie-Kombination (R-CHOP oder R-Bendamustin), gefolgt von einer Rituximab-Maintenance für zwei Jahre. Im experimentellen Arm erhielten die Patient:innen Ibrutinib plus Rituximab (alle zwei Monate) für zwei Jahre gefolgt von Ibrutinib bis zum Progress.
Insgesamt wurden 397 Patient:innen in die Studie eingeschlossen. Das mediane Alter in beiden Gruppen betrug 74 Jahre. Die Hochrisikomerkmale (blastoide Histologie, hoher Ki-67 und TP53-Mutation) waren zwischen den zwei Gruppen ausgeglichen verteilt.
Nach einem medianen Follow-up von 47,9 Monaten konnte ein signifikant verlängertes PFS für die experimentelle im Vergleich zur Kontrollgruppe gezeigt werden (65,3 vs. 42,4 Monate, HR: 0,69, p=0,003). Interessanterweise wird dieser Unterschied aber vor allem durch die Population getragen, die mit R-CHOP behandelt wurde (5-Jahres-PFS 52,4% vs. 19,2%, HR: 0,37). Das PFS der Patient:innen, die mit Rituximab und Bendamustin behandelt wurden, unterschied sich nicht von dem der Gruppe, die mit Ibrutinib und Rituximab behandelt wurde (5-Jahres-PFS: 50,8% vs. 47,4%).
In der Subgruppe der blastoiden Mantelzelllymphome zeigte sich ein kürzeres PFS (6,9 vs. 21,1 Monate, HR: 2,33) für die Rituximab/Ibrutinib-Therapie, in der Subgruppe der TP53-mutierten Mantelzelllymphome ein Vorteil für die Rituximab/Ibrutinib-Kombination (18,5 vs. 8,9 Monate, HR: 0,77). Die 5-Jahres-OS-Rate zeigte keinen Unterschied zwischen Ibrutinib/Rituximab-Therapie und R-Chemotherapie (57,7 vs. 54,45%).
Rituximab-Maintenance bei neu diagnostiziertem Mantelzelllymphom
Beim neu diagnostizierten Mantelzelllymphom verlängerte eine Rituximab-Erhaltung nach Cytarabin-haltiger Induktion und HD mit ASCT nicht nur das PFS, sondern auch das Gesamtüberleben,6 wobei dieser Vorteil in der Langzeitanalyse nur noch für das PFS erhalten blieb.7
Am diesjährigen ASH wurden Daten der Patient:innen präsentiert, die im Rahmen der TRIANGLE-Studie behandelt worden waren,3 wobei die Rituximab-Maintenance separat untersucht worden war.8 Eine Rituximab-Maintenance (alle zwei Monate für drei Jahre) war in allen drei Armen (Arm I: Ibrutinib-R-CHOP/R-DHAP + Ibrutinib-Maintenance; Arm A+ I: Ibrutinib-R-CHOP/R-DHAP plus ASCT + Ibrutinib-Maintenance, Arm A: R-CHOP/R-DHAP + HD und ASCT) gemäss lokalen Richtlinien empfohlen.
In die retrospektive Studie wurden alle Patient:innen eingeschlossen, die nach der Induktion bzw. der Konsolidierung eine Remission erreicht hatten. In den verschiedenen Studienarmen starteten 59% (I), 64% (A+I) und 67% (A) eine Rituximab-Erhaltung. Nach einem medianen Follow-up von vier Jahren und einer Rituximab-Erhaltung von median 26 (Arm I) bzw. 30 Monaten (Arme A+I und A) konnte ein signifikant längeres PFS mit der Rituximab-Maintenance in allen drei Armen (HR Arm I: 0,50, A+I: 0,26, A: 0,29) erreicht werden. Die 4-Jahres-PFS-Raten lagen bei 86% vs. 76% (Arm I), 89% vs. 75% (Arm A+I) und 83% vs. 54% (Arm A). Die Rituximab-Maintenance war mit einer erhöhten Rate an Grad-3-Infekten assoziiert. Die Autor:innen folgerten, dass eine Erhaltungstherapie mit Rituximab auch nach vorgängiger Ibrutinib-Therapie einen PFS-Benefit erreicht.
CD-22-gerichtetes CAR-T-Zell-Konstrukt nach Versagen einer CD19-gerichteten CAR-T-Zell-Therapie
Die verfügbaren CD19-gerichteten CAR-T-Zell-Therapien bei grosszelligen Lymphomen sind sehr effektiv und können nach Versagen der Immun-Chemotherapien bei ca. 40–50% der Patient:innen eine Langzeitremission bewirken. Die Optionen beim Rückfall nach einer Anti-CD19-CAR-T-Zell-Therapie sind limitiert.
In die akademische Phase-I-Studie mit dem anti-CD22-gerichteten CAR-T-Zell-Konstrukt Firicabtagene Autoleucel wurden 38 Patient:innen mit r/r grosszelligem Lymphom mit Rezidiv nach CD19-CAR-T-Zell-Therapie oder fehlender CD19-Expression eingeschlossen.9 CAR-T-Zellen wurden in zwei Dosen (1 und 3 Millionen CAR22-positive T-Zellen pro Kilogramm) getestet. Endpunkte waren der Erfolg der Herstellung, die Sicherheit und die dosislimitierende Toxizität.
Die Patient:innen waren mit median vier Vortherapien inklusive einer CD19-CAR-T-Zell-Therapie stark vorbehandelt. Nach einem medianen Follow-up von 36,7 Monaten betrug die Gesamtansprechrate 68% und die Rate an kompletten Remissionen (CR) 53%. Die empfohlene Dosis für die Phase-II-Studie wurde bei 1 Million CAR22-positiver T-Zellen pro Kilogramm festgelegt. Die mediane Ansprechzeit (DOR) lag bei 23,2 Monaten und wurde von Patient:innen mit einer kompletten Remission nicht erreicht. Die 3-Jahres-PFS-Rate lag bei 30% und die 3-Jahres-OS-Rate bei 41%. Es wurde über keine schweren Zytokin-Release-Syndrome (CRS) oder Immuneffektorzell-assoziierte Neurotoxizitätssyndrome (ICANS) berichtet. Bei vier Patient:innen (11%) kam es zu sekundären myeloiden Neoplasien, wobei der kausale Zusammenhang mit dem CAR22-Produkt nicht klar ist. Aufgrund des Nebenwirkungsprofils wurde die Phase-II-Studie jedoch gestoppt.
Literatur:
1 Sehn LH et al.: ASH 2024; Abstr. #LBA-1 2 Leonard JP et al.: J Clin Oncol 2019; 37(14): 1188-99 3 Dreyling M et al.: Lancet 2024; 403(10441): 2293-306 4 Wang ML et al.: N Engl J Med 2022; 386(26): 2482-94 5Lewis DJ et al.: ASH 2024; Abstr. #235 6Le Gouill S et al.: N Engl J Med 2017; 377(13): 1250-60 7 Sarkozy C et al.: J Clin Oncol 2023; 42(7): 769-73 8 Ladetto M et al.: ASH 2024; Abstr. #237 9 Kramer AM et al.: ASH2024; Abstr. #69
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
AxSpA: Kommunikation ist essenziell für gute Diagnosestellung und Therapie
Die axiale Spondyloarthritis (axSpA) präsentiert sich klinisch heterogen. Es treten sowohl muskuloskelettale Manifestationen auf als auch extramuskuloskelettale wie Uveitis, Psoriasis ...
Heilung für das multiple Myelom?
Fortschritte des Wissens zur Pathogenese des multiplen Myeloms (MM) und die davon abgeleitete Entwicklung neuer Behandlungsformen haben zu einer signifikanten Steigerung des Überlebens ...