Rehabilitation von Arm-Hand-Paresen nach einem Schlaganfall
Autor:
Dr. Klemens Fheodoroff
Abteilung für Neurologische Rehabilitation
KABEG Gailtal-Klinik
Hermagor
E-Mail: klemens.fheodoroff@kabeg.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Zu den häufigsten Langzeitfolgen nach einem Schlaganfall gehören Lähmungen und Störungen des Arm-Hand-Gebrauchs. Wie stark deren Beeinträchtigung sechs Monate nach einem Schlaganfall ausfällt, lässt sich unter anderem an der Kontrolle von Willkürbewegungen der Schulter und der Fingerstreckung in den ersten Tagen festmachen. Verschiedenste Behandlungsstrategien können helfen, Arm-Hand-Paresen effektiv zu rehabilitieren, wenn sie ziel- und stadiengerecht eingesetzt werden.
Keypoints
-
Arm-Hand-Paresen gehören zu den häufigsten Langzeitfolgen nach Schlaganfall und zu den bedeutsamen Prädiktoren der langfristigen Behinderung.
-
Die Kontrolle von einfachen Willkürbewegungen (Schulterabduktion und Fingerextension) 72 Stunden bzw. 7 Tage nach einem ersten Schlaganfall hat sich als wichtiges Prognosekriterium herauskristallisiert.
-
Wenn keine Bewegungskontrolle vorhanden ist, muss besonderes Augenmerk auf den schonenden Umgang mit dem gelähmten Arm gelegt werden, um Schmerzen und Gelenksschäden (Kontrakturen) zu verhindern.
-
Auch im chronischen Stadium (länger als 6 Monate nach Schlaganfall) sind einzelne Behandlungsformen zum Erreichen individueller Therapieziele wirksam und sollten daher angeboten werden.
Ist die Kontrolle von einfachen Willkürbewegungen (Schulterabduktion und Fingerextension) 72 Stunden bzw. 7 Tage nach einem ersten Schlaganfall erhalten, kann von einer guten Erholung der Arm-Hand-Aktivitäten (greifen, loslassen, nach etwas langen etc.) ausgegangen werden. Umgekehrt ist das Fehlen dieser Bewegungskontrolle mit einem 13-fach erhöhten Risiko für die Entwicklung einer spastischen Bewegungsstörung („spastic movement disorder“, SMD) assoziiert.1,2
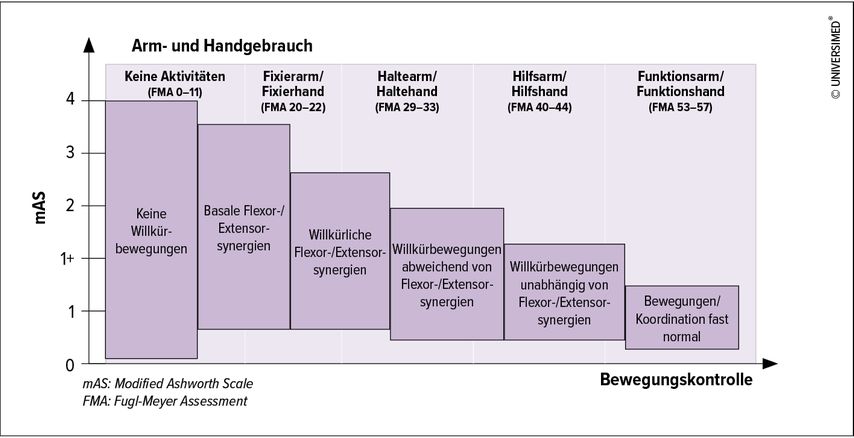
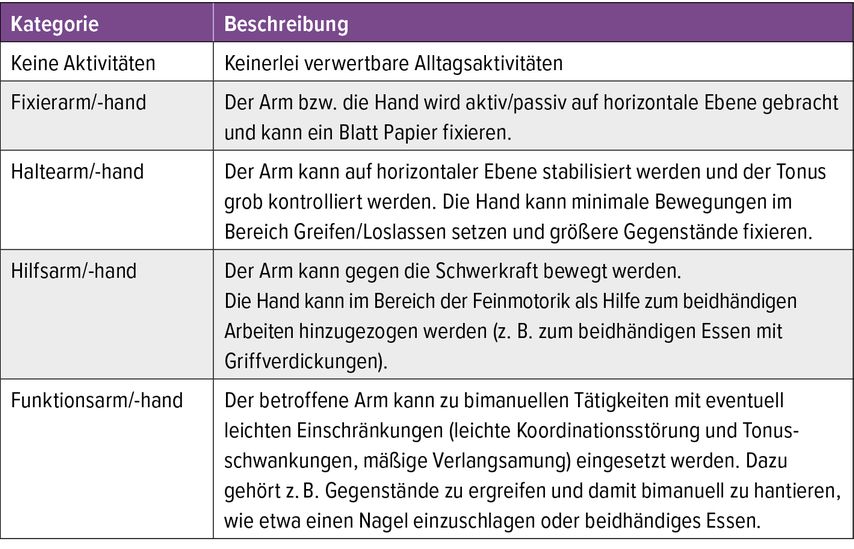
Zur Erfassung der Arm-Hand-Aktivitäten wurden 5 Kategorien vorgeschlagen. Sie wurden mit Cut-off-Werten aus der Arm-Section des Fugl-Meyer Assessment (FMA-AS) korreliert, des gebräuchlichsten Verfahrens zur Erfassung von Bewegungskontrolle bei zentralen Lähmungen (keine Bewegungskontrolle, mit Synkinesien oder annähernd normale Willkürbewegungen).3,4 In Abbildung 1 wird das Zusammenspiel von Muskeltonus, Bewegungskontrolle und Arm-Hand-Aktivitäten dargestellt.
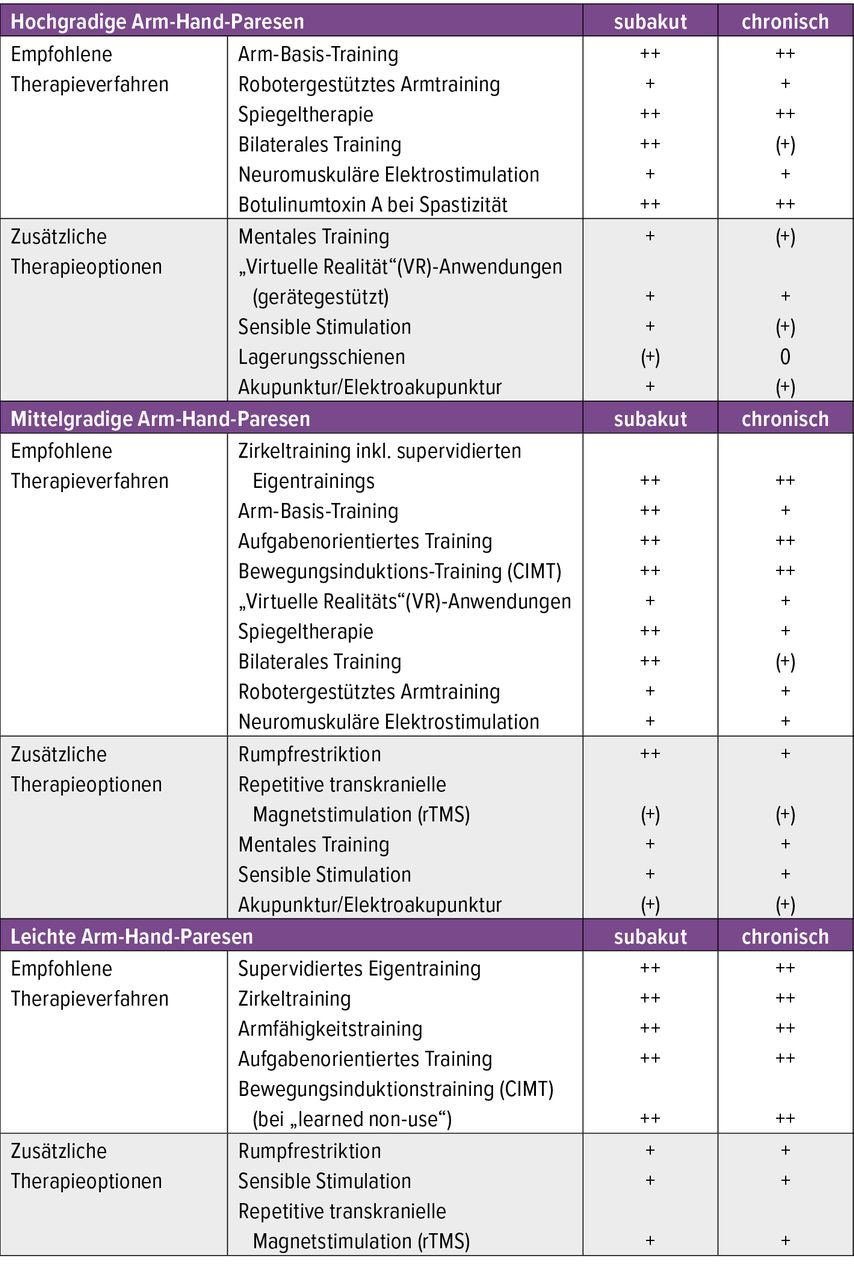
Die Behandlungsziele variieren je nach dem Grad der Kontrolle von Willkürbewegungen und der Zeit, die seit dem Schlaganfall vergangen ist, sowie den vorhandenen Begleitstörungen. Werden unterschiedliche Behandlungsziele verfolgt, so kommen dementsprechend verschiedene Behandlungsstrategien zum Einsatz. Eine detaillierte Auflistung der Empfehlungen zur Behandlung von Arm-Hand-Paresen abhängig vom Schweregrad findet sich in Tabelle 1. Deren Evidenz wurde 2020 in einer S3-Leitlinie der Deutschen Gesellschaft für Neurorehabilitation (DGNR) bewertet.5 Neben Schwere und Chronizität der Lähmung wurden die Art, die Intensität, die Dauer und die Verteilung der Behandlungen in ihren Auswirkungen auf unmittelbare und anhaltende Therapieeffekte bewertet. Dabei hat sich gezeigt, dass unterschiedliche Therapieverfahren in Studien zu ähnlichen Ergebnissen führten. Klar herauskristallisiert hat sich mittlerweile, dass die Prinzipien des motorischen Lernens den klassischen Behandlungsschulen (Bobath, PNF) überlegen sind.
Tab. 1: Empfohlene und zusätzliche Therapieoptionen zur Behandlung von Arm-Hand-Paresen nach Schlaganfall abhängig von deren Schweregrad
Behandlung abhängig vom Schweregrad der Paresen
Wenn keine Bewegungskontrolle vorhanden ist, muss besonderes Augenmerk auf den schonenden Umgang mit dem gelähmten Arm gelegt werden, um die Entwicklung von Schmerzen und Gelenksschäden (Kontrakturen) sowie eines komplexen regionalen Schmerzsyndroms (CRPS-Typ 1 mit Handödem, Überwärmung und Schmerzen) möglichst hintanzuhalten. Zusätzlich sollten sensible (thermische, elektrische und durch Vibration induzierte) Stimulationsverfahren, Spiegeltherapie, (zyklische) Elektrostimulation und – bei Entwicklung einer spastischen Bewegungsstörung – Botulinumtoxin-A-Injektionen in die spastischen Muskeln zur Anwendung kommen. Damit kann die Beweglichkeit im behandelten Bewegungssegment erhalten und eine tonisch gehemmte Bewegungskontrolle der Antagonisten für einen Zeitraum von ca. 3 Monaten aktiviert werden („therapeutisches Fenster“).
Auch im Langzeitverlauf hat sich die Behandlung mit Botulinumtoxin als sicheres und effektives Verfahren zur Behandlung der fokalen Spastizität etabliert.6,7 Umdie rein pharmakologische Wirkung zu verlängern, sollten Dehnungen, Lagerungen und Aktivierung von Willkürbewegungen in die tägliche Routine integriert werden.
Kontrolle von Willkürbewegungen als Basis für Arm-Hand-Aktivitäten
Bei erhaltener Bewegungskontrolle gilt es, die Arm-Hand-Aktivitäten durch repetitives Üben und durch aufgabenorientiertes Training (evtl. mit Rumpfrestriktion zur Verhinderung von Ausweichbewegungen) auszubauen. Die Trainingsintensität sollte mindestens 90–270 Minuten pro Woche betragen. Unterstützend können robotergestützte Verfahren, VR (virtuelle Realität)-Anwendungen und (funktionelle) Elektrostimulation in das Training eingebaut werden. Auch eine repetitive transkranielle Magnetstimulation (rTMS) kann bei entsprechender Erfahrung zur Anwendung kommen: entweder als inhibitorische niederfrequente 1-Hz-Stimulation des kontraläsionalen motorischen Kortex oder als hochfrequente Stimulation des ipsiläsionalen motorischen Kortex (3, 5, 10 oder 20Hz) z.B. für 5 Tage. Die Kombination beider Stimulationsverfahren wird außerhalb von Studienprojekten nicht empfohlen.
Bei erlerntem Nichtgebrauch der gelähmten Hand trotz erhaltener Bewegungskontrolle sollte ein Bewegungsinduktionstraining („constraint-induced movement therapy“, CIMT) durchgeführt werden. Dabei wird der Gebrauch des nicht betroffenen Armes durch einen gepolsterten Handschuh („constraint“) unterbunden. Mit den Betroffenen werden Trage- und Trainingszeiten, Ausnahmen zum Abnehmen des Handschuhs sowie ein tägliches Selbst-Monitoring der festgelegten Aufgaben und Handlungen (z.B. Lichtschalter betätigen; Türe öffnen, Telefonnummer wählen usw.) schriftlich vereinbart. Der Gebrauch der gelähmten Hand wird dadurch intensiv gefördert.
Robuste Evidenz für gerätegestützte Therapieverfahren
Um der reduzierten Ausdauer bei entsprechender Bewegungskontrolle entgegenzuwirken, kann eine neuromuskuläre (Mehrkanal-)Elektrostimulation (FES) eingesetzt werden. Um entsprechende Effekte im Arm-Hand-Gebrauch zu erzielen, sind allerdings Trainingszeiten von 1–2 Stunden pro Tag – unter Berücksichtigung der gerätespezifischen Kontraindikationen – erforderlich. Oberflächenelektroden werden als ausreichend beurteilt; implantierbare Elektroden für die Unterarmextensoren sollten nicht eingesetzt werden.
Mittlerweile liegt eine robuste Evidenz zum Einsatz von roboter- bzw. gerätegestützten Verfahren vor. Damit kann sowohl die Anzahl der (passiven, assistierten und aktiven) Bewegungswiederholungen erhöht als auch den Betroffenen ein Feedback zur Durchführung der Bewegungen und zum Ergebnis des Trainings geliefert werden. Auch für VR-Anwendungen wurden mittlerweile Verfahren entwickelt, die sowohl im Gruppensetting („Armstudio“) als auch im Heimtraining eingesetzt werden können. Erste Metaanalysen sind Erfolg versprechend.8
Kontinuierliche Behandlung auch im chronischen Stadium
Das Training der Kontrolle von Arm- und Handbewegungen sollte bereits in den ersten Tagen nach einem Schlaganfall starten, wenn es der klinische Zustand zulässt. Ab Tag 7 sollte das Training auf mindestens 5x 30 Minuten pro Woche gesteigert werden, um nachhaltige Therapieeffekte zu erzielen. Für die Stabilisierung der erreichten Ziele sollten einfache Dehnungs- und Bewegungsübungen als Selbstübungsprogramm in die tägliche Routine integriert werden. Auch im chronischen Stadium (länger als 6 Monate nach Schlaganfall) sind einzelne Behandlungsformen zum Erreichen individueller Therapieziele wirksam und sollten daher angeboten werden.5
Neben einer kontinuierlichen wohnortnahen Begleitung sind stationäre Wiederholungsbehandlungen in spezialisierten Reha-Zentren sinnvoll. Sie dienen der Überprüfung und Erweiterung der Ziele im Arm-Hand-Gebrauch (Tab. 2), der Auffrischung des Übungsprogrammes sowie der Anpassung und Überprüfung von Hilfsmitteln.
Wenn keine andere Therapie in ausreichender Intensität möglich ist, kann ein Training mit pflegenden Personen oder Angehörigen unter therapeutischer Supervision als Therapieoption erwogen werden. Möglicherweise werden Tele-Rehabilitationsverfahren in absehbarer Zukunft einen wichtigen Beitrag zur Optimierung der Heimtherapie leisten. Derzeit ist die Datenlage allerdings noch nicht ausreichend, um die technische Machbarkeit und die Präferenzen der Betroffenen und Angehörigen ausreichend beurteilen zu können.
Zusammenfassend kann gesagt werden, dass die Kenntnisse über die stadiengerechte Behandlung von Arm-Hand-Paresen zugenommen haben. Mittelfristig sollte die Erfassung des Schweregrades von Arm-Hand-Paresen standardisiert und die Kontrolle von Willkürbewegungen als Basis der Handlungskompetenz verankert werden. Auch eine Standardisierung von Zielen zu Arm-Hand-Aktivitäten wäre wünschenswert.
Literatur:
1 Houwink A et al.: Functional recovery of the paretic upper limb after stroke: who regains hand capacity? Arch Phys Med Rehabil 2013; 94(5): 839-44 2 Nijland RH et al.: Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke 2010; 41(4): 745-50 3 Woodbury ML et al.: Rasch analysis staging methodology to classify upper extremity movement impairment after stroke. Arch Phys Med Rehabil 2013; 94(8): 1527-33 4 Berger M et al.: Evaluating the comprehensibility of the Arm-Hand-Activity-Scale (AHAS-German version) as part of establishing psychometric quality criteria, in: Dettmers C et al. (Hg.): 5th European Congress of Neurorehabilitation (ECNR) 2019, Budapest: 50 5 Platz T et al.: Rehabilitative Therapie bei Armparese nach Schlaganfall. S3-Leitlinie 2020; AWMF-Register Nr. 080/003: https://www.awmf.org/leitlinien/detail/ll/080-001.html 6 Turner-Stokes L et al.: Longitudinal goal attainment with integrated upper limb spasticity management including repeat injections of botulinum toxin A: Findings from the prospective, observational Upper Limb International Spasticity (ULIS-III) cohort study. J Rehabil Med 2021; 53(2): jrm00157 7 Simpson DM et al.: Practice guideline update summary: Botulinum neurotoxin for the treatment of blepharospasm, cervical dystonia, adult spasticity, and headache: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology 2016; 86(19): 1818-26 8 Jin M et al.: Effects of virtual reality in improving upper extremity function after stroke: A systematic review and meta-analysis of randomized controlled trials. Clin Rehabil 2022; 36(5): 573-96
Das könnte Sie auch interessieren:
Menschen mit Demenz: Was beeinflusst deren Überleben nach Diagnosestellung?
Verschiedenste Faktoren beeinflussen die Überlebenszeit nach einer Demenzdiagnose. Das Wissen um Risikofaktoren zum Zeitpunkt der Diagnose einer Demenzerkrankung oder in deren Verlauf ...
Alzheimer: Was gibt es Neues in der Biomarker-Entwicklung?
Schätzungen zufolge leben in Österreich 115000 bis 130000 Menschen mit einer Form der Demenz. Eine Zahl, die sich bis zum Jahr 2050 verdoppeln wird.1 Antikörper-Wirkstoffe könnten in der ...
Kappa-FLC zur Prognoseabschätzung
Der Kappa-freie-Leichtketten-Index korreliert nicht nur mit der kurzfristigen Krankheitsaktivität bei Multipler Sklerose, sodass er auch als Marker zur Langzeitprognose der ...