Biomarkertestung auf dem Weg in die Zukunft
Redaktion:
Dr. med. Judith Moser
Autorin:
Prof. Dr. med. Anne Maria Schultheis
Institut für Klinische Pathologie Universitätsklinikum Freiburg
Deutschland
Die Erfassung von Biomarkern bildet ein zentrales Tool in der Therapie des Lungenkarzinoms. Mittlerweile erfolgt die Testung auch in frühen Stadien und ermöglicht bei metastasierter Erkrankung eine wachsende Vielfalt an Therapieoptionen. Herausforderungen im klinischen Alltag und offene Fragen unterstreichen die Notwendigkeit einer kontinuierlichen Optimierung.
Das nichtkleinzellige Lungenkarzinom (NSCLC) ist das Paradebeispiel einer Erkrankung, die basierend auf den Prinzipien der Präzisionsmedizin diagnostiziert und behandelt wird. Angesichts der hohen Rezidivraten selbst in den frühen Stadien der Erkrankung hat die Präzisionsmedizin auch in diesen Bereiche Einzug gehalten. Somit erfolgt die Testung von Biomarkern sowohl beim operablen Lungenkarzinom als auch in den Stadien III und IV.
Neoadjuvantes und adjuvantes Setting
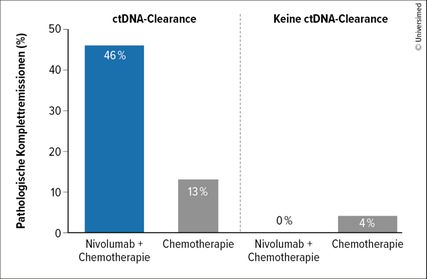
Abb. 1: Pathologische Komplettremissionen je nach ctDNA-Clearance in CheckMate 816 (modifiziert nach Forde PM et al.)2
Basierend auf der Checkmate-816-Studie wurde neoadjuvantes Nivolumab in Kombination mit Chemotherapie beim resektablen, PD-L1-exprimierenden NSCLC mit hohem Rezidivrisiko zugelassen.1,2 Im Rahmen der Studie erfolgte die Evaluierung verschiedener Biomarker, zu denen Tumormutationslast, PD-L1-Expression und zirkulierende Tumor-DNA (ctDNA) zählten. Wie sich zeigte, war nur die PD-L1-Expression ≥1% für das Überleben prädiktiv. Zwischen der ctDNA-Clearance und der Rate an pathologischen Komplettremissionen bestand eine Korrelation (Abb. 1), weshalb aktuell Forschungen auf Hochtouren laufen, um den Stellenwert der ctDNA-Analyse weiter zu erkunden. Auf dem Gebiet der zielgerichteten Therapien existieren noch keine Zulassungen in der neoadjuvanten Situation. Osimertinib wird in NeoADAURA bei EGFR-positiven resektablen Tumoren untersucht (NCT04351555), und weitere klinische Studien laufen aktuell.
In der adjuvanten Situation konnte die Immuntherapie mit Atezolizumab bzw. Pembrolizumab, basierend auf den Studien IMpower010 und PEARLS/KEYNOTE-091, als Standard etabliert werden.3,4 Allerdings liessen die beiden Studien einheitliche Vorgaben in Bezug auf die Biomarkertestung (PD-L1, ALK, EGFR) vermissen. Beim EGFR-mutierten NSCLC konnte die ADAURA-Studie klinische Vorteile durch adjuvantes Osimertinib nachweisen.5 Aufgrund dessen ist die Erfassung des EGFR-Mutationsstatus beim frühen NSCLC unabdingbar. Dies gilt auch für die Testung von ALK-Rearrangements, da die Daten aus der ALINA-Studie den Benefit von adjuvant verabreichtem Alectinib belegen.6 Um die Vorteile der neoadjuvanten und der adjuvanten Therapie zu verbinden, wird derzeit die perioperative Behandlungsstrategie klinisch erprobt. Die Biomarkertestung ist in diesem Setting jedoch noch nicht gut etabliert.
Hilfestellung durch KI
Eine spezielle Herausforderung für Patholog:innen ergibt sich aus der akkuraten Evaluierung der PD-L1-Expression. Scores und Cut-offs müssen Berücksichtigung finden, und die enorme Heterogenität dieses Parameters ist zu beachten. Künstliche Intelligenz wird sicher in naher Zukunft dazu beitragen, die Abläufe zu verbessern. Auch die Bewertung der Tumorregression infolge der neoadjuvanten Therapie stellt keine einfache Aufgabe dar, hier helfen jedoch etablierte Kriterien, die von der International Association for the Study of Lung Cancer definiert wurden.7 Allerdings ist sicherzustellen, dass alle Patholog:innen diese Kriterien bei der Evaluierung von Proben nach einer neoadjuvanten Behandlung auch tatsächlich anwenden.
Insgesamt lässt sich festhalten, dass die Biomarkertestung in den Bereich des frühen Lungenkarzinoms vorgedrungen ist. Das Panel sollte mindestens die PD-L1-Expression sowie den ALK- und EGFR-Status beinhalten. Ob eine umfassende Testung bereits zum Diagnosezeitpunkt eines frühen Lungenkarzinoms empfehlenswert ist, steht zur Diskussion.
Im äusserst heterogenen Stadium III liegt nur wenig Evidenz für eine biomarkerbasierte Behandlung vor, weshalb Entscheidungen interdisziplinär gefällt werden sollten. Ein Beispiel für eine erfolgreiche biomarkergestützte Therapie liefert die LAURA-Studie zum Einsatz von Osimertinib nach der Chemoradiotherapie resektabler, EGFR-mutierter Tumoren.8 Beim Monitoring des Ansprechens auf die konsolidierende Immuntherapie im Stadium III könnte die ctDNA-Analyse zu einem wertvollen Tool avancieren.9
Stolpersteine im Stadium IV
Für das grosse Kollektiv der Patient:innen im Stadium IV steht eine ständig anwachsende Gruppe an zielgerichteten Therapien zur Verfügung. Patholog:innen sind hier mit der Schwierigkeit konfrontiert, kleine Gewebsbiopsien unter Zeitdruck mit mehreren Assays untersuchen zu müssen. Als zeit- und gewebssparend erweisen sich panelbasierte Methoden, die «Fast track»-Strategien beinhalten, in deren Rahmen die wichtigsten Marker für die Erstlinientherapie innerhalb von 1–3 Tagen erfasst werden.10
Spezielle Aufmerksamkeit wurde erst in letzter Zeit beispielsweise den EGFR-Exon-20-Insertionen und den HER2-Mutationen zuteil, da mittlerweile zielgerichtete Medikamente zur Verfügung stehen. Im Bereich der Checkpoint-Inhibitoren sind PD-L1-Expression und Tumormutationslast im Hinblick auf die Prädiktion bekanntermassen keine perfekten Marker. Kombinationen der STK11-, KEAP1- und KRAS-Mutationen konnten mit einem verminderten Ansprechen auf die Immuntherapie in Verbindung gebracht werden.11
Die grösste Herausforderung im Kontext der Präzisionsmedizin resultiert aus der Tatsache, dass ein substanzieller Teil der Patient:innen mit NSCLC gar keine Testung erhält bzw. auch bei Vorliegen eines Testergebnisses nicht immer eine entsprechende zielgerichtete Therapie bekommt.12 In Deutschland wurde ein breites Netzwerk implementiert, innerhalb dessen alle Patient:innen mit NSCLC getestet werden können. Leider ist die Notwendigkeit der Testung vor allem in den frühen Stadien unzureichend bekannt, was sich in noch immer niedrigen Testraten widerspiegelt.13
Fazit
Zusammenfassend muss auf den Stellenwert der Biomarkertestung als unverzichtbares Tool beim Lungenkarzinom hingewiesen werden. Wir müssen «smarte» Panels entwerfen, mit deren Hilfe wir mit wenig Gewebe in einem knappen Zeitrahmen zu Ergebnissen kommen. Meiner Meinung nach wird sich die ctDNA speziell im Zusammenhang mit dem Monitoring als wertvoller Biomarker etablieren, und KI-gestützte Tools werden die Standardisierung und Auswertung von Markern wie der PD-L1-Expression erleichtern. Als wichtigste Aufgabe sehe ich die kontinuierliche Schulung unserer Kolleg:innen im Hinblick auf die Notwendigkeit der Biomarkertestung bei NSCLC-Patient:innen, auch in frühen Stadien.
Literatur:
1 Fachinformation Opdivo® 2 Forde PM et al.: Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022; 386(21): 1973-85 3 Felip E et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021; 398(10308): 1344-57 4 O’Brien M et al.: Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 2022; 23(10): 1274-86 5 Wu YL et al.: Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med 2020; 383(18): 1711-23 6 Wu YL et al.: Alectinib in resected ALK-positive non-small-cell lung cancer. N Engl J Med 2024; 390(14): 1265-76 7 Travis WD et al.: IASLC multidisciplinary recommendations for pathologic assessment of lung cancer resection specimens after neoadjuvant therapy. J Thorac Oncol 2020; 15(5): 709-40 8 Lu S et al.: Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC. N Engl J Med 2024; 391(7): 585-97 9 Jun S et al.: Analysis of circulating tumor DNA predicts outcomes of short-course consolidation immunotherapy in unresectable stage III NSCLC. J Thorac Oncol 2024; 19(10): 1427-37 10 Yang SR, Schultheis AM et al.: Precision medicine in non-small cell lung cancer: Current applications and future directions. Semin Cancer Biol 2022; 84: 184-19811 Ricciuti B et al.: Diminished efficacy of programmed death-(ligand)1 inhibition in STK11- and KEAP1-mutant lung adenocarcinoma is affected by KRAS mutation status. J Thorac Oncol 2022; 17(3): 399-410 12 Sadik K et al.: Impact of clinical practice gaps on the implementation of personalized medicine in advanced non-small-cell lung cancer. JCO Precis Oncol 2022; 6: e220024613 Loges S et al.: Aktuelle Umfrage zur Testbereitschaft in frühen und späten Stadien des NSCLC. Journal Onkologie 5/2024. https://www.journalonko.de/artikel/lesen/umfrage-testbereitschaft-nsclc-deutschland . Abgerufen November 2024
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...