CDK4/6-Inhibitoren prominent präsentiert
Bericht:
Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Große praxisverändernde Studien werden beim San Antonio Breast Cancer Symposium wohl eher nicht erwartet. Auch in diesem Jahr wurde der Fokus auf die Optimierung von Standardbehandlungen gelegt. Dennoch gaben interessante Ergebnisse aus Phase-II-Studien Hinweise auf mögliche weitere Behandlungskonzepte. Daten aus Phase-III-Studien bestätigten insbesondere Therapiestrategien mit CDK4/6-Inhibitoren bei diversen Krankheitsausprägungen.
MRT-geführte neoadjuvante Therapieoptimierung ist machbar
Eine mit Bildgebung geführte Optimierung der neoadjuvanten Chemotherapie bei HER2(„human epidermal growth factor receptor“)-positivem Brustkrebs im Stadium II und III war im Fokus der multizentrischen Phase-II-Studie TRAIN-3.1 Hintergrund der Studie war die Frage, ob die neoadjuvante Chemotherapie nach 3 Zyklen bei kompletter Remission laut Magnetresonanztomografie (MRT) sicher gestoppt werden kann.
Dazu wurden 467 Patient:innen nach jeweils 3 Zyklen Paclitaxel, Carboplatin, Trastuzumab und Pertuzumab (PTC-Ptz) entsprechend ihrem Ansprechen weiterhin neoadjuvant behandelt oder bei radiologischer Komplettremission der Operation zugeführt. Es wurden maximal 9 Zyklen der neoadjuvanten Chemotherapie appliziert. Wurde nach der Operation eine pathologische Komplettremission festgestellt, erhielten die Patient:innen bis zur Komplettierung eines Jahres Trastuzumab plus Pertuzumab.Lag keine pathologische Komplettremission vor, wurden die 9 Zyklen PTC-Ptz komplettiert und anschließend 14 Zyklen T-DM1 gegeben. Primärer Studienendpunkt war die 3-Jahres-Rate für das ereignisfreie Überleben (EFS). Eingeschlossen wurden 235 Patient:innen mit HR(Hormonrezeptor)-negativem und 232 Patient:innen mit HR-positivem Brustkrebs. Der Lymphknotenstatus war für beide Populationen in ungefähr 40% der Fälle negativ und in 60% positiv.
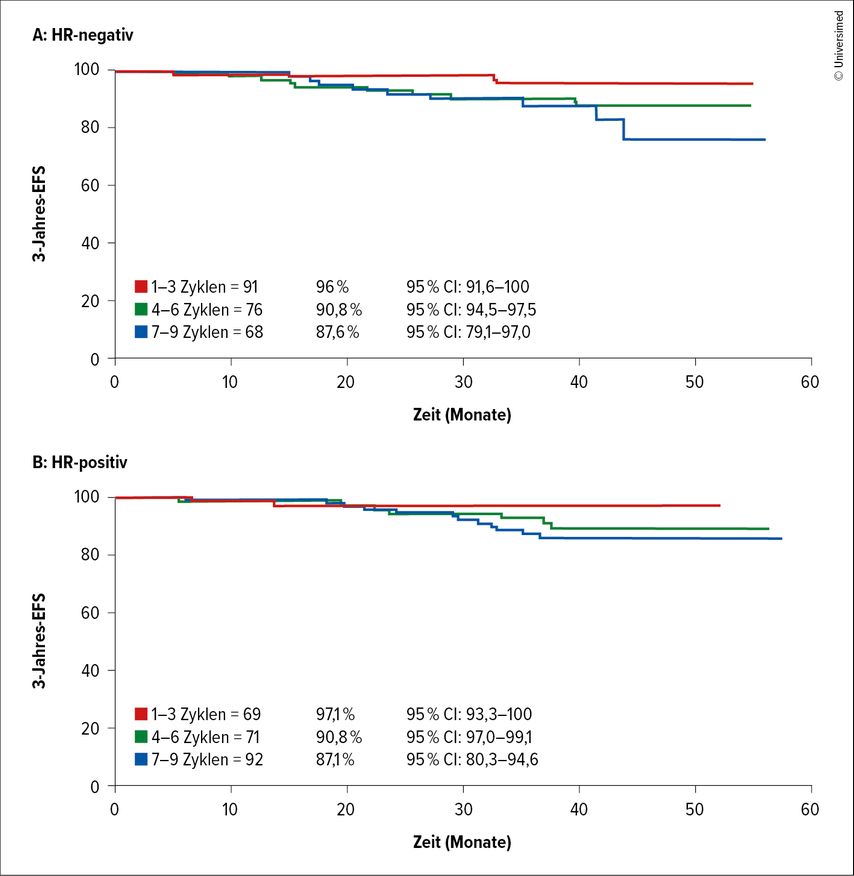
Nach 3 Zyklen waren 34% der HR-negativen und 16% der HR-positiven Patient:innen in Komplettremission, nach 6 Zyklen 60% bzw. 31% und nach 9 Zyklen 80% bzw. 43% der Patient:innen. Die 3-Jahres-EFS-Rate war mit 96,0% bzw. 97,1% nach 1–3 Zyklen neoadjuvanter Therapie, 90,8% bzw. 92,8% nach 4–6 Zyklen und 87,6% bzw. 87,1% nach 7–9 Zyklen für HR-negative und HR-positive Patient:innen vergleichbar (Abb. 1). Die Inzidenz von Nebenwirkungen Grad 3–4 stieg mit der höheren Anzahl neoadjuvanter Chemotherapiezyklen an.
Abb. 1: Ereignisfreies Überleben (EFS) nach drei Jahren in Abhängigkeit von der Anzahl der neoadjuvanten Behandlungszyklen (modifiziert nach Louis F et al.)1
CDK4/6-Inhibition bei tripelpositivem frühem Brustkrebs
Ebenfalls in einer Phase-II-Studie wurde untersucht, ob Palbociclib plus Letrozol oder wöchentlich appliziertes Paclitaxel, jeweils in Kombination mit Trastuzumab plus Pertuzumab, die wirksamere neoadjuvante Therapie für Patientinnen mit HR-positivem, HER2-positivem frühem Brustkrebs ist. Die TOUCH-Studie randomisierte 145 postmenopausale Patientinnen. Erste Ergebnisse wurden beim SABCS gezeigt.2
Die Patientinnen waren median 69 Jahre alt. Bei 75% war der Lymphknotenstatus N0 und bei 25% N1. 79,5% der Patientinnen im Paclitaxel-haltigen Studienarm vervollständigten 4 Paclitaxel-Zyklen, 16,4% brachen Paclitaxel aufgrund von Nebenwirkungen frühzeitig ab. Im Palbociclib-plus-Letrozol-haltigen Arm komplettierten 94,4% der Patientinnen 4 Zyklen Palbociclib und 2,8% brachen die Therapie frühzeitig aufgrund von Nebenwirkungen ab. 5 Dosen der Therapie mit Trastuzumab plus Pertuzumab konnten bei 93,2% der Patientinnen im Paclitaxel-haltigen und bei 97,2% der Patientinnen im Palbociclib- plus-Letrozol-haltigen Studienarm vervollständigt werden. Es brachen 6,8% bzw. 2,8% die HER2-gerichtete Therapie aufgrund von Nebenwirkungen ab. Ein komplettes Ansprechen wurde bei 32,9% versus 33,3% der Patientinnen beobachtet.
TOUCH ist somit die erste Studie, die einen CDK(„Cyclin-dependent kinase“)4/6-Inhibitor bei tripelpositiven Patientinnen im neoadjuvanten Setting untersucht und dieses Konzept bestätigt hat.
Langzeitergebnisse mit Olaparib nach (neo)adjuvanter Chemotherapie
Mit den Ergebnissen der randomisierten, placebokontrollierten Phase-III-Studie OlympiA wurde für die einjährige adjuvante Gabe des PARP(Poly[ADP-ribose]-Polymerase)-Inhibitors Olaparib nach einer (neo)adjuvanten Chemotherapie bei Patient:innen mit „Breast cancer 1“ (BRCA1)- oder BRCA2-Alterationen und HER2-negativem Hochrisiko-Brustkrebs eine signifikante Verlängerung des Überlebens ohne invasive Erkrankung (IDFS), des fernmetastasenfreien Überlebens (DDFS) und des Gesamtüberlebens (OS) nachgewiesen. Beim SABCS wurden nun Langzeitdaten mit einer medianen Nachbeobachtungszeit von 6,1 Jahren präsentiert.3
Der Nutzen durch die Olaparib-Erhaltungstherapie wurde mit den 6-Jahres-Daten bestätigt. Für das IDFS wurde eine Hazard-Ratio (HR) von 0,65 (95% CI: 0,53–0,78) mit IDFS-Raten von 79,6% versus 70,3% ermittelt. Die HR für das DDFS betrug ebenfalls 0,65 (95%CI: 0,53–0,81) mit 6-Jahres-Raten von 83,5% versus 75,7%. Das Risiko zu sterben wurde um 28% reduziert (HR: 0,72; 95% CI: 0,56–0,93), nach 6 Jahren lebten 87,5% der Patientinnen mit Olaparibversus 83,2%bzw. der Patientinnen ohne Olaparib. Der Nutzen der Erhaltungstherapie wurde über alle Subgruppen inklusive der Patient:innen mit HR-positiver Hochrisiko-Erkrankung beobachtet. Nebenwirkungen von speziellem Interesse wurden weniger häufig unter Olaparib als unter Placebo berichtet (6,3% vs. 9,3%), darunter myelodysplastisches Syndrom (MDS) oder akute myeloische Leukämie (AML) bei 4 versus 6 Patient:innen, Pneumonitis bei 9 versus 13 Patient:innen und neue primäre Karzinome bei 45 versus 68 Patient:innen. Insgesamt nahmen 1836 Patient:innen an der Studie teil.
Mit diesen Ergebnissen würde die Wichtigkeit einer Testung auf pathologische Keimbahn-BRCA-Varianten beim HER2-negativen primären Hochrisiko-Brustkrebs unterstrichen, so die Autor:innen der Studie.
CDK4/6-Inhibitor bei HER2-positivem Brustkrebs
Die Effektivität der zusätzlichen Gabe von Palbociclib zu einer endokrinen plus HER2-gerichteten Therapie bei Patient:innen mit HR-positivem, HER2-positivem metastasiertem Mammakarzinom untersuchte die offene, randomisierte Phase-III-Studie AFT-38 PATINA.4 Zwischen Juni 2017 und Juli 2021 wurden insgesamt 518 Patient:innen eingeschlossen. Nahezu alle Patientinnen (97,3%) erhielten eine duale Anti-HER2-Therapie und 90,9% einen Aromataseinhibitor (AI). Der primäre Endpunkt war das progressionsfreie Überleben (PFS) laut Prüfarztbericht.
Mit einer medianen Nachbeobachtungszeit von 53 Monaten wurde die finale PFS-Analyse durchgeführt. Im Ergebnis wurde durch die zusätzliche Palbociclib-Gabe das Risiko für einen Progress oder Tod um 26% signifikant reduziert (HR: 0,74; 95% CI: 0,58–0,94; p=0,0074). Im Median betrug das PFS 44,3 versus 29,1 Monate mit bzw. ohne Palbociclib. 29,2% versus 22,2% der Patient:innen sprachen auf die Therapie an, mit einer Krankheitskontrollrate von 89,3% versus 81,3%. Die Daten für das OS waren mit 119 Ereignissen noch unreif. Der Median war im Palbociclib-Arm noch nicht erreicht und betrug 77,0 Monate im Kontrollarm. Die 5-Jahres-OS-Rate lag bei 74,3% versus 69,8%.
Als häufigste Nebenwirkung unter Palbociclib traten Neutropenien auf, außerdem wurden Fatigue, Stomatitis und Diarrhöen häufiger berichtet. Die Inzidenz von Nebenwirkungen Grad ≥4 war mit 12,3% versus 8,9% vergleichbar. Es wurden keine therapiebedingten Todesfälle beobachtet.
Die Kombinationstherapie sei möglicherweise ein neuer Standard in der Behandlung des fortgeschrittenen HR-positiven, HER2-negativen Mammakarzinoms, resümierten die Autor:innen.
PFS-Verlängerung mit Imlunestrant plus Abemaciclib
Imlunestrant ist ein Hirn-penetrierender oraler selektiver Östrogenrezeptor-Degrader (SERD) und reiner Östrogenrezeptor(ER)-Antagonist, der ER kontinuierlich, auch bei ESR1(„Estrogen receptor 1“)-mutierten Tumoren, inhibiert.
In der dreiarmigen Phase-III-Studie EMBER-3 erhielten 874 Patient:innen mit ER-positivem, HER2-negativem frühem Brustkrebs und Rezidiv oder Tumorprogress unter oder nach einem AI mit oder ohne CDK4/6-Inhibitor randomisiert Imlunestrant als Monotherapie oder in Kombination mit Abemaciclib oder eine endokrine Standardtherapie nach Wahl des Behandlers/der Behandlerin.5 Der primäre Endpunkt war das PFS laut Prüfarztbericht im Vergleich von Imlunestrant versus Standardtherapie bei Patient:innen mit ESR1-Mutation bzw. bei allen Patient:innen sowie im Vergleich von Imlunestrant plus Abemaciclib versus Imlunestrant-Monotherapie bei allen Patient:innen. 60% der Patientinnen hatten bereits einen CDK4/6-Inhibitor erhalten und ungefähr ein Drittel der Tumoren war ESR1-mutiert.
Im Ergebnis wurde das PFS mit Imlunestrant versus Standardtherapie bei Patient:innen mit ESR1-Mutation signifikant verlängert (HR: 0,62; 95% CI: 0,46–0,82; p<0,001). Die Auswertung bei allen Patient:innen erreichte die Signifikanzgrenze nicht (HR: 0,87; 95% CI: 0,72–1,04; p=0,12). Die Hinzunahme von Abemaciclib zu Imlunestrant führte zu einer signifikanten PFS-Verlängerung von median 5,5 auf 9,4 Monate (Abb. 2). Das Risiko für einen Progress oder Tod wurde um 43% reduziert (HR: 0,57; 95% CI: 0,44–0,73; p<0,001). Dieser Vorteil unter der Kombinationstherapie wurde unabhängig vom ESR1-Mutationsstatus beobachtet. Das Toxizitätsprofil von Imlunestrant war günstig. Nur 4% bzw. 6% der Patient:innen brachen die Therapie mit Imlunestrant bzw. Imlunestrant plus Abemaciclib aufgrund von Nebenwirkungen ab.
Abb. 2: Progressionsfreies Überleben (PFS) unter Imlunestrant plus Abemaciclib versus nur Imlunestrant (modifiziert nach Jhaveri K et al.)5
CDK4/6-Inhibition in erster Therapielinie bestätigt
Primäre Ergebnisse der randomisierten Phase-IV-Studie PADMA zeigten für Patient:innen mit metastasiertem HER2-negativem, HR-positivem Brustkrebs und hohem Progressionsrisiko eine signifikante Verlängerung des PFS, wenn mit Palbociclib plus endokriner Therapie im Vergleich zu einer Chemotherapie behandelt wurde.6 Damit konnte der aktuelle Standard einer CDK4/6-Hemmung als Erstlinientherapie bestätigt werden.
Insgesamt erhielten in der PADMA-Studie 120 Patient:innen mit Indikation für eine Mono-Chemotherapie in der ersten Therapielinie eine endokrine Therapie mit einem AI oder Fulvestrant ± „Gonadotropin-releasing hormone“-Agonisten (GnRHa) plus Palbociclib oder eine Chemotherapie nach Wahl des Behandlers/der Behandlerin (Paclitaxel, Capecitabin, Epirubicin oder Vinorelbin) mit oder ohne endokrine Erhaltungstherapie mit Tamoxifen, einem AI oder Fulvestrant ± GnRHa. Die eingeschlossenen Patient:innen waren median 62 Jahre alt, wiesen in 42% der Fälle Lebermetastasen auf, waren zu 32% endokrinresistent und bei 37% wurde eine Metastasierung bei initialer Diagnosestellung identifiziert.
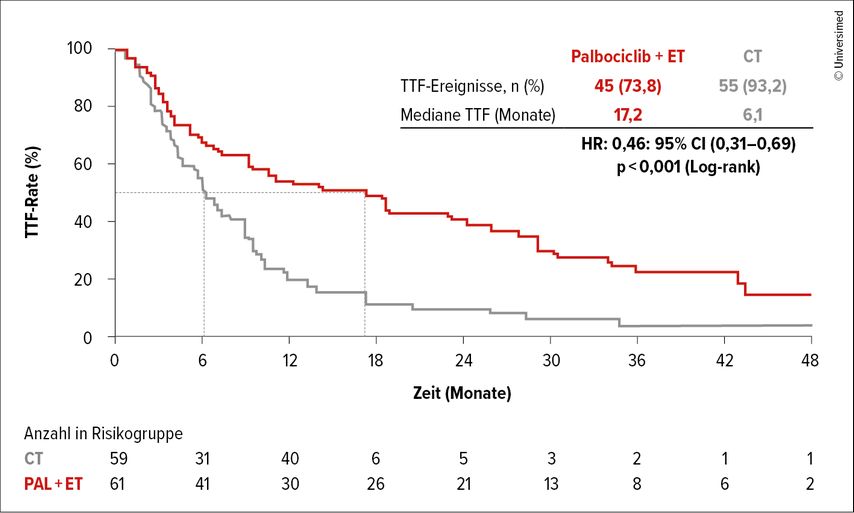
Mit einer medianen Nachbeobachtungszeit von 36,8 Monaten lag die Zeit bis zum Versagen der Therapie (TTF, primärer Studienendpunkt) bei 17,2 Monatenversus 6,1 Monate (HR: 0,46; 95% CI: 0,31–0,69; p<0,001; Abb. 3). Das mediane PFS betrug 18,7 versus 7,8 Monate (HR: 0,45; 95% CI: 0,29–0,79; p<0,001), das mediane OS lag bei 46,1 Monaten versus 36,8 Monate.
Abb. 3: Zeit bis Therapieversagen (TTF) im Vergleich von Palbociclib plus endokriner Therapie (ET) versus Chemotherapie nach Wahl des Behandlers/der Behandlerin (modifiziert nach Loibl S et al.)6
ADC unabhängig von CDK4/6-Vortherapie wirksam
Dass das Antikörper-Wirkstoff-Konjugat (ADC) Trastuzumab Deruxtecan (T-DXd) nach Progress unter einem CDK4/6-Inhibitor wirksam ist, zeigte eine beim SABCS präsentierte Subgruppenanalyse der DESTINY-Breast06-Studie.7 In dieser Studie erhielten chemotherapienaive Patient:innen mit HR-positivem Brustkrebs und niedriger (HER2-low: IHC 1+ oder IHC 2+/ISH–) oder sehr niedriger HER2-Expression (HER2-ultralow: IHC 0) randomisiert T-DXd oder eine Chemotherapie nach Wahl des Behandlers/der Behandlerin. Eingeschlossen wurden Patient:innen mit ≥2 vorangegangenen Therapielinien (endokrine Therapie ± zielgerichtete Therapie für die metastasierte Erkrankung) oder mit einer Therapielinie für das metastasierte Mammakarzinom sowie einem Progress nach ≤6 Monaten der Erstlinientherapie mit endokriner Substanz plus CDK4/6-Inhibitor oder einem Rückfall ≤24 Monate nach Beginn der adjuvanten endokrinen Therapie.
Die Auswertung der Subgruppe mit Progress nach endokriner Erstlinien-Therapie plus CDK4/6-Inhibitor und endokriner Resistenz bestätigte ein signifikant verlängertes PFS mit einer Hazard-Ratio von 0,38 (TTP <6 Monate), 0,69 (TTP 6–12 Monate) und 0,67 (TTP >12 Monate) unter T-DXd. Die Ansprechraten für das ADC lagen bei 67,7%, 60,0% bzw. 59,5%.
Quelle:
San Antonio Breast Cancer Symposium (SABCS), 10.–13. Dezember 2024, San Antonio, USA
Literatur:
1 Louis F et al.: Three-year event-free survival of the multicenter phase II TRAIN-3 study evaluating image-guided optimization of neoadjuvant chemotherapy duration in stage II and III HER2-positive breast cancer (BOOG 2018-01). SABCS 2024; Abstr. #RF1-03 2 Malorni L et al.: Palbociclib plus letrozole versus weekly paclitaxel, both in combination with trastuzumab plus pertuzumab, as neoadjuvant treatment for patients with HR+/HER2+ early breast cancer. Primary results from the randomized phase II TOUCH trial (IBCSG 55-17). SABCS 2024; Abstr. #RF1-02 3 Garber J et al.: OlympiA: a phase 3, multicenter, randomized, placebo-controlled trial of adjuvant olaparib after (neo)adjuvant chemotherapy in patients with germline BRCA1 & BRCA2 pathogenic variants & highrisk HER2-negative primary breast cancer: longerterm follow-up. SABCS 2024; Abstr. #GS1-09 4 Metzger O et al.: AFT-38 PATINA: a randomized, open label phase III trial to evaluate the efficacy and safety of palbociclib + anti-HER2 therapy + endocrine therapy vs. anti-HER2 therapy + endocrine therapy after induction treatment for hormone receptor-positive/HER2-positive metastatic breast cancer. SABCS 2024; Abstr. #GS2-12 5 Jhaveri K et al.: Imlunestrant, an oral selective estrogen receptor degrader (SERD), as monotherapy and combined with abemaciclib, for patients with ER+, HER2- advanced breast cancer, pretreated with endocrine therapy: results of the phase 3 EMBER-3 trial. SABCS 2024; Abstr. #GS1-01 6 Loibl S et al.: Primary results of the randomised phase IV trial comparing first-line ET plus palbociclib vs standard mono-chemotherapy in women with high risk HER2-/HR+ metastatic breast cancer and indication for chemotherapy – PADMA study. SABCS 2024; Abstr. #LB1-03 7 Bardia A et al.: Efficacy and safety of trastuzumab deruxtecan (T-DXd) vs physician’s choice of chemotherapy by pace of disease progression on prior endocrine-based therapy: additional analysis from DESTINY-Breast06. SABCS 2024; Abstr. #LB1-04
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...