Extrakorporale Photopherese: Methoden und Indikationen
Autorin:
Univ.-Prof. Dr. Nina Worel
Universitätsklinik für Transfusionsmedizin und Zelltherapie, Wien
E-Mail: nina.worel@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die extrakorporale Photopherese ist ein bereits vor etwa 40 Jahren von dem Dermatologen Richard Edelson zur Behandlung des kutanen T-Zell-Lymphoms entwickeltes Therapieverfahren. Im Laufe der Zeit wurde das Indikationsspektrum u.a.auf die Behandlung der Graft-versus-Host-Erkrankung erweitert.
Technik: „inline“ vs. „offline“
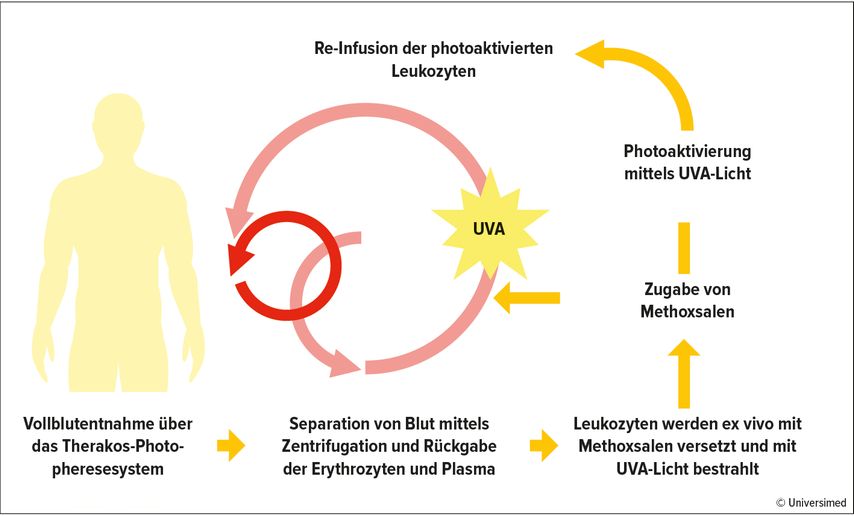
Die extrakorporale Photopherese (ECP) gliedert sich in zwei Phasen. In der ersten Phase werden Leukozyten gesammelt, die in der zweiten Phase mit einem Photosensitizer (8-Methoxypsoralen, 8-MOP) versetzt und mit UVA-Licht bestrahlt (Photoaktivierung) werden.
Anschließend erhält der Patient die behandelten Zellen wieder infundiert (Abb. 1). Für die ECP stehen unterschiedliche technische Verfahren zur Verfügung.
Geschlossene Behandlungssysteme („Inline“-Systeme)
Am häufigsten wird ECP mit einem geschlossenen System durchgeführt. Dazu wird Vollblut – bevorzugt über einen peripheren Venenzugang gewonnen – in einer modifizierten Latham-Glocke zentrifugiert, um die Erythrozyten von Plasma und Leukozyten zu trennen. Die Leukozyten werden in einen Sammelbeutel geleitet, nach Zugabe von 8-MOP mit UVA-Licht bestrahlt und anschließend reinfundiert.Die Bezeichnung „Inline“-System besagt, dass der Patient während der gesamten Behandlungsdauer mit dem Gerät verbunden ist und Bestrahlung und Rückgabe der behandelten Zellen über das Photopheresesystem erfolgen.
Offene Behandlungssysteme („Offline“-Systeme)
Hier werden Leukozyten mittels eines konventionellen Zellseparators gesammelt, in einem getrennten Arbeitsschritt im Labor mit 8-MOP versetzt und „offline“ einer UVA-Strahlenquelle ausgesetzt, bevor der Patient die behandelten Zellen zurückbekommt. Eine Sonderform ist die Mini-Photopherese, bei der ca. 150–200ml Vollblut weiterverarbeitet werden.
Wirkungsmechanismus: vor allem immunmodulierend
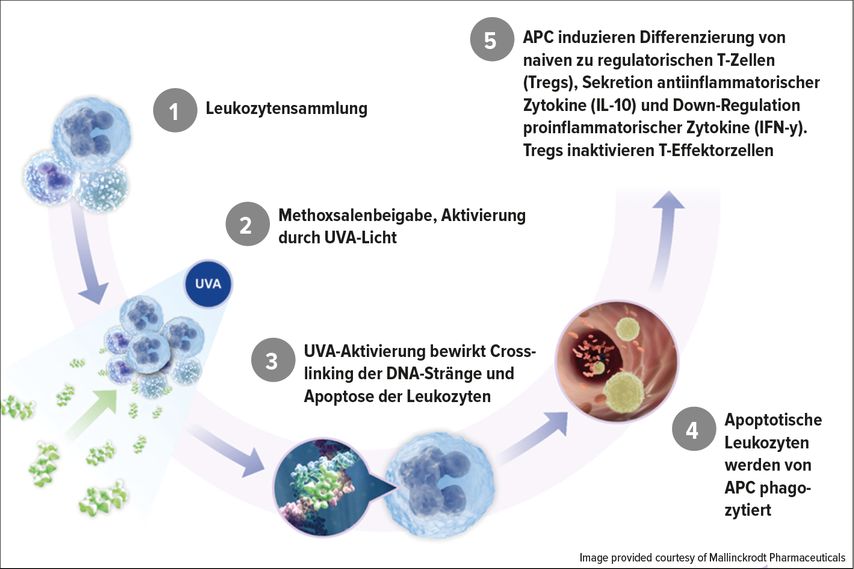
Trotz etwa 40-jähriger Erfahrung im Einsatz der ECP und mehr als 1,5 Millionen ECP-Behandlungen sind die exakten Wirkungsmechanismen nach wie vor nicht exakt geklärt. Bis dato weiß man, dass die Wirkung der ECP hauptsächlich auf einem immunmodulierenden Effekt beruht. Die UVA-Bestrahlung der mit 8-MOP behandelten Leukozyten führt zu einem „cross-linking“ der Desoxyribonukleinsäure (DNA) und im weiteren Verlauf zur Apoptose der betroffenen Zelle, wobei maligne Zellen, alloreaktive und aktivierte T-Zellen stärker von Apoptose betroffen sind als gesunde, ruhende T-Zellen (Abb. 2).
Die Immunmodulation basiert auf einer Induktion von spezifischen regulatorischen T-Zellen, Änderung von Zytokinprofilen, Switch von CD4-positiven Th1- zu Th2-Zellen und Differenzierung von Monozyten in dendritische Zellen. Zusätzlich wurde eine Transimmunisierung beschrieben, die es ermöglicht, bisher schlecht vom Immunsystem erkannte Tumorantigene durch potente antigenpräsentierende Zellen zu präsentieren. Nach Phagozytose der entsprechenden Zellpopulation werden anti-Tumor-spezifische T-Zellen generiert, die zytotoxisch gegen T-Zell-Klone wirken. Neben den beschriebenen Differenzierungsmechanismen werden auch Zytokine wie z.B. Tumor-Nekrose-Faktor-α und Interleukin-6 freigesetzt, die zur Aktivierung von Monozyten führen.
Je nach Grunderkrankung sind unterschiedliche immunmodulierende Effekte der ECP beschrieben. Der Switch von Th1- zu Th2-Zellen bewirkt einen Anstieg von antiinflammatorischen Zytokinen (wie Interleukin-10) und eine vermehrte Freisetzung der Interleukine-4 und -5. Zusätzlich bewirkt der Switch zu Th2-Zellen auch eine Reduktion von proinflammatorischen Zytokinen. Trotz Switch von Th1- zu Th2-Zellen kommt es zu keiner erhöhten Infektanfälligkeit. Durch die ECP steigt die Zahl spezifischer regulatorischer T-Zellen an. Dies führt zum Wiederherstellen der Immuntoleranz.
Aktuelle Indikationen
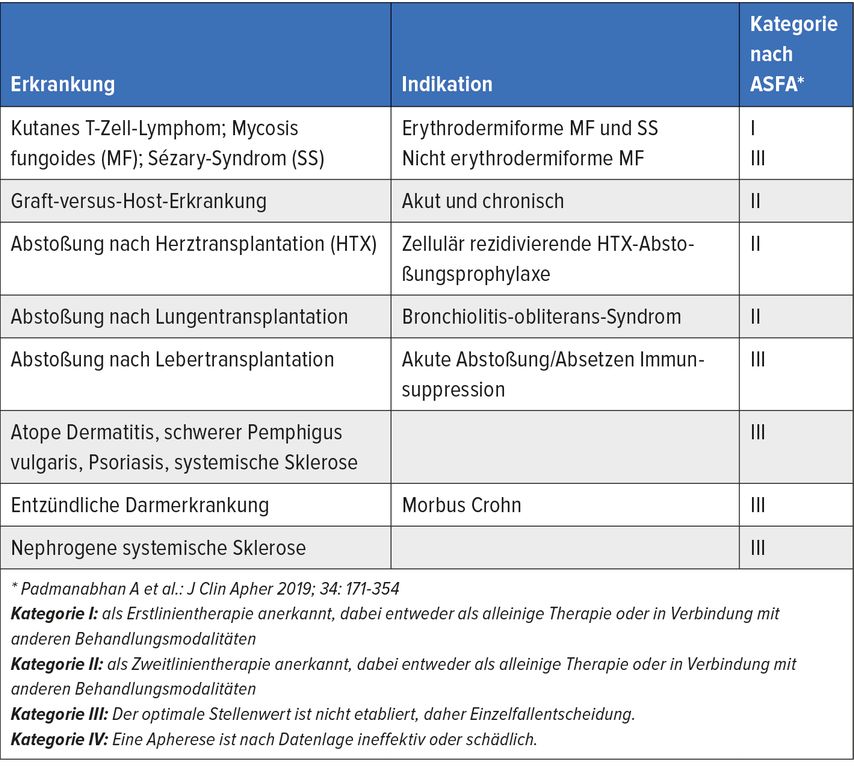
Indikationen für eine ECP-Behandlung sind in Tabelle 1 enthalten. In der Folge werden einige aktuelle Indikationen näher beschrieben.
Kutanes T-Zell-Lymphom
Die häufigste Variante dieser lymphoproliferativen Erkrankungen der Haut ist die Mycosis fungoides. Bei etwa 5% der Fälle liegt ein Sézary-Syndrom mit Erythrodermie, Leukämie und Lymphknotenbefall vor, welches eine schlechte Prognose mit einer mittleren Überlebensrate von nur etwa drei Jahren hat. Erstmals wurde 1987 über die erfolgreiche Anwendung der ECP in der Behandlung kutaner T-Zell-Lymphome (CTCL) berichtet.
Die ECP wird überwiegend bei den erythrodermen Varianten der Mycosis fungoides und des Sézary-Syndroms eingesetzt. Die Ansprechraten auf die Behandlung liegen bei etwa 70–75%. Patienten mit relativ intaktem Immunsystem und einer Krankheitsdauer von unter zwei Jahren ohne Befall von inneren Organen oder Lymphknoten zeigen ein besseres Ansprechen.
Akute und chronische Graft-versus-Host-Erkrankung
Standardmäßig wird eine Graft-versus-Host-Erkrankung (GVHD) primär mit Steroiden in Kombination mit systemischer Immunsuppression (zumeist Calcineurininhibitoren) behandelt. Bei fehlendem Ansprechen auf diese Erstlinientherapie (40–60%) muss auf eine Zweitlinientherapie gewechselt werden.
In einer Metaanalyse von 31 Studien konnte bei steroidrefraktärer (SR) akuter GVHD durch ECP bei 67% der Patienten mit Hautbefall, 38% mit Leberbefall und 54% mit Darmbefall eine komplette Remission (CR) erzielt werden. Bei SR, chronischer GVHD erreichten bei Haut- und Mundschleimhautbeteiligung 75% (35–38% CR) und 63% der Patienten eine deutliche Verbesserung, bei Lungen- und Leberbeteiligung lag das Ansprechen bei 48% und 39%.
Durch die klinischen Erfolge der Studien REACH-1, -2 und -3, in denen Ruxolitinib zur Behandlung der SR akuten und SR chronischen GVHD im Vergleich zur besten verfügbaren Standardtherapie getestet wurde, ist die ECP etwas aus der Zweitlinientherapie der GVHD verdrängt worden. Nach wie vor hat die ECP aber in der Behandlung der SR GVHD einen wichtigen Stellenwert, besonders wenn auf Ruxolitinib kein adäquates Ansprechen erreicht bzw. Ruxolitinib aufgrund von Zytopenien nicht oder in reduzierter Dosierung verabreicht wird.
Neben der immunmodulierenden Wirkung der ECP ist das Risiko von Infektkomplikationen während der ECP-Behandlung deutlich geringer als bei systemischer Immunsuppression. Ein weiterer Vorteil ist der steroidsparende Effekt der ECP, der sowohl bei ECP in der Zweitlinientherapie als auch in Kombination mit Ruxolitinib beschrieben wird.
Abstoßung nach Herz- und Lungentransplantation
In einer 1998 durchgeführten, prospektiven, randomisierten Studie erhielten 27 Patienten nach Herztransplantation (HTX) eine Standard-Immunsuppression und 33 Patienten zusätzlich ECP für 6 Monate. Die ECP-Gruppe zeigte signifikant weniger Abstoßungsepisoden im Vergleich zum Standard-Therapiearm. Auch zeigte sich eine signifikant geringere Intima-Media-Dicke der Koronargefäße nach einem und zwei Jahren in der ECP-Gruppe. Rezente Publikationen unterstreichen, dass ECP bei Patienten mit hohem Risiko für Infektionen oder mit malignen Erkrankungen als Begleittherapie zu einer reduzierten Immunsuppression Abstoßungsepisoden verhindern kann. Auch im Management der akuten und chronischen Abstoßungsreaktionen nach HTX ist die ECP als Zweitlinientherapie anerkannt.
Nach Lungentransplantation (LuTX) führt die ECP-Behandlung zur klinischen Verbesserung bzw. Stabilisierung bei Abstoßungsreaktionen. In zwei großen Studien mit 84 Patienten wurde eine deutliche Verlangsamung der Abnahme der Lungenfunktion beobachtet, von 112ml pro Monat auf 12ml pro Monat bzw. von 116ml pro Monat auf 29ml pro Monat bei Patienten mit Bronchiolitis-obliterans-Syndrom (BOS). So wie die chronische GVHD ist auch das BOS eine Erkrankung, die von einer über einen längeren Zeitraum durchgeführten ECP-Behandlung profitiert. Viele LuTX-Zentren setzen die ECP routinemäßig bei Patienten mit durch Biopsie gesicherter Abstoßung oder BOS ein.
Fazit: sicher, effektiv, verträglich
Die ECP stellt eine sichere, effektive, nebenwirkungsarme und sehr gut verträgliche Therapieoption dar. Der therapeutische Effekt beruht auf einer Modulation des zellulären Immunsystems, was eine Abnahme der T-Zell-Aktivität zur Folge hat. Die ECP hat einen gesicherten Stellenwert in der erfolgreichen Behandlung des CTCL, der akuten und chronischen GVHD und in der Therapie von Abstoßungsepisoden nach HTX und LuTX. Zusätzlich gibt es auch positive Ergebnisse in der Behandlung anderer Erkrankungen, wie Morbus Crohn, und einer Reihe von dermatologischen Krankheitsbildern, wie der systemischen Sklerodermie.
Durch experimentelle wie auch klinische Untersuchungen zur Wirkung der ECP auf das Immunsystem hat die ECP-Behandlung in den letzten Jahren eine Erweiterung des Indikationsspektrums erfahren.
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...