_nopparit.jpg)
Paradigmenwechsel in der Krebstherapie
Medizinjournalistin
Krebs hat in Staaten mit hohem Pro-Kopf-Einkommen wie in den westlichen Industriestaaten kardiovaskuläre Krankheiten als häufigste Todesursache bei 35- bis 70-Jährigen überholt.1 Auf der anderen Seite stehen die Entwicklungen in der Krebsforschung, die zu immer wirkungsvolleren Therapien führen. Dieses Spannungsfeld war Thema des Vortrages von Univ.-Prof. Matthias Preusser, Leiter der Klinischen Abteilung für Onkologie an der Universitätsklinik für Innere Medizin I der Medizinischen Universität Wien, bei den „Onkologischen Wintergesprächen 2020“ in Wien.
Entwicklung der Krebstherapien
Die Krebstherapie ist einem ständigen Wandel unterworfen. Bis Ende des 19. Jahrhunderts war die Operation die einzige verfügbare Behandlung. Die Entdeckung der Röntgenstrahlen 1896 eröffnete eine neue Therapieoption, die bereits Anfang des 20. Jahrhunderts eingesetzt und seitdem stetig weiterentwickelt wurde.2 Im Zweiten Weltkrieg wurde – eher durch Zufall – die Wirkung von Senfgas oder Lost auf Lymphome entdeckt: Die Chemotherapie war geboren.2, 3 Sie wurde seit etwa 1946 zunächst nur bei hämatologischen Tumoren eingesetzt. Erst rund zehn Jahre später entwickelten US-amerikanische Wissenschaftler die erste Chemotherapie gegen solide Tumoren, die auch heute noch in zahlreichen Regimen zu finden ist: Fluoropyrimidin 5-Fluorouracil (5-FU).3
Dank verbesserter Diagnose- und Untersuchungsverfahren sammelten Krebsforscher immer neue und tiefergehende Erkenntnisse über das Wesen von Tumoren. Die Erkenntnis, dass es „den Krebs“ nicht gibt und auch innerhalb einer Entität eine zum Teil erhebliche Heterogenität zu finden ist, öffnete den Weg hin zu individualisierten Behandlungsoptionen wie „targeted therapies“ mit Tyrosinkinase-Inhibitoren (TKI) und Immuntherapien.4–6
From bench to bedside
Diese Fortschritte leiteten einige Paradigmenwechsel in der Tumortherapie ein. Preusser verdeutlichte dies am Beispiel von Hirnmetastasen. Bei Patienten, deren Hirnmetastasen vor dem Jahr 2000 diagnostiziert worden waren, lag das Gesamtüberleben (OS) bei median fünf Monaten. Dabei machte die primäre Tumorkrankheit kaum einen Unterschied. Nach 2000 lag das mediane OS nur unwesentlich höher: sieben Monate. Dies änderte sich drastisch mit der Einführung der Immuncheckpoint-Inhibitoren (CTLA-4-, PD1-, PD-L1-Inhibitoren). So konnte beispielsweise in der Studie CheckMate 204 bei Melanompatienten mit Hirnmetastasen durch die Kombination aus einem CTLA-4- und einem PD1-Inhibitor (Ipilimumab + Nivolumab) eine objektive Responserate (ORR) von 55% intrakranial und 51% insgesamt erreicht werden. Bei 26% der Patienten kam es zu einer vollständigen Remission (CR) der Hirnmetastasen, bei 30% zu einer partiellen Remission(PR)(Abb. 1). In dieser Studie wurde bis zum Zeitpunkt der Auswertung das mediane OS nicht erreicht. Die OS-Raten zu den Monaten 6 und 9 lagen bei 92,3% und 82,8%. Das geschätzte 12-Monats-OS betrug 81,5%.7 Ähnlich gute Resultate erzielte die ALEX-Studie mit zwei TKI (Alectinib vs. Crizotinib) bei Patienten mit ALK-positivem nichtkleinzelligem Lungenkrebs (NSCLC).8
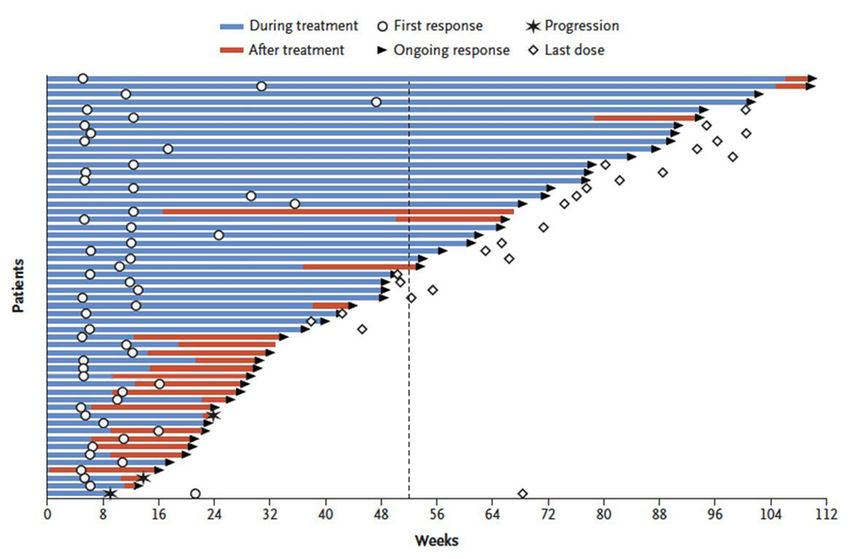
Abb. 1:Ansprechen der Hirnmetastasen bei Melanompatienten auf die Immuntherapie7
Inzwischen sind verschiedene Checkpoint-Inhibitoren als Erst- bzw. Zweitlinientherapie für nahezu alle Tumorentitäten zugelassen. Dazu zählen zum Beispiel der CTLA-4-Inhibitor Ipilimumab, die PD1-Inhibitoren Nivolumab und Pembrolizumab sowie die PD-L1-Inhibitoren Atezolizumab, Durvalumab und Avelumab. Sie haben die Prognose von einigen der aggressivsten Krebsarten wie Melanom, Lungen- und Nierenzellkrebs erheblich verbessert, selbst im metastasierten Stadium.9
Paradigmenwechsel: Metastasen verhindern
Besser als Metastasen zu behandeln wäre es, ihr Entstehen zu unterbinden. Ein möglicher Weg dorthin ist eine Antiangiogenese durch die Blockade des Wachstumsfaktors VEGF. So traten in der AVAil-Studie bei NSCLC-Patienten unter dem Angiogenesehemmer Bevacizumab weniger Hirnmetastasen auf als in der Kontrollgruppe. Extrakraniale Metastasen wurden jedoch nicht verhindert. Anders als bei NSCLC konnte der Effekt auf Hirnmetastasen in zwei Studien mit Brustkrebspatientinnen (AVEREL, AVADO) nicht bestätigt werden.10
Zukunft der onkologischen Therapie
Die Erforschung und Entwicklung neuer Therapieansätze und Substanzen sowie die Kombination unterschiedlicher Therapeutika wird laut Preusser zu immer individuelleren Behandlungsregimen führen. Zudem werde sich die Therapie zunehmend in das ambulante Setting verlagern. Bereits seit einigen Jahren werden onkologische Patienten vermehrt ambulant behandelt. Lag die Zahl der ambulanten Patientenkontakte 2007 bei rund 7100, so hatte sie sich 2016 schon mehr als verdoppelt und lag bei fast 14500 – Tendenz steigend. Möglich wird dies unter anderem durch die Kooperation onkologischer Spitzenzentren mit anderen Kliniken und den Wissenstransfer auch über Landesgrenzen hinweg (Abb. 2). Die zunehmende Digitalisierung wird diese Entwicklung unterstützen, denn sie ermöglicht andere Kommunikationsformen zwischen Arzt und Patient. Daten und Befunde können leichter erhoben und übermittelt werden, was den professionellen Austausch erleichtert. Die Herausforderung besteht darin, diese Daten vor Missbrauch zu sichern.
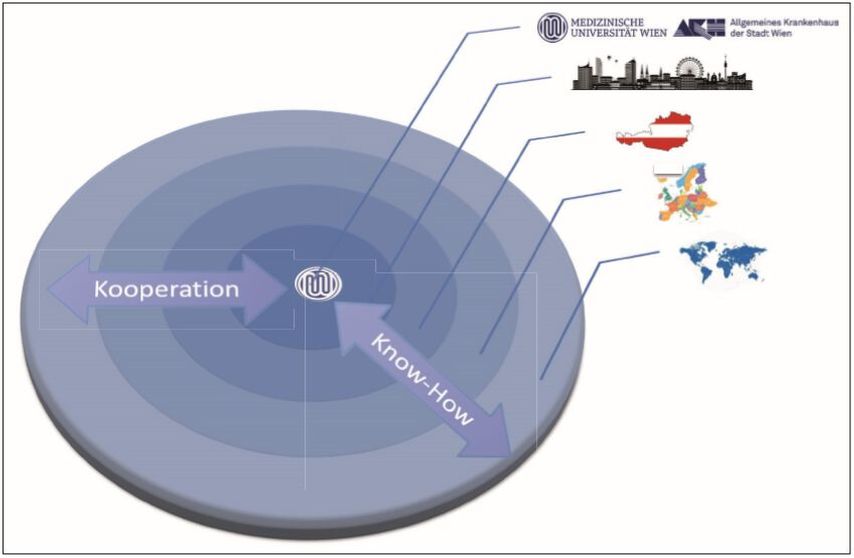
Abb. 2: Wissenstransfer als Grundlage für eine flächendeckende evidenzbasierte onkologische Versorgung
Eine weitere Herausforderung sind die Therapiekosten. Diese sind laut Preusser zum Beispiel in den USA seit Mitte der 1990er-Jahre drastisch gestiegen – von rund 2000 US-Dollar pro Monat auf mehr als 10000 US-Dollar pro Monat in den Jahren 2010 bis 2014.
Quelle:
Onkologische Wintergespräche 2020, 24./25. Jänner 2020, Wien
Literatur:
1 Dagenais GR et al.: Lancet 2019; pii: S0140-6736(19)32007-0 (doi: 10.1016/S0140-6736(19)32007-0. [Epub ahead of print]) 2 The American Cancer Society. The History of Cancer. Available from: cancer.org/cancer/cancerbasics/thehistoryofcancer 3 DeVita VT Jr, Chu E: Cancer Res 2008; 68:8643-53 4 Kirkwood JM et al.: CA Cancer J Clin 2012; 62: 309-35 5 Finn OJ.: Ann Oncol 2012; 23(Suppl 8): viii6-9 6 Mansh M: Yale J Biol Med 2011; 84: 381-9 7 Tawbi HA et al.: N Engl J Med 2018; 379: 722-30
8 Gadgeel S et al.: Ann Oncol 2018; 29: 2214-22 9 Preusser M et al.: Nat Rev Neurol 2015; 11: 504-14 10 Ilhan-Mutlu A et al.: Mol Cancer Ther 2016; 15: 702-10
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


