Rasante Fortschritte bei der Myelomtherapie
Autoren:
Prof. Dr. Heinz Ludwig1
OA Dr. Martin Schreder2
1 Wilhelminen Krebsforschungsinstitutc/o I. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie mit Ambulanz und Palliativstation
2 I. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie mit Ambulanz und Palliativstation
Klinik Ottakring, Wien
Korrespondenz
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Forschungsarbeiten zur Therapie des multiplen Myeloms schreiten rasant voran. Neue Erkenntnisse erweitern unser Verständnis der komplexen genetischen Mechanismen der malignen Transformation und geben außerdem Einblick in den Einfluss von Lebensstiländerungen, wie z.B. Ernährungsstil, auf den Krankheitsverlauf. Aufgrund des begrenzten Platzes kann hier nur eine kleine Zahl subjektiv ausgewählter Präsentationen vorgestellt werden.
MonumenTAL-2: Talquetamab in der Erstlinie
Die Wirksamkeit von bispezifischen Antikörpern wird mittlerweile auch in der Erstlinientherapie untersucht. In der MonumenTAL-2-Studie wird eine Kombination von Talquetamab (Target: GPRC5D) mit Daratumumab und Revlimid bei Patient:innen mit neu diagnostiziertem multiplem Myelom (NDMM) untersucht.1
Nach einer medianen Therapiedauer von nur einem Monat wurden beeindruckende Ansprechraten von 100% bzw. 96,2%, abhängig von Dosierung (0,6mg/kg vs. 1,6mg/kg) und Behandlungsintervall (alle zwei vs. alle vier Wochen) erzielt.
GPRC5D wird jedoch auch in Haut und Hautanhangsgebilden exprimiert, weshalb die Talquetamab-Therapie zu charakteristischen Nebenwirkungen wie Haut- und Nagelveränderungen, Schluck- und Geschmacksstörungen sowie Gewichtsverlust führen kann. Oft sind Dosisanpassungen oder Verlängerungen der Behandlungsintervalle erforderlich. Ein Therapieabbruch war jedoch bei keinem der bisher behandelten 34 Patient:innen notwendig.
MajesTEC-5: Teclistamab-haltige Regime
In der dreiarmigen Phase-II-Studie MajesTEC kooperieren erstmals beide deutschen Myelom-Studiengruppen (die „German-speaking myeloma multicenter group“ [GMMG] und die „Deutsche Studiengruppe multiples Myelom“ [DSMM]).2 Patient:innen mit NDMM werden in drei Therapiearme randomisiert:
Teclistamab (1,5mg/kg wöchentlich) plus Daratumumab/Lenalidomid (Dara-Len),
Teclistamab (3,0mg/kg wöchentlich) plus Dara-Len und
Teclistamab (3,0mg/kg) plus Daratumumab, Bortezomib und Lenalidomid.
Nach sechs Zyklen Induktionstherapie erfolgt eine Stammzelltransplantation, gefolgt von einer 18 Zyklen dauernden Erhaltungstherapie mit Teclistamab und Daratumumab.
Die ersten Ergebnisse zeigen nach drei Zyklen eine Ansprech- und MRDneg-Rate (MRD, minimale Resterkrankung) von 100%. Die Infektionsinzidenz lag insgesamt bei 92%, wobei Infektionen Grad ≥3 bei 20,4% der Patient:innen beobachtet wurden. Ein Zytokinfreisetzungssyndrom (CRS) Grad 1/2 wurde bei 65,3% beobachtet, während ein „immune effector cell-associated neurotoxicity syndrome“ (ICANS) bei keinem der Proband:innen aufgetreten ist.
Neuer trispezifischer Antikörper (BCMA-CD38-CD3: TreatTM)
Hang Quach hat erste Ergebnisse mit einem trispezifischen Antikörper, der an BCMA, CD38 und CD3 bindet, bei Patient:innen mit rezidiviertem/refraktärem multiplem Myelom (RRMM) vorgestellt.3 Der Antikörper verfügt über besonders hohe Bindungsaffinität und bindet auf CD38 an andere Epitope als Daratumumab. Durch die speziell abgestufte Bindungsaffinität an BCMA>CD38>CD3 kommt es zu einer starken Tumorlyse bei geringen CD38-bedingten „Off-tumor“-Nebenwirkungen.
Im Mausmodell wurde eine höhere Wirksamkeit als mit Teclistamab und in der Phase I/II-Studie mit der höchsten Dosisstufe eine Ansprechrate von 85% bei CD38-resistenten Patient:innen beobachtet. Als relevante Nebenwirkung wurde CRS Grad 1–2, jedoch keine ICANS gesehen.
DREAMM-9: Belanatamab-Kombis inErstlinie
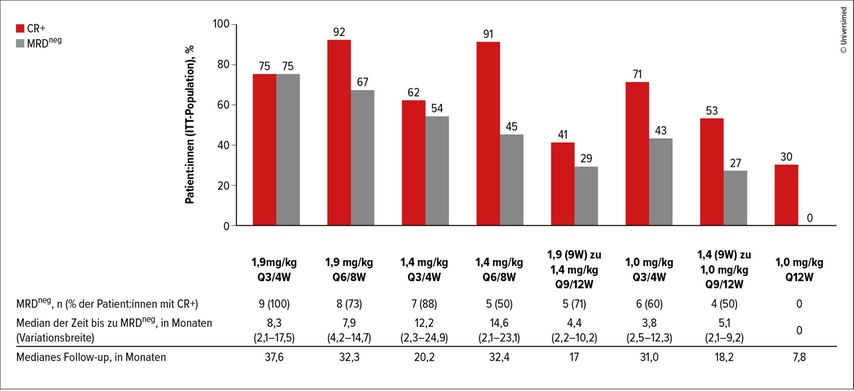
Nach erfolgreichen Studien (DREAMM-7 und DREAMM-8) mit Belantamab-Kombinationen bei vorbehandelten Patient:innen wird in DREAMM-9 nun der Einsatz von Belantamb-Kombinationen in der Erstlinientherapie untersucht.4 Es werden acht Kohorten mit unterschiedlichen Dosis- und Intervallstufen von Belantamab in Kombination mit Bortezomib, Lenalidomid und Dexamethason (VRd) bei NDMM-Patient:innen evaluiert (Abb. 1).
Abb. 1: Ansprech- und MRDneg-Raten in 8 Kohorten mit Erstlinientherapie mit VRd plus 8 verschiedene Dosierungen und Applikationsintervalle von Belantamab (modifiziert nach Saad Z et al.)4
Die vorläufigen Ergebnisse zeigen Ansprechraten zwischen 71% und 100%. Die MRDneg-Raten schwankten zwischen 10% und 83%. Ebenso variierte die Häufigkeit von Augentoxizitäten von Grad 3/4 stark (10–67%). Eine Verlängerung der Belantamab-Dosierungsintervalle von drei bis vier Wochen auf sechs bis acht Wochen führte zu einer verbesserten Verträglichkeit und weniger Beeinträchtigungen der Sehschärfe. Erste klinische Erfahrungen deuten darauf hin, dass ein lang anhaltendes Ansprechen auch bei verlängerten Therapieintervallen möglich ist.
Randomisierte Phase-III-Studien
GMMG HD7: Isatuximab bei transplantationsgeeigneten Patient:innen
Die GMMG präsentierte Zwischenergebnisse der HD7-Studie, in der transplantationsgeeignete Patient:innen entweder in einen Therapiearm mit VRd plus Isatuximab oder in einen Kontrollarm ohne CD38-Therapie randomisiert wurden.5 Nach drei sechswöchigen Zyklen Induktionstherapie folgt eine autologe Stammzelltransplantation. Anschließend erfolgt eine zweite Randomisierung in eine Erhaltungstherapie mit Isatuximab und Lenalidomid oder eine Lenalidomid-Monotherapie.
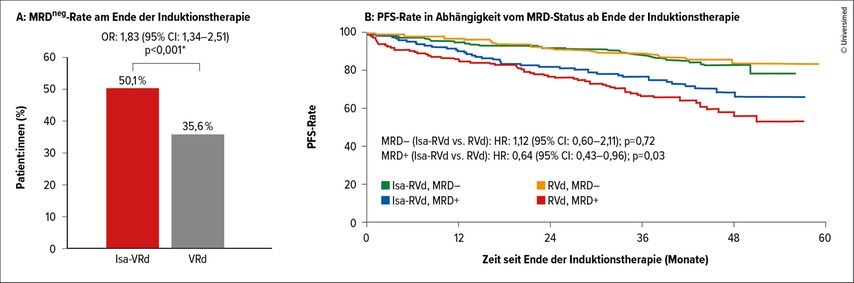
Die primären Studienendpunkte sind die MRDneg-Rate nach der Induktionstherapie und nach der Transplantation sowie das progressionsfreie Überleben (PFS) nach der zweiten Randomisierung. Wie erwartet, führte die Isatuximab-VRd-Kombination zu signifikant höheren MRDneg-Raten, die nach der Induktionstherapie bei 50,1% vs. 35,6% (p<0,001; Abb. 2A) und nach der Transplantation bei 66,2% vs. 47,7% lagen.
Abb. 2: A) Isa-VRD führte zu signifikant höheren MRDneg-Raten. B) Keinen Unterschied gab es beim PFS-Verlauf zwischen MRDneg-Patient:innen mit und ohne Isatuximab, jedoch zeigte sich ein signifikant kürzeres progressionsfreies Überleben (PFS) bei MRDpos-Patient:innen ohne Isatuximab (modifiziert nach Goldschmidt H et al.)5
Interessanterweise waren die PFS-Kurven der MRDneg-Patient:innen in beiden Gruppen (Isa-VRd und VRd) nahezu identisch. Hingegen zeigten MRDpos-Patient:innen, die Isa-VRd erhielten, ein signifikant besseres PFS im Vergleich zur VRd-Gruppe (p<0,03; Abb. 1B). Der Vorteil der CD38-Therapie war in allen klinisch relevanten Subgruppen nachweisbar.
IFM2017-03: Inwieweit kann Dexamethason eingespart werden?
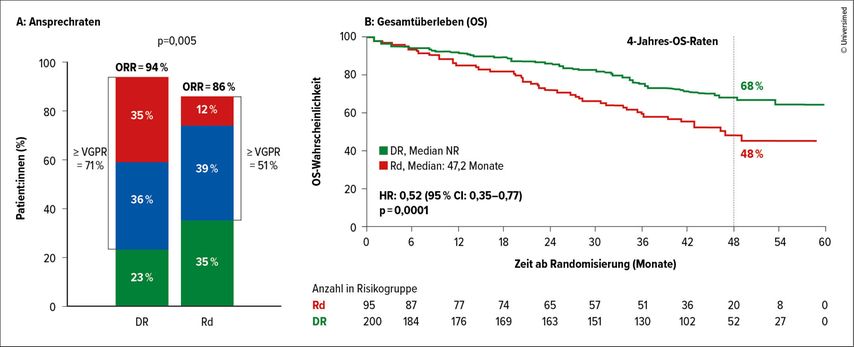
Die Verträglichkeit von Dexamethason variiert stark zwischen einzelnen Patient:innen und ist bei älteren Personen insgesamt geringer. Daher sind Therapien mit reduzierter Dexamethason-Dosis oder ganz ohne Cortison für viele Betroffene von besonderem Interesse. Die französische Studiengruppe „Intergroup francophone du myelome“ hat in der IFM2017-03-Studie bei älteren (>65 Jahre) Patient:innen ein Cortison-freies Protokoll (Daratumumab/Lenalidomid [Dara-R]) mit dem konventionellen Lenalidomid-Dexamethason(Rd)-Protokoll verglichen.6 Die Ergebnisse zeigen bemerkenswerte Vorteile der Dara-R-Therapie gegenüber Rd. So lag die Ansprechrate in der Dara-R-Kohorte deutlich höher als in der Rd-Gruppe (94% vs. 86%). Weiters zeigten sich ein verlängertes PFS (53,4 vs. 22,5 Monate) und Gesamtüberleben (OS; Median in der Dara-R-Gruppe nicht erreicht vs. 47,2 Monate in der Rd-Gruppe; p=0,0001). Außerdem haben die Patient:innen viel länger von Dara-R profitiert, was sich in der längeren Therapiedauer manifestierte (31,6 vs. 14,3 Monate). Insgesamt kam es unter Dara-R zu einer Reduktion der Mortalität um 48%.
Weder das Alter noch der „Charlson comorbidity index“ zeigten eine Korrelation mit dem PFS. Hingegen war ein hoher „Frailty-Score“ mit einem deutlich verkürzten PFS in der Rd-Gruppe verbunden. In der Dara-R-Gruppe führte die Therapie hingegen auch bei Patient:innen mit hohem Frailty-Score zu einem signifikant längeren PFS im Vergleich zu Rd (Abb. 3). Zusammenfassend erzielte Dara-R in allen klinisch relevanten Parametern überlegene Ergebnisse und bietet auch bei vulnerablen Patient:innen mit hohem Frailty-Score eine wirksamere und besser verträgliche Behandlungsoption.
Abb. 3: Inwieweit kann Dexamethason eingespart werden? Höhere Ansprechraten und längeres progressionsfreies Überleben (PFS) mit Daratumumab/Revlimid (DR) im Vergleich zu Revlimid/Dexamethason (Rd) bei gebrechlichen Patient:innen mit NDMM in der IFM-2017-13-Studie. A) Ansprechraten, B) Gesamtüberleben (OS) (modifiziert nach Manier S et al.)6
AURIGA: Lenalidomid-Erhaltungstherapie nach autologer Transplantation?
Um die zentrale Frage zu klären, ob eine Lenalidomid-Erhaltungstherapie nach autologer Transplantation, die derzeit als Standardtherapie gilt, durch die Kombination mit Daratumumab verbessert werden kann, wurden 200 Patient:innen entweder in eine Gruppe mit der Standard-Lenalidomid-Erhaltungstherapie oder in einen experimentellen Studienarm mit der Kombination aus Daratumumab und Revlimid randomisiert.7 In die AURIGA-Studie wurden nur Patient:innen aufgenommen, die während der Induktionsphase keine CD38-Antikörpertherapie erhalten haben.
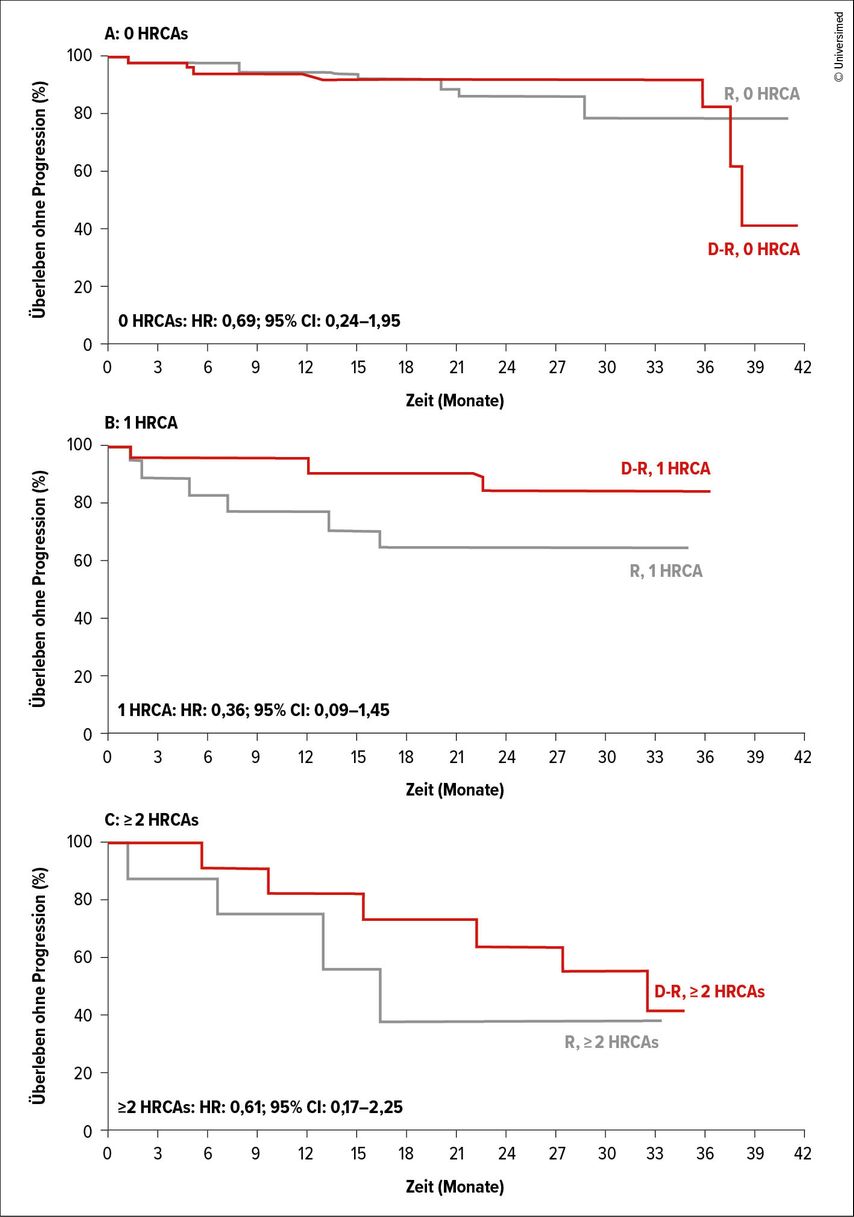
Der primäre Studienendpunkt war die Rate an einem MRDneg-Status 12 Monate nach Beginn der Erhaltungstherapie. Sekundäre Endpunkte umfassten das PFS, das OS und anhaltende MRD-Negativität. Die Kombinationstherapie mit Daratumumab und Revlimid führte zu einer signifikant höheren MRDneg-Rate von 50,5% im Vergleich zu 18,8%. Dies war auch mit einem signifikant längeren PFS und einer 47%igen Reduktion des Risikos für Progression oder Mortalität verbunden (HR: 0,53; 95% CI: 0,29–0,97; p=0,036). Der PFS-Vorteil war bei Patient:innen mit zytogenetischen Risikofaktoren besonders ausgeprägt (HR: 0,36, 95% CI: 0,09–1,45; Abb. 4).
Abb. 4: Randomisierter Vergleich einer Erhaltungstherapie mit Daratumumab/Lenalidomid mit Lenalidomid in der AURIGA-Studie. Progressionsfreies Überleben (PFS): A) Patient:innen mit keiner, B) Patient:innen mit einer und C) Patient:innen mit ≥2 zytogenetischen Hochrisiko-Aberrationen (HRCA; modifiziert nach Laahn F et al.)7
Insgesamt konnte mit der Kombination von Daratumumab mit Lenalidomid nach einer durchschnittlichen Behandlungsdauer von etwa zwei Jahren (Median 25 Monate) eine klinisch relevante Verlängerung des PFS erzielt werden.
MajesTec-4 (EMN 30): Teclistamab in der Erhaltungstherapie
In der dreiarmigen MajesTec-4-Studie soll die Wertigkeit einer Teclistamab-Lenaldomid-Erhaltungstherapie über 2 Jahre mit einer Teclistamab-Monotherapie bzw. einer Standard-Lenalidomid-Monotherapie bei insgesamt 1500 Patient:innen nach autologer Transplantation verglichen werden. Elena Zamagni hat beim ASH-Meeting die Ergebnisse der Run-in-Phase mit Teclistamab vorgestellt.8
In einem Studienarm wurde Teclistamab initial wöchentlich und danach alle vier Wochen gemeinsam mit Lenalidomid verabreicht, in der zweiten Gruppe wurde Teclistamab von Beginn an 4-wöchentlich gemeinsam mit Lenalidomid verabreicht, während in der dritten Gruppe Teclistamab 4-wöchentlich als Monotherapie appliziert wurde. Nach einem medianen Follow-up von 21,3 Monaten im ersten bzw. 9,2 Monaten in den beiden letztgenannten Therapiearmen wurde die Qualität des Ansprechens nach Transplantation in allen drei Gruppen dramatisch verbessert, wobei die Gruppe mit dem längsten Follow-up eine sCR(stringente komplette Remission)-Rate von 90,6% (CR-Rate 9,4%) erreicht hat. Dementsprechend lag in der erstgenannten Gruppe die MRDneg-Rate zum Zeitpunkt 12 Monate bei 100%.
Infektionen und Hypogammoglobulinämie waren die häufigsten nichthämatologischen Nebenwirkungen, die trotz empfohlener Immunglobulinprophylaxe zu verzeichnen waren. Bisher wurde eine behandlungsbedingte Grad-5-Nebenwirkung aufgrund einer Covid-19-Infektion beobachtet. Auf Basis der Ergebnisse der Run-in-Phase wurde mittlerweile für beide Teclistamab-Arme eine 4-wöchentliche Applikation ab Tag 1 der Erhaltungstherapie festgelegt und die Einbringung in die Studie eröffnet.
CC-92480-MM-002: Mezigdomid bei Patient:innen mit RRMM
Mezigdomid zählt zu der neuen Substanzgruppe der sogenannten „cereblon E3 ligase modulatory drugs“ (CELMoDS), die wie die bekannten „immunomodulatory imide drugs“ (IMiDs) an Cereblon binden und zu einer verstärkten Degradation von Aiolos und Ikarus führen, was in weiterer Folge zum Abbau der wichtigen Transkriptionsfaktoren IRF4 und Myc und letztlich zur Apoptose führt. Ein weiterer Vorteil von Mezigdomid liegt in der stärkeren Aktivierung der Immun-„Environments“.
Beim ASH-Kongress wurden nun die aktualisierten Ergebnisse der CC-92480-MM-002-Studie präsentiert, die eine beträchtliche Wirksamkeit der Kombination von Mezigdomid mit Bortezomib und Dexamethason bei Patient:innen mit RRMM zeigte.9 Die Gesamtansprechrate (ORR) lag bei 85,7% und das PFS bei 17,5 Monaten. Die häufigsten Grad-3/4-Nebenwirkungen waren Neutropenie (63%) und Infektionen (32,7%). Weitere klinische Untersuchungen werden den Nutzen von Mezigdomid speziell bei Lenalidomid- und Pomalidomid-resistenten Patient:innen zeigen.
Neue CAR-T-Zell-Konstrukte
Die klinische Entwicklung von CAR(„chimeric antigen receptor“)-T-Zell- Produkten, die an GPRC5D binden, zeigte erfreuliche Ergebnisse. Mit MCARH109-CAR-T-Zellen, die an das oben genannte Target binden, wurde in einer Phase-I/II- Studie bei 17 Patient:innen eine Ansprechrate von 71% erzielt, wobei 7 von 10 Patient:innen zuvor eine gegen BCMA gerichtete Behandlung erhalten hatten. Die mediane Ansprechdauer lag bei 8,6 Monaten. Bei 6 von 10 Patient:innen, die unter der Behandlung rezidivierten, wurde ein Verlust von GPRC5D an Myelomzellen festgestellt.10
Mehr klinische Daten liegen für BMS-986393-CAR-T-Zellen vor.11 Von den eingebrachten 79 Patient:innen waren 76% tripel-refraktär. Insgesamt konnte eine Ansprechrate von 87% und ein medianes PFS von 14,5 Monaten beobachtet werden. Als Anti-GPRC5D-assoziierte Nebenwirkungen wurden Gewichtsverlust (6%) sowie Veränderungen an Nägeln (19%), Haut (30%) und Mundschleimhaut (31%) festgestellt.
Eine weitere spannende Entwicklung betrifft die Verwendung von „D-domains“ anstelle der üblichen „single chain variable fragments“ (scFv) zur Bindung an Ziel-Antigene. Dabei handelt es sich um synthetische Proteine von etwa 8kDa, die verschiedene Vorteile wie besseren Zugang zu bestimmten Targets in einer komplexen Umgebung, größere Spezifität und höhere Avidität, größere Stabilität, verminderte Immunogenität, weniger „Off-target“-Effekte und verlängerte CAR-T-Zell-Persistenz aufweisen. In einer Phase-I/II-Studie mit „D-Domain“-basierten CAR-T-Zellen wurde eine Ansprechrate von 95% (CR: 65%) und eine PFS-Rate von 52% nach 27 Monaten beobachtet.12
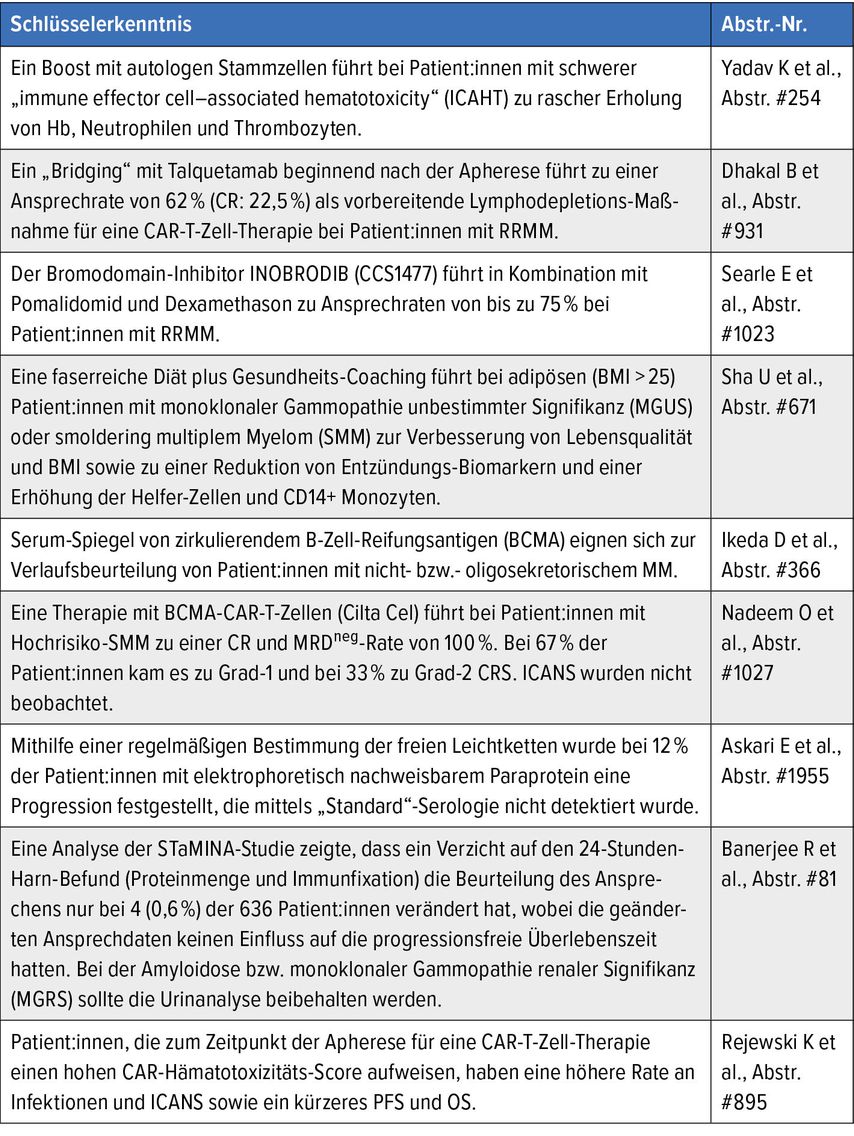
Weitere interessante Erkenntnisse vom ASH-Kongress 2024 finden Sie in Tabelle 1 zusammengefasst.
Literatur:
1 Nooka AK et al.: ASH 2024; Abstr. #1975 2 Raab MS et al.: ASH 2024; Abstr. #493 3 Quach H et al.: ASH 2024; Abstr. #1026 4 Saad Z et al.: ASH 2024; Abstr. #497 5 Goldschmidt H et al.: ASH 2024; Abstr. #769 6 Manier S et al.: ASH 2024; Abstr. #774 7 Laahn F et al.: ASH 2024; Abstr. #675 8 Zamagni E et al.: ASH 2024; Abstr. #494 9 Sandhu I et al.: ASH 2024; Abstr. #1025 10 Jurgens EM et al.: J Clin Oncol 2024; JCO2401785 11 Bal S et al.: ASH 2024; Abstr. #922 12 Bishop MR et al.: ASH 2024; Abstr. #4825
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...