Rundherdmanagement – eine ständige Herausforderung
Autor:
Priv.-Doz. Mag. Dr Gerlig Widmann, EBIR, FCIRSE
Geschäftsführender Oberarzt, Leitender Oberarzt Sektion Computertomografie
Leiter Kopf-Hals-Radiologie, Thorax-Radiologie und onkologische Radiologie
Universitätsklinik für Radiologie, Innsbruck
E-Mail: gerlig.widmann@i-med.ac.at
Im Rahmen von hochauflösenden Computertomografien werden inzidentelle Rundherde immer häufiger diagnostiziert. Um mit solchen Befunden adäquat umgehen zu können, bedarf es risikobasierter Handlungsempfehlungen.
Keypoints
-
Pulmonale Rundherde werden CT-morphologisch in solide und subsolide Rundherde unterteilt und entsprechen prämalignen bis invasiven Befunden von AAH, AIS, MIA bis zum invasiven Adenokarzinom.
-
Inzidentell entdeckte Rundherde sollten entsprechend den Fleischner Society Guidelines oder den BTS-Guidelines anhand einer Risikostratifizierung und Evaluierung der Volumenverdoppelungszeit abgeklärt werden.
-
Lungenkrebsscreening ist ausschließlich für Hochrisikopopulationen vorgesehen und erfordert ein strukturiertes und qualitätsgesichertes Screening-Programm mit einem Rundherdmanagement analog dem Lung-RADS oder dem EUPS.
Als pulmonalen Rundherd bezeichnet man eine fokale rundliche Verdichtung ≤3cm. Herde >3cm werden als Raumforderung und Herde ≤3mm als Mikronodulus klassifiziert. Rundherde werden in solide und subsolide Herde unterteilt. Subsolide bedeutet, dass Gefäßstrukturen nicht maskiert sind. Wenn in einem subsoliden Rundherd solide Anteile und Milchglaskomponenten vorliegen, bezeichnet man diesen als teilsoliden Rundherd, und wenn allein eine Milchglaskomponente vorliegt, als reinen Milchglasherd.
Diese Unterteilung hat insofern Bedeutung, als
-
atypische adenomatöse Hyperplasien (AAH, prämaligne) in der Computertomografie (CT) als reine Milchglasherde <5mm,
-
Adenokarzinome in situ (AIS, prämaligne) als reine Milchglasherde zwischen 5 mm und 30 mm,
-
minimal invasive Adenokarzinome (MIA, invasiv) als teilsolide Rundherde mit soliden Anteilen <5 mm
-
und invasive Adenokarzinome als größere teilsolide Rundherde oder solide Rundherde imponieren.
Die korrekte Größenmessung von Rundherden folgt den Empfehlungen der Fleischner Society.1 Bei Rundherden <10mm wird der Durchschnitt aus maximaler Längs- und Kurzachse angegeben, bei Rundherden ≥10mm werden sowohl Längs- als auch Kurzachse einzeln genannt. Subsolide Rundherde werden analog zu soliden Rundherden vermessen, bei teilsoliden Rundherden wird allerdings auch der maximale Durchmesser des soliden Anteils (falls >3 mm) angegeben. Ein zeitgemäßes Rundherdmanagement erfordert eine Software-unterstützte Volumenmessung, insbesondere zur optimalen Beurteilung der Größenänderung bei Verlaufsuntersuchungen.2
So entspricht eine Größenzunahme von 8mm auf 10mm (äquivalent 268mm3 auf 524 mm3) bereits einer Volumenzunahme von 96%. Darüber hinaus hat sich die Evaluierung der Volumenverdoppelungszeit in Tagen als ein hervorragendes Tool zur Dignitätsbeurteilung etabliert.
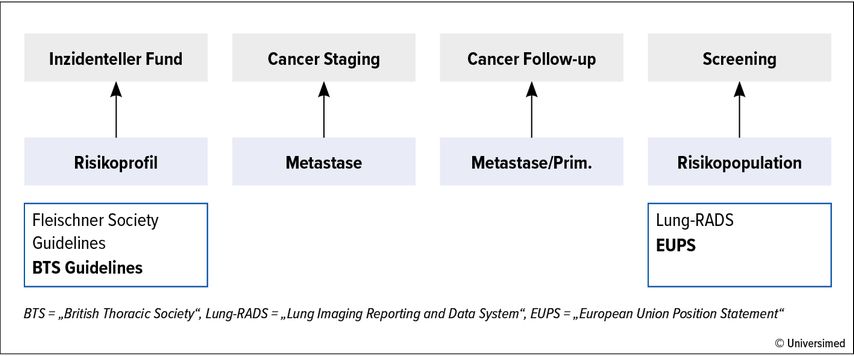
Für ein korrektes Rundherdmanagement sind sowohl die klinische Präsentation als auch der klinische Kontext zu berücksichtigen (Abb. 1). In diesem kurzen Referat wird das Management von inzidentell entdeckten Rundherden und solchen, die im Rahmen von Lungenkrebs-Screenings diagnostiziert werden, etwas näher erläutert.
Management von inzidentell entdeckten Rundherden
Das Malignitätsrisiko eines inzidentell entdeckten Lungenrundherds ist stark abhängig von der Größe des Herds und dem individuellen Lungenkrebsrisiko des Patienten. Zur Orientierung besonders relevant sind hier zwei verschiedene Guidelines, die Fleischner Society Guidelines und die BTS (British Thoracic Society) Guidelines.
Fleischner Society Guidelines
Nach den Fleischner Society Guidelines (Update 2017) werden solide Rundherde <6mm nicht weiter verlaufskontrolliert. Einzig bei Hochrisikopatienten (höheres Alter, schwere Raucher) mit suspekter Rundherdmorphologie und/oder Oberlappenlokalisation wird eine optionale Verlaufskontrolle in zwölf Monaten angeboten.3 Rundherde zwischen 6mm und 8mm werden innerhalb von 6–12 Monaten kontrolliert, ungeachtet dessen, ob das Risiko niedrig oder hoch ist. Rundherde >8mm werden nach drei Monaten kontrolliert, eine Positronen-Emissions-Tomografie/Computertomografie (PET-CT) oder eine bioptische Abklärung sind empfohlen.
Auch hier wird nicht zwischen niedrigem oder hohem Risiko unterschieden, und die Handlungsempfehlungen sind sehr breit gefasst. Milchglasherde ≥6mm werden nach 6–12 Monaten kontrolliert und bei Persistenz wird eine Kontrolle alle zwei Jahre bis zum fünften Jahr empfohlen. Teilsolide Herde ≥6mm werden nach 3–6 Monaten kontrolliert und falls unverändert und mit persistierender solider Komponente <6 mm jährlich für fünf Jahre kontrolliert. Diese Guidelines gelten ausschließlich für Patienten >35 Jahre ohne bekannte Malignität und ohne Immunkompromittierung.
BTS Guidelines
Die BTS Guidelines beinhalten deutlich konkretere Handlungsempfehlungen basierend auf einer Risikostratifikation und errechneten Volumenverdoppelungszeiten.4 Solide Rundherde <5 mm (äquivalent <80 mm3) werden nicht weiter verlaufskontrolliert. Herde zwischen 5 mm und 6 mm werden nach einem Jahr verlaufskontrolliert. Herde ≥8 mm (äquivalent ≥300 mm3) werden nach dem Brock-Modell stratifiziert und bei einem Malignitätsrisiko ≥10% einer PET-CT zugeführt. Hier erfolgt eine weitere Risikostratifikation nach dem Herder-Modell.
Bei neuerlichem Malignitätsrisiko ≥10% wird eine weitere invasive Abklärung empfohlen. Solide Rundherde ≥6mm (äquivalent ≥80 mm3) werden mit einer CT nach drei Monaten mit Bestimmung der Volumenverdoppelungszeit (VDT) kontrolliert. Bei einer VDT ≤400 Tage erfolgt eine invasive Abklärung, bei einer VDT zwischen 400 und 600 Tagen eine invasive Abklärung oder engmaschige Kontrolle je nach Patientenpräferenz und bei einer VDT >600 Tage je nach Patientenpräferenz keine weitere Nachsorge oder eine längerfristige Kontrolle. Für subsolide Rundherde >5mm wird eine CT-Kontrolle nach drei Monaten empfohlen. Bei einem klaren Wachstum oder veränderter Morphologie mit Größenzunahme von soliden Anteilen wird eine invasive Abklärung bzw. definitive Behandlung empfohlen. Bei Persistenz wird nach dem Brock-Modell stratifiziert und bei einem Malignitätsrisiko >10% das weitere Vorgehen individuell mit dem Patienten diskutiert.
Management im Rahmen von Lungenkrebs-Screenings
Ein Lungenkrebs-Screening mit einer jährlichen Niedrigdosis-CT führt bei der weltweit zweithäufigsten Krebsart und führenden Ursache von Krebstodesfällen zu einer signifikanten Reduktion der Lungenkrebsmortalität.5 Ein Screening wird daher sowohl von der US Preventive Service Task Force als auch von einer Europäischen Expertenkommission klar empfohlen, ist jedoch ausschließlich für Hochrisikopopulationen vorgesehen. Das sind in der Regel Probanden >50 Jahre mit einer Raucheranamnese von 20 Pack-Years und mehr, die derzeit rauchen oder innerhalb der letzten 15 Jahre mit dem Rauchen aufgehört haben. Für das Management der im Screening detektierten Rundherde sind klare Entscheidungsbäume gefordert, die eine hohe diagnostische Treffsicherheit bieten. Zu nennen sind das Lung-RADS Version 1.1 und das European Union Position Statement.
Lung-RADS Version 1.1
Im Lung-RADS („Lung Imaging Reporting and Data System“) Version 1.1 des American College of Radiology gibt es folgende Einstufungen:6
-
Befunde mit „Lung-RADS 1 – negativ“ (kein Rundherd oder definitiv gutartige Rundherde) und „Lung-RADS 2 – gutartig“ (solide Rundherde <6mm, teilsolide Rundherde <6mm, Milchglasherde <30mm) kommen beide in die nächste Screening-Runde nach zwölf Monaten (Malignitätsrisiko <1%, Prävalenz 90%).
-
„Lung-RADS 3 – wahrscheinlich gutartig“ (solide Rundherde ≥6 bis <8mm, teilsolide Rundherde ≥6mm, Milchglasherde ≥30mm) erfordert eine CT nach sechs Monaten (Malignitätsrisiko 1–2%, Prävalenz 5%).
-
„Lung-RADS 4A – suspekt“ (solide Rundherde ≥8 bis <15mm, teilsolide Rundherde ≥6mm mit solider Komponente ≥6 bis <8mm, Milchglasherde ≥30mm) erfordert eine CT nach drei Monaten oder eventuell eine PET-CT, falls eine solide Komponente ≥8mm vorliegt (Malignitätsrisiko 5–15%, Prävalenz 2%).
-
„Lung-RADS 4B und 4X – sehr suspekt“ (solide Rundherde ≥15mm, teilsolide Rundherde mit solider Komponente ≥8mm oder Kategorie 3 und 4 mit zusätzlichen Malignitätscharakteristika) erfordern eine weiterführende diagnostische und ggf. invasive Abklärung (Malignitätsrisiko >15%, Prävalenz 2%).
Eine Größenzunahme von >1,5mm im Verlauf führt zu einer Hochstufung auf die Kategorie 4A (Größenzunahme <4mm) oder 4B (Größenzunahme >4mm).
European Union Position Statement
Im European Union Position Statement (EUPS) wird folgendes Vorgehen empfohlen:7
-
Als negatives Screening-Ergebnis gelten solide Rundherde <5mm. Sie kommen in die nächste Screening-Runde.
-
Als positives Screening-Ergebnis werden solide Rundherde ≥10mm oder ≥300mm3 definiert, für die eine weiterführende Abklärung bzw. definitives Management vorgesehen ist.
-
Als indeterminierte Ergebnisse gelten solide Rundherde ≥5 bis <10mm oder ≥100 bis <300mm3, teilsolide Rundherde ≥5mm und Milchglasherde >100mm3. Diese werden nachh drei Monaten kontrolliert, bei einer VDT <400 Tage weiterführend abgeklärt, bei einer VDT zwischen 400 und 600 Tagen neuerlich nach drei Monaten kontrolliert und bei einer VDT >600 Tage in die nächste Screening-Runde entlassen.
Lungenkrebs-Screening erfordert ein strukturiertes, qualitätsgesichertes Programm mit einem multidisziplinären Team aus Radiologie (diagnostisch, interventionell), Pulmologie, Thoraxchirurgie, internistischer Onkologie, Radioonkologie, Pathologie, und einem verpflichtenden Angebot zur Raucherentwöhnung. Unstrukturiertes Screening birgt die Gefahr einer Überdiagnose mit unnötigen Verlaufsuntersuchungen und potentieller Schädigung durch invasive Abklärung von falsch-positiven Rundherden.
Literatur:
1 Bankier AA et al.: Recommendations for measuring pulmonary nodules at CT: a statement from the Fleischner Society. Radiology 2017; 285(2): 584-600 2 Oudkerk M et al.: European position statement on lung cancer screening. Lancet Oncol 2017; 18(12): e754-66 3 Bueno J et al.: Updated Fleischner Society Guidelines for managing incidental pulmonary nodules: common questions and challenging scenarios. Radiographics 2018; 38(5): 1337-50 4 Graham RNJ et al.: Return of the pulmonary nodule: the radiologist‘s key role in implementing the 2015 BTS guidelines on the investigation and management of pulmonary nodules. Br J Radiol. 2016; 89(1059): 20150776 5 de Koning HJ et al.: Reduced lung-cancer mortality with volume CT screening in a randomized trial. N England J Med. 2020 Feb 6; 382(6): 503-13 6 Kastner J et al.: Lung-RADS Version 1.0 versus Lung-RADS Version 1.1: comparison of categories using nodules from the national lung screening trial. Radiology 2021; 300(1): 199-206 7 Kauczor HU et al.: ESR/ERS statement paper on lung cancer screening. Eur Radiol 2020; 30(6): 3277-94
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...