Vaskuläre Anomalien aus plastisch-chirurgischer Sicht
Klinische Abteilung für Plastische und Rekonstruktive Chirurgie<br> Medizinische Universität Wien<br> E-Mail: christine.radtke@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Sie können zu funktionellen und signifikanten kosmetischen Problemen des Patienten oder aber zu lebensbedrohlichen Blutungen führen. Eine optimale interdisziplinäre Zusammenarbeit von plastischen Chirurgen, Radiologen, ggf. Pädiatern, Mund-Gesichts-Kiefer-Chirurgen, Dermatologen und Pathologen ist für die erfolgreiche Diagnostik und Therapie notwendig. Bisherige Einteilungen haben zu Schwierigkeiten geführt. In dieser Arbeit wird ein Algorithmus zur klinischen und bildgebenden Diagnostik vaskulärer Anomalien vorgestellt. Die Indikationen zur Behandlung werden diskutiert und die Therapieoptionen erläutert.
Keypoints
-
Für die erfolgreiche Diagnostik und Therapie ist eine optimale interdisziplinäre Zusammenarbeit unumgänglich.
-
Es zeigt sich ein breites Spektrum an Malformationen, das von einfachen Schwellungen oder Farbveränderungen der Haut bis hin zu lebensbedrohlichen Entitäten reichen kann.
-
Insgesamt unterscheidet man zwischen vaskulären Malformationen und Hämangiomen, wobei auch Kombinationen auftreten können.
-
Grundlage der Therapieentscheidung ist eine international anerkannte Klassifikation vaskulärer Anomalien.
In der Vergangenheit hat es Unstimmigkeiten bezüglich der Nomenklatur für vaskuläre Anomalien gegeben. Basierend auf dem klinischen Verhalten und den endothelialen Zellcharakteristika haben Mulliken und Glowacki (1982) eine Klassifizierung der vaskulären Anomalien der maxillofazialen Region erstellt, und es werden zwei Hauptgruppen unterschieden: Hämangiome und vaskuläre Malformationen.1, 2 Zur weiteren Einteilung werden nach der Klassifikation durch die International Society for the Studies of Vascular Anomalies (ISSVA) die jeweiligen biologischen Eigenschaften wie Zelltypen, Zellproliferation und Hämodynamik der vaskulären Anomalien berücksichtigt.3
Zuletzt wurde diese Klassifikation 2014 erneuert und die Entitäten können wie in Tabelle 1 dargestellt unterschieden werden.4

Tab. 1: ISSVA-Klassifikation vaskulärer Anomalien, 2014
Auch wenn ein rein auf Abwarten ausgelegtes Konzept bei unkomplizierten Hämangiomen im Säuglingsalter vielfach empfohlen werden kann, erfordert das rasch proliferative Wachstum solcher Läsionen eine adäquate Therapie.5 Demgegenüber müssen vaskuläre Malformationen, die normalerweise lebenslang persistieren, meist behandelt werden, insbesondere dann, wenn klinische Symptome auftreten. Aufgrund individueller Parameter wie Durchmesser, Lage oder Wachstumsverhalten können verschiedene Therapiemaßnahmen wie zum Beispiel Kryotherapie, Kortikosteroidtherapie, Lasertherapie, Sklerotherapie, operative Maßnahmen und/oder Embolisation erfolgreich durchgeführt werden. Keines dieser Behandlungskonzepte stellt jedoch die einzige Behandlungsmethode der Wahl dar.6
Hämangiome
Hämangiome sind die am häufigsten auftretenden Tumoren im Säuglings- und Kleinkindesalter mit einer bevorzugten Manifestation von 60% im Kopf-Hals-Bereich.7 Sie machen einen Anteil von 7–10% aller gutartigen Weichteiltumoren aus. Typische Lokalisationen sind Augenlider, Stirn, Wange oder die Parotisloge. Das Hämangiom stellt einen echten vaskulären Tumor dar, welcher bedingt ist durch ein vermehrtes Wachstum.
Charakteristischerweise wächst das Hämangiom proportional schneller als der Säugling. Hämangiome sind bei der Geburt meist noch nicht erkennbar. Die Mehrheit der Hämangiome entwickelt sich innerhalb des ersten Lebensjahres mit typischem schnellem Wachstum (proliferative Phase) und wird dann von den Eltern wahrgenommen.
Danach zeigen die meisten Hämangiome Anzeichen der Involution,8 der Prozess der Rückbildung ist normalerweise langsam und nicht vor dem 5.–9. Lebensjahr komplett abgeschlossen (Involutionsphase). In ca. 50% der Fälle kommt es nach der Involution zu bleibenden Residuen im Sinne von Narben, atrophen Hautveränderungen, Telangiektasien oder Falten.9
Das Hämangiom wächst durch die Proliferation endothelialen Gewebes. Während der Phase des raschen Wachstums ist die Zahl an Mastzellen innerhalb des Endothels erhöht.10, 11
Initial werden Hämangiome als erythematöse, makulopapuläre Strukturen mit Telangiektasien bemerkt, welche dann durch schnelle Proliferation an Größe nehmen und dabei ihr Kolorit verändern. Weiters zeigt sich klinisch eine überwärmte Schwellung mit beerenartiger Oberflächenstruktur (Abb. 1). Die meisten der oberflächlichen Hämangiome können durch die klinische Untersuchung im Zusammenhang mit einer exakten Anamnese diagnostiziert werden. Die klinische Untersuchung sollte je nach Lage auch ggf. die intraorale oder pharyngeale Ausdehnung (durch Endoskopie) einschließen. Die bildgebende Diagnostik beinhaltet die Sonografie, ggf. sollte diese durch farbkodierte Duplexsonografie komplettiert werden. Zur Bestimmung der Tiefenausdehnung oder Infiltration angrenzender Strukturen wie Orbita oder Parotis haben sich das CT und/oder das MRT als hilfreich erwiesen.12
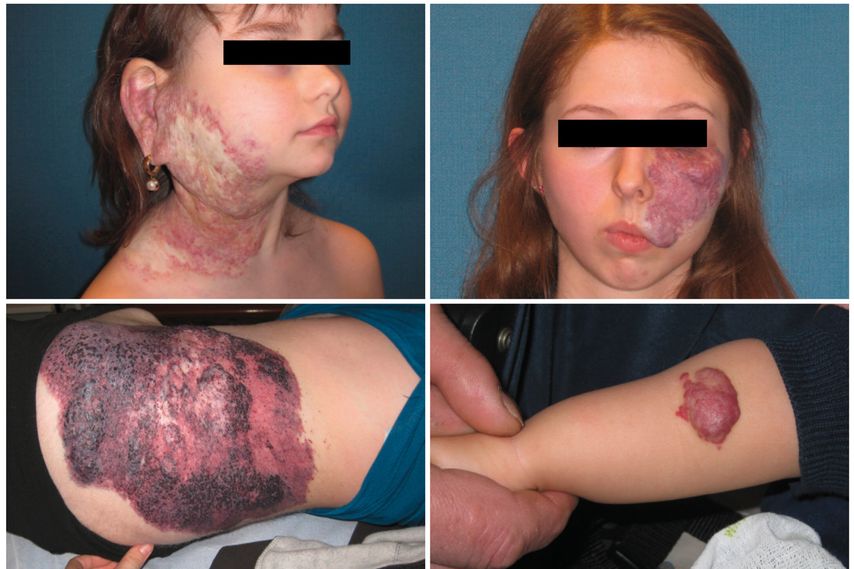
Abb. 1: Verschiedene Erscheinungsformen von Hämangiomen
Intraossäre Hämangiome sind extrem selten, können jedoch zu schwerwiegenden Komplikationen am betroffenen Skelettabschnitt führen.13
Zunächst sollte zur Beurteilung der Wachstumsdynamik eine engmaschige klinische Kontrolle stattfinden. Eine Therapie ist bei plötzlich einsetzender Proliferation oder funktioneller Beeinträchtigung indiziert. Als Behandlungskonzept steht eine Vielzahl von Optionen zur Verfügung, Jede Therapiemöglichkeit ist von den individuellen Gegebenheiten abhängig. Die Kryotherapie ist bei kleinen, oberflächlichen Hämangiomen zu empfehlen.14 Größere Läsionen können in Abhängigkeit von ihrer Eindringtiefe mit verschiedenen Lasern abgetragen werden.15
Bei schnell proliferierenden Hämangiomen sind Kortikosteroide empfohlen, bei schnell proliferierenden Tumoren mit lebensbedrohlichem Ausmaß eine Interferon-α-2a-Therapie.16
Die orale Kortikoidtherapie bei proliferierenden Hämangiomen kann über mehrere Wochen erfolgen, mit 2–5mg/kg KG über 3–4 Wochen mit anschließender Dosisreduktion über 8 Wochen. Eine Reduktion sollte unter diesem Schema in den ersten 1–2 Wochen erkennbar sein, bei ausbleibendem Therapieerfolg in diesem Zeitraum sollte die Therapie abgebrochen und eine chirurgische Exzision empfohlen werden. Die Kortikoidtherapie hat sich nur im proliferativen Stadium als wirksam erwiesen. Bei stark proliferierenden Hämangiomen mit Lebensbedrohung (z.B. im Kopf-Hals-Bereich) kann eine Interferon-α-2a-Therapie erfolgen. Bei einer Ansprechrate von nur ca. 50% und schwerwiegenden Nebenwirkungen ist die Indikation sehr streng zu stellen.17 Die chirurgische Intervention sollte generell nur bei kleinen Hämangiomen oder sekundär bei Residuen nach Involution erfolgen. Die chirurgische Exzision ist indiziert bei kritischer anatomischer Lage oder schnellem Wachstum, welches zu Hautdefekten und sogar Hautnekrosen führen kann. Individuell zu erwägen ist eine präoperative Embolisation bzw. die Kombination der Exzision mit anschließender Lasertherapie bei bestehenden Residuen. Bei funktioneller Beeinträchtigung des Gesichtsfeldes, des Luftweges, bei akuten Blutungen, Ulzerationen oder Infektionen ist eine sofortige Intervention angebracht.18
Vaskuläre Malformationen
Zu den vaskulären Malformationen gehören die venösen, lymphatischen, kapillären und arteriovenösen Malformationen. Insgesamt werden die Malformationen aufgrund ihrer Hämodynamik in „High flow“ und „Low flow“-Läsionen eingeteilt. Kapilläre, venöse und lymphatische Malformationen werden zu den „Low flow“-Läsionen gezählt. Arterielle und arteriovenöse Malformationen zeigen einen schnellen Blutfluss („high flow“) und es besteht hier das Risiko für spontan auftretende Blutungen, welche mit zunehmendem Alter gefährlicher werden können.19, 20
Vaskuläre Malformationen sind anlagebedingte Fehlbildungen, die aus dysmorphen Gefäßen entstehen. Im Gegensatz zu den Hämangiomen bestehen hier keine zelluläre Proliferation, keine schnelle Proliferationsphase oder spontane Rückbildung. Sie sind schon bei Geburt angelegt bzw. vorhanden. Annähernd 31% der vaskulären Malformationen treten im Kopf-Hals-Bereich auf.21 Im Gegensatz zu den Hämangiomen zeigen die vaskulären Malformationen ein kontinuierliches Wachstum ohne Anzeichen einer Involution.22Sie wachsen im Verhältnis proportional mit dem Patienten, zusätzlich können Traumata, Infektionen und hormonelle Umstellungen wie Pubertät oder Schwangerschaft das Wachstum stimulieren. Der zugrunde liegende Mechanismus des Wachstums ist nicht durch eine endotheliale Proliferation, sondern durch die Flusseigenschaften innerhalb der Läsion undin ihrer Umgebung bestimmt. Es ist ein Resultat der Bildung von Kollateralgefäßen und der Dilatation von beteiligten Gefäßen.23
In vielen Fällen kann die Diagnose durch die Anamnese gestellt werden. Obwohl sie schon bei der Geburt vorhanden sind, werden die Läsionen nicht sofort erkannt, sondern erst im Verlauf, wenn es zu einer klinisch wahrnehmbaren Vergrößerung kommt.
Venöse Malformationen
Venöse Malformationen sind bei der Geburt meist als kleine, bläuliche Läsionen angelegt, welche sich dann im weiteren Verlauf zu einem schwammartigen Gebilde vergrößern. klinisch präsentieren sie sich als weiche, zusammendrückbare Struktur mit typischer blauer Verfärbung (Abb. 2). Die Auskultation zeigt keine Strömungsgeräusche. Durch Manöver, welche den venösen Druck erhöhen (bei Läsionen im Kopf-Hals-Bereich z.B. Kopftieflage, Valsalva-Manöver) kann es zu einer vorübergehenden Vergrößerung der venösen Läsion kommen. Das Fehlen von Strömungsgeräuschen oder tastbarem Schwirren zeigt die „Low flow“-Läsion an.24 In der bildgebenden Darstellung sind Phleboliten wegweisend für „Low flow“-Läsionen.25
Einige der venösen „Low flow“-Malformationen können während der operativen Exzision Blutungen verursachen. Deshalb ist es wichtig, vor der operativen Therapie die Größe der Läsion und die Flusseigenschaften ggf. mithilfe einer Angiografie zu bestimmen. Die Behandlung der venösen Malformationen hängt ab von der Größe und Lokalisation der Läsion.26
Abb. 2: Venöse und AV-Malformationen
Bei größeren, invasiven Malformationen ist es ratsam, die Sklerosierungstherapie in Kombination mit der chirurgischen Therapie anzuwenden. Kane et al. haben erst kürzlich eine signifikante Patientenzufriedenheit mit der Sklerosierungstherapie durch „tetradecyl sulfate“ (Sotradecol) in Kombination mit der Ablation gezeigt. Es ist noch wichtig anzumerken, dass die Sklerosierungstherapie nur als zusätzliche Therapie zur angemessenen chirurgischen Ablation zu sehen ist.27, 28
Lymphatische Malformationen
Lymphatische Malformationen sind normalerweise farblos, die darüberliegende Haut stellt sich als unauffällig dar (Abb. 3). Es sind nichtpulsierende, schmerzlose Raumforderungen der Weichteile. Man unterscheidet die makrozytische Form, auch als Hygrom bezeichnet, von der mikrozytischen Form, welche sich bei Inzision mit charakteristischen intrakutanen Bläschen darstellt. Es kann bei akuten Infektionen zu spontaner schneller Größenzunahme kommen, in dessen Folge letztlich auch durch verdrängendes Wachstum funktionelle Störungen eintreten können.29
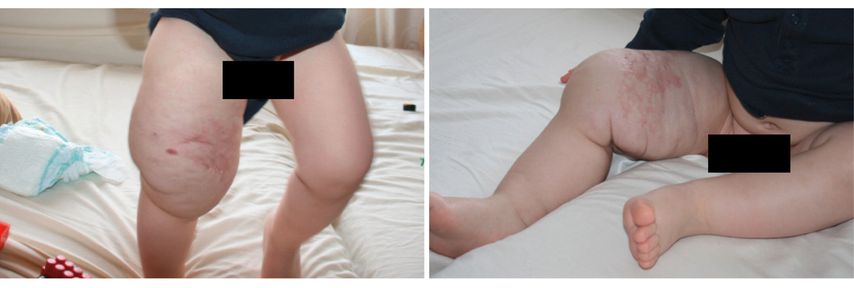
Abb. 3: Lymphatische Malformationen
Lymphatische Malformationen sind schwieriger zu behandeln – gerade wegen der fehlenden klaren Demarkation und der infiltrativen Natur der lymphatischen Gefäße. Deshalb sind hierfür in erster Linie nicht operative Interventionen vorzuziehen,30 etwa die Steroidtherapie, Radiatio oder Sklerosierungstherapie. Besonders die Bleomycin-Sklerotherapie und die OK-432-Sklerotheraphie haben vielversprechende Ergebnisse in der Behandlung der lymphatischen Malformationen gezeigt, sowohl präoperativ als auch möglicherweise als Ersatz für die operative Therapie.31, 32
Des Weiteren hat sich in den letzten Jahren vor allem für die Behandlung von komplexen lymphatischen Malformationen die Therapie mit Sirolimus als effektiv erwiesen. Sirolimus, auch bekannt als Rapamycin, ist eine Serin-/Threoninkinase, welche den PI3K/AKT/mTOR-Pathway reguliert, der wiederum eine wichtige Rolle im Hinblick auf Zelltod, Angiogenese und Zellwachstum spielt.33
Sirolimus wurde 1999 als Immunsuppressivum zugelassen, die antiangiogenetischen und antiproliferativen Eigenschaften dieses Medikaments haben in der Behandlung von lympathischen Malformationen einen großen Einfluss.34 Tian et al. zeigten in ihrer Studie mit 56 Fällen von Kindern mit lymphatischen Malformationen eine eindeutige Verbesserung unter Sirolimustherapie.35
Arteriovenöse Malformationen
Arteriovenöse (AV) Malformationen sind „High flow“-Läsionen, welche aus einer hohen Anzahl an schnell durchflossenen Gefäßen bestehen. Sie setzen sich zusammen aus dilatierten zuführenden Arterien mit abführenden Venen. Im Unterschied zu AV-Fisteln zeigt sich bei den AV-Malformationen ein zwischengeschalteter Nidus aberranter Gefäße. Die Anlage dieser ist bei der Geburt bereits schon vorhanden, sie zeigen sich aber oft über Jahrzehnte nicht symptomatisch.36
Es werden 4 Stadien unterschieden: Ruhephase, Evolution, Destruktion und Dekompensation.37 In der symptomatischen Phase kann es durch venöse Hypertension zu einer Gewebeischämie kommen, welche Schmerzen, Ulzerationen oder Blutungen verursacht. Klinisch erscheinen diese Läsionen als gefärbt, oft überwärmt, mit fester Konsistenz (Abb. 4). Ein Schwirren kann getastet oder auskultiert werden. Gelegentlich zeigt sich eine Schwellung oder eine Asymmetrie. Oftmals präsentiert sich der Patient erstmals mit akuter Blutung.
Bildgebende Darstellung vaskulärer Malformationen
Viele der vaskulären Malformationen zeigen bis zur Adoleszenz nur wenige radiografisch darstellbare Zeichen und ein signifikanter Prozentsatz weist keine knöcherne Beteiligung auf. Bei knöcherner Beteiligung kann dann eine sogenannte Seifenblase oder honigwabenartige Struktur als radiologisches Kennzeichen sichtbar sein. Mittels „magnetic resonance imaging“ (MRI) kann zwischen „Low flow“- und „High flow“-Läsionen differenziert werden.38
CT-Aufnahmen können zur Beurteilung der Ausdehnung der Läsion in dem umgebenden Gewebe dienen. Doppler-Sonografie kann zwischen „Low flow“- und „High flow“-Läsionen unterscheiden. Mit einer Angiografie kann nicht nur die Größe beschrieben/abgegrenzt, sondern zusätzlich auch die Flussrate durch die Läsion beurteilt werden.39–41
Behandlungsindikation
Die Behandlungsindikation basiert auf der klinischen Symptomatik. Sich vergrößernde Läsionen mit Ulzerationen und Blutungen sind teils eine Notfallindikation.
Die isolierte Sklerosierungstherapie hat sich bei kleineren Läsionen als erfolgreich erwiesen, z.B. die direkte Injektion von Ethibloc. Diese ist mit einer Komplikationsrate von 4,7% bis 14,3% eine relativ sichere Therapieoption für vaskuläre Malformationen der oberen und unteren Extremitäten.42 Während bei arteriovenösen „Low flow“-Malformationen eine direkte Injektion die Therapie der Wahl darstellt, sollte die Embolisierung bei „High flow“-Malformationen gemeinsam mit einer selektiven Katheterangiografie durchgeführt werden.42
Diese Maßnahme wird vor dem operativen Eingriff durchgeführt, um das Risiko schwerwiegender Blutungen während der Operation zu minimieren. „High flow“-Läsionen können Turbulenzen im Durchflussgebiet aufweisen, was wiederum das Risiko für Koagulopathien erhöht. Arterielle Embolisation hat sich präoperativ zur operativen Entfernung als erfolgreich erwiesen, besonders bei intraossären Läsionen.43 Das vorrangige Ziel ist dabei, den Blutfluss in der Malformation zu reduzieren, und zwar ohne Disruption des Flusses durch die proximalen Feedergefäße. Die chirurgische Exzision sollte optimalerweise innerhalb von 24–48h nach Embolisation erfolgen und niemals später als nach 10 Tagen. Es wird angenommen, dass es kurzzeitig nach Embolisation zu einer Kollateralenbildung kommt, wobei die verzögerte Exzision die Möglichkeit des Auftretens intra- und postoperativer Blutungen erhöht. Das Ziel besteht in einer vollständigen Entfernung der Malformation.
Perioperative Nachsorge
Die perioperative Nachsorge umfasst die Kontrolle der lokalen Durchblutungs- und Kreislaufsituation, der Wundsituation, der Regression oder Progression der Läsion durch sonografische Kontrolle oder CT/MRT-Untersuchungen, eine regelmäßige Fotodokumentation sowie eine gute Führung der oft jungen Patienten und besonders auch der Eltern. Auf eine gute Patientenführung ist nicht nur bei der Nachsorge sondern vor allem auch, wenn – wie bei manchen Hämangiomen der Fall – mit einer therapeutischen Intervention zugewartet wird, zu achten.
Postoperative Komplikationen
Komplikationen sind lokale Infektionen, Ulzerationen, Hypopigmentationen, Ausbildung von Hauttaschen, Narbenbildungen oder funktionelle Einschränkungen. Bei unzureichender Entfernung des Nidus bei AV-Malformationen kann es zu schwer kontrollierbaren Rezidiven kommen. Besonders in der Gruppe der AV-Malformationen bestimmt der Zeitpunkt des Eingriffes das Ergebnis mit: So beträgt die Erfolgsrate der chirurgischen Behandlung in der Ruhephase (nach Schobinger) 75% und nimmt im Verlauf der weitergehenden Stadien wie der Evolutionsphase, der Phase der Destruktion bis hin zum Stadium der Dekompensation kontinuierlich ab.44
Der Einsatz von topischen Steroiden, beispielsweise im Augenbereich, kann zu lokalen Nekrosen, Infektionen, Weichteilatrophie, Augapfelpenetration bis hin zur Erblindung führen. Die Anwendung von Interferon-α-2a kann zu unerwünschten neurologischen Komplikationen führen.45
Ebenso haben auch weitere der bei lebensbedrohlichen Konstellationen eingesetzten Therapiemöglichkeiten, wie Chemotherapie, Bestrahlung, Embolisation und Chirurgie oft weitreichende Komplikationen, die hier nicht im Einzelnen aufgeführt werden.
Die Radikalität der chirurgischen Sanierung ist abhängig vom Ausmaß der Läsion. Falls keine R0-Resektion möglich ist, sollte zumindest eine Verkleinerung angestrebt werden. Wann immer möglich sollten funktionielle anatomische Strukturen erhalten werden, daher ist ein multimedialer Therapieansatz unentbehrlich.
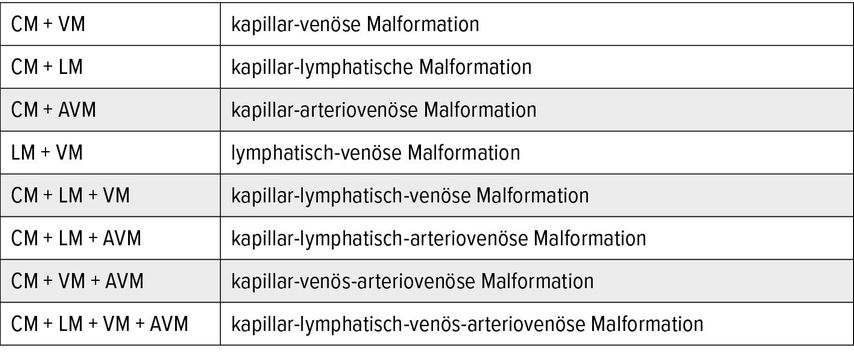
Tab. 2: Einteilung kombinierter vaskulärer Malformationen nach dem ISSVA-Schema 2014
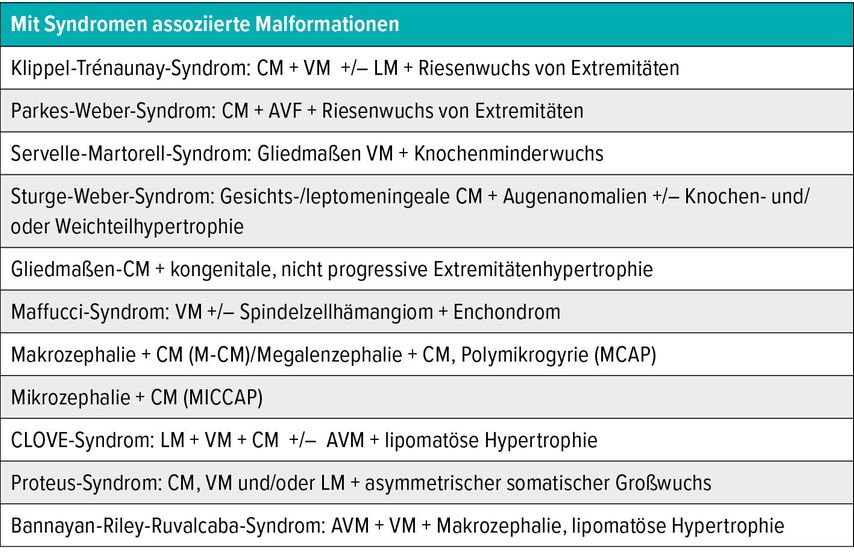
Tab. 3: Mit Syndromen assoziierte Malformationen
Literatur:
1 George A et al.: Update on the classification of hemangioma. J Oral Maxillofac Pathol 2014; 18(Suppl 1): S117-20 2 Mulliken JB et al.: Classification of pediatric vascular lesions. Plast Reconstr Surg 1982; 70(1): 120-1 3 Wassef M et al.: Vascular Anomalies Classification: Recommendations from the International Society for the Study of Vascular Anomalies. Pediatrics 2015; 136(1): e203-14 4 Wassef M et al.: Vascular Anomalies Classification: Recommendations from the International Society for the Study of Vascular Anomalies. Pediatrics 2015; 136 (1): e203-e214 5 Lobo-Mueller E et al.: Extremity vascular anomalies in children: introduction, classification, and imaging. Semin Musculoskelet Radiol 2009; 13(3): 210-35 6 Krowchuk DP et al.; Clinical Practice Guideline for the Management of Infantile Hemangiomas. Pediatrics 2019; 143(1): e20183475 7 Krowchuk DP et al.; Subcommittee on the Management of Infantile Hemangiomas: Clinical Practice Guideline for the Management of Infantile Hemangiomas. Pediatrics 2019; 143(1): e20183475 8 Léauté-Labrèze C et al.: Infantile haemangioma. Lancet 2017; 390(10089): 85-94 9 Boull C, Maguiness SM: Congenital hemangiomas. Semin Cutan Med Surg 2016; 35(3): 124-7 10 Tan ST et al.: Mast cells and hemangioma. Plast Reconstr Surg 2004; 113(3): 999-1011 11 Pasyk KA et al.: Quantitative evaluation of mast cells in cellularly dynamic and adynamic vascular malformations. Plast Reconstr Surg 1984; 73(1): 69-77 12 Johnson CM, Navarro OM: Clinical and sonographic features of pediatric soft-tissue vascular anomalies part 2: vascular malformations. Pediatr Radiol 2017; 47(9): 1196-208 13 Brandner JS et al.: Intraosseous hemangioma of the frontal bone. Report of a case and review of the literature. J Oral Maxillofac Surg 2018; 76(4): 799-805 14 Araujo MR et al.: Sclerotherapy and cryotherapy in the management of oral vascular lesions: a series of 10 cases. Gen Dent 2016; 64(5): 25-9 15 Azma E, Razaghi M.: Laser treatment of oral and maxillofacial hemangioma. J Lasers Med Sci 2018; 9(4): 228-32 16 Liu KX et al.: Characterization of long-term outcomes for pediatric patients with epithelioid hemangioma. Pediatr Blood Cancer 2019; 66(1): e27451 17 Darrow DH et al.; Section on Dermatology, Section on Otolaryngology–Head and Neck Surgery, and Section on Plastic Surgery: Diagnosis and management of infantile hemangioma. Pediatrics 2015; 136(4): e1060-104 18 Darrow DH et al.; Section on Dermatology, Section on Otolaryngology–Head and Neck Surgery, and Section on Plastic Surgery: Diagnosis and management of infantile hemangioma. Pediatrics 2015; 136(4): e1060-104 19 Jackson IT et al: Hemangiomas, vascular malformations, and lymphovenous malformations: classification and methods of treatment. Plast Reconstr Surg 1993; 91: 1216-30 20 Ballah D et al.: Vascular anomalies: what they are, how to diagnose them, and how to treat them. Curr Probl Diagn Radiol 2011; 40: 233-47 21 Mahady K et al.: Vascular anomalies of the head and neck in children. Quant Imaging Med Surg 2015; 5: 886-97 22 Jackson IT et al.: Hemangiomas, vascular malformations, and lymphovenous malformations: classification and methods of treatment. Plast Reconstr Surg 1993; 91: 1216-30 23 Ballah D et al.: Vascular anomalies: what they are, how to diagnose them, and how to treat them. Curr Probl Diagn Radiol 2011; 40: 233-47 24 Greene AK, Alomari AI: Management of venous malformations. Clin Plast Surg 2011; 38: 83-93 25 Eivazi B et al.: Phleboliths from venous malformations of the head and neck. Phlebology 2013; 28(2): 86-92 26 Jackson IT et al.: Hemangiomas, vascular malformations, and lymphovenous malformations: classification and methods of treatment. Plast Reconstr Surg 1993; 91: 1216-30 27 Bowman J et al.: Outcomes of sclerotherapy and embolization for arteriovenous and venous malformations. Semin Vasc Surg 2013; 26: 48-54 28 Kane WJ et al.: Significant hemangiomas and vascular malformations of the head and neck: clinical management and treatment outcomes. Ann Plast Surg 1995; 35(2): 133-43 29 Greene AK et al.: Management of lymphatic malformations. Clin Plast Surg 2011; 38: 75-82 30 Defnet AM et al.: Pediatric lymphatic malformations: evolving understanding and therapeutic options. Pediatr Surg Int 2016; 32(5): 425-33 31 Muir T et al.: Intralesional bleomycin injection (IBI) treatment for haemangiomas and congenital vascular malformations. Pediatr Surg Int 2004; 19: 766-73 32 Yoo JC et al.: OK-432 sclerotherapy in head and neck lymphangiomas: long-term follow-up result. Otolaryngol Head Neck Surg 2009; 140(1): 120-3 33 Wiegand S et al.: Treatment of lymphatic malformations with the mTOR inhibitor sirolimus: a systematic review. Lymphat Res Biol 2018; 16(4): 330-9 34 Wiegand S et al.: Treatment of lymphatic malformations with the mTOR inhibitor sirolimus: a systematic review. Lymphat Res Biol 2018; 16(4): 330-9 35 Tian R et al.: Effectiveness of sirolimus in the treatment of complex lymphatic malformations: Single center report of 56 cases. J Pediatr Surg 2020; S0022-3468(19)30931-5 36 Jackson IT et al.: Hemangiomas, vascular malformations, and lymphovenous malformations: classification and methods of treatment. Plast Reconstr Surg 1993; 91: 1216-30 37 Collin AC et al.: Intraosseous arteriovenous malformations. Rev Stomatol Chir Maxillofac 2010; 111(1): 11-8 38 Hyodoh H et al.: Malformations: imaging, treatment approaches and therapeutic issues. Radiographics 2005; 25: 159-72 39 Ohgiya Y et al.: Dynamic MRI for distinguishing high-flow from low-flow peripheral vascular malformations. Am J Roentgenol 2005; 185: 1131-7 40 Gruber H, Peer S: Ultrasound diagnosis of soft tissue vascular malformations and tumours. Curr Med Imaging Rev 2009; 5: 55-61 41 Gaimari G et al.: Color-Doppler ultrasound in the diagnosis of oral vascular anomalies. N Am J Med Sci 2014; 6: 1-5 42 Chung Sim Lim et al.: Incidence of major complication following embolo-sclerotherapy for upper and lower extremity vascular malformations. Vascular 2020; 1708538120937616 43 Bowman J et al.: Outcomes of sclerotherapy and embolization for arteriovenous and venous malformations. Semin Vasc Surg 2013; 26: 48-54 44 Müller-Wille R et al.: Vascular anomalies (part II): Interventional therapy of peripheral vascular malformations. Rofo 2018; 190(10): 927-37 45 Lackner H et al.: Sirolimus for the treatment of children with various complicated vascular anomalies. Eur J Pediatr 2015; 174(12): 1579-84
Das könnte Sie auch interessieren:
Filler sicher injizieren
Filler haben es zurzeit schwer. Gerade in der Laienpresse wird kritisch über sie berichtet (z.B. ARD/WDR: „Markt“ vom 16.10.2024). Dabei sind Filler – hier vor allem die ...
Narbenbehandlungen und Korrektureingriffe in der Praxis
Sowohl symptomatische und funktionell einschränkende Narben als auch ästhetisch störende und die Lebensqualität beeinträchtigende Vernarbungen machen eine differenzierte Narbentherapie ...
Optimierung des direkten Brauenliftings
Ein direkter Brauenlift bietet oft die präziseste und langfristigste Lösung, wenn es darum geht, eine abgesunkene Braue ästhetisch anzuheben. Gerade bei asymmetrischen oder künstlich ...