mCRPC – State of the Art, und was kommt 2025?
Autor:innen:
Priv.-Doz. Dr. Angelika Terbuch
Univ.-Prof. Dr. Thomas Bauernhofer
Klinische Abteilung für Onkologie
Medizinische Universität Graz
E-Mail: angelika.terbuch@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In den letzten Jahren haben sich neben der Chemotherapie mit Docetaxel und Cabazitaxel und den beiden „new hormonal agents“ (NHA) Enzalutamid sowie Abirateron nun die PARP-Inhibitoren beziehungsweise die Radioligandentherapien mit 177Lu-PSMA und Radium-223 als effektive Behandlungsoptionen bei Patienten mit metastasiertem kastrationsrefraktärem Prostatakarzinom (mCRPC) etabliert. Die Herausforderung ist die Wahl der richtigen Sequenz dieser neuen Therapieoptionen, insbesondere in Abhängigkeit von den bereits erfolgten Vortherapien im hormonsensitiven (mHSPC) Setting. Mit dem folgenden Artikel möchten wir eine Orientierungshilfe zur Entscheidungsfindung in Bezug auf die geeignete Therapiewahl geben.
Keypoints
-
Die personalisierte Tumortherapie hat die „One size fits all“-Behandlung auch beim mCRPC abgelöst.
-
Spätestens in der Kastrationsresistenz sollte eine Biomarkeranalyse insbesondere auf HRR-Veränderungen erfolgen.
-
Die richtige Therapiesequenz hängt von den bereits erfolgten Vortherapien im hormonsensitiven Setting und der Biomarkeranalyse ab.
Das kastrationsresistente Prostatakarzinom wird definiert durch 3 konsekutive Anstiege des PSA-Wertes im mindestens wöchentlichen Abstand über einen Wert von 2ng/ml und 50% des Nadirs bei supprimiertem Testosteron (<50ng/dl bzw. 0,5ng/ml).
Therapieentscheidung beim kastrationsresistenten Prostatakarzinom
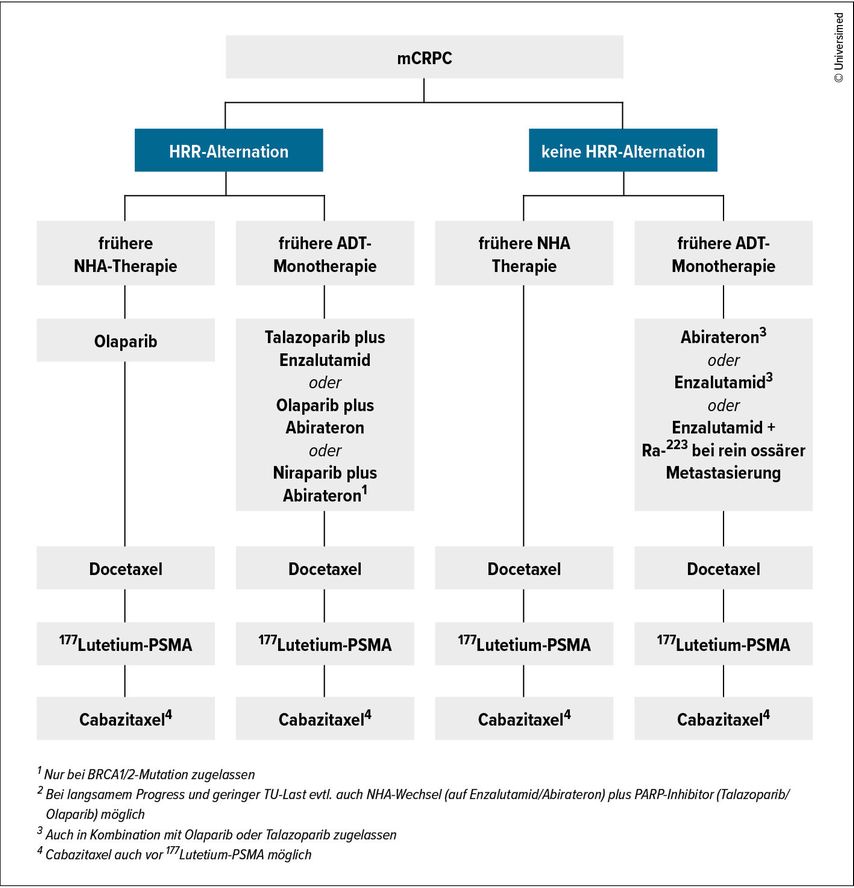
Zur Entscheidungsfindung (Abb. 1) für eine ideale, personalisierte Therapie sollte spätestens in der Kastrationsresistenz eine Biomarkeranalyse am Gewebe oder mittels Liquid Biopsy aus dem Plasma (somatische Mutation) oder aus dem Blut (aus den Leukozyten) bei einem Verdacht auf eine Keimbahnmutation stattgefunden haben. Circa 20% der Patienten mit mCRPC weisen Defekte im DNA-Reparaturmechanismus („homologous recombination repair“, HRR) auf, zu welchem als bekannteste Vertreter die BRCA1- und BRCA2-Gene zählen.
Veränderungen im Bereich von HRR-Genen sind prädiktiv für das Ansprechen auf PARP-Inhibitoren. Dies konnte in drei randomisierten Phase-III-Studien in der Erstlinienbehandlung des mCRPC gezeigt werden.1–3
Von Biomarkern abhängige Therapien
PROPEL-Studie
Die PROPEL-Studie untersuchte die Kombination von Abirateron/Prednison mit dem PARP-Inhibitor Olaparib im Vergleich zu Abirateron/Prednison plus Placebo.1 Patienten wurden unabhängig vom HRR-Status eingeschlossen. In der Studienpopulation ergab sich für den primären Endpunkt im Interventionsarm ein radiografisch progressionsfreies Überleben (rPFS) von 24,8 Monaten im Vergleich zu 16,6 Monaten in der Kontrollgruppe (HR:0,66; 95%CI: 0,54–0,81, p<0,0001).1 Für das Gesamtüberleben ergab sich in der Gesamtpopulation ein statistisch nicht signifikanter Vorteil im Kombinationsarm (42,1 Monate vs. 34,7 Monate; HR: 0,81, 95% CI: 0,67–1,00; p=0,054).1 Der größte und auch statistisch signifikante Benefit im Gesamtüberleben zeigte sich in der Gruppe der Patienten mit einer Mutation an den BRCA1/2-Genen (HR: 0,29; 95% CI: 0,14–0,56).1
TALAPRO-2-Studie
Die Phase-III-Studie TALAPRO-2 untersuchte den PARP-Inhibitor Talazoparib in Kombination mit Enzalutamid im Vergleich zu Placebo plus Enzalutamid.2 Die Studie schloss zunächst Patienten unabhängig vom HRR-Status ein (Kohorte 1), gefolgt von einer zweiten Kohorte ausschließlich für Patienten mit HRR-Alteration. Für den primären Endpunkt ergab sich in der Kohorte 1 ein signifikant verbessertes rPFS im Kombinationsarm als im Kontrollarm (medianes rPFS 33,1 vs. 19,5 Monate; HR: 0,67; 95% CI: 0,55–0,81; p<0,0001). Dieser Benefit ergab sich sowohl für Patienten mit HRR Alteration (HR: 0,46) als auch für Patienten ohne HRR Alteration (HR:0,70).2 Auch das Gesamtüberleben (OS) betreffend zeigte ein Update am ASCO GU 2025 eine signifikante Verbesserung durch eine Behandlung mit Enzalutamid in Kombination mit Talazoparib (medianes OS 45,8 Monate vs. 37 Monate; HR: 0,8; 95% CI: 0,66–0,96; p=0,016).
Da sich in den beiden oben genannten Studien auch in den Subgruppen ohne HRR-Veränderung ein verlängertes rPFS zeigte, erfolgte in Europa die Zulassung der PARP-Inhibitoren in Kombination mit Abirateron/Prednison bzw. Enzalutamid unabhängig vom HRR-Status. Der synergistische Effekt könnte daraus resultieren, dass die Androgenrezeptor-Signalweg-Inhibitoren die Transkription mancher HRR-Gene blockieren und den Tumor dadurch für eine Behandlung mit PARP-Inhibitoren empfänglich machen.
MAGNITUDE-Studie
Die Phase-III-Studie MAGNITUDE untersuchte den PARP-Inhibitor Niraparib in Kombination mit Abirateron/Prednison im Vergleich zu Abirateron/Prednison plus Placebo.3 Die Studie teilte Patienten anhand ihres HRR-Profils in eine HRR-negative und eine HRR-positive Kohorte auf. In der HRR-positiven Kohorte zeigte sich eine Verlängerung des rPFS im Kombinationsarm mit dem PARP-Inhibitor Niraparib (HR: 0,76; 95% CI: 0,6–0,97; p =0,028).3 Der größte Benefit ergab sich auch in dieser Studie für Patienten mit BRCA1/2-Mutation. Hier wurde im Kombinationsarm ein rPFS von 19,5 Monaten im Vergleich zu 10,9 Monaten im Kontrollarm erreicht (HR: 0,55, 95% CI: 0,39–0,78; p=0,0007).3 Nach Adjustierung für eine ungleiche Verteilung in den Behandlungsarmen (Allgemeinzustand der Patienten, Organmetastasen) zeigte sich auch eine Verlängerung im Gesamtüberleben für BRCA1/2-Träger, welche mit der Kombination behandelt wurden (HR: 0,66, 95% CI: 0,46–0,95; p=0,02). In der HRR-negativen Population konnte kein Benefit durch die zusätzliche Behandlung mit dem PARP-Inhibitor erzielt werden.3 Auf Basis dieser Daten erhielt Niraparib in Kombination mit Abirateron/Prednison in Europa die Zulassung zur Erstlinienbehandlung für Patienten mit mCRPC und BRCA1/2-Mutation.
PROFOUND-Studie
Sollte der Patient bereits vor Kenntnis des Biomarkerstatus eine Behandlung mit einem der NHA (Abirateron, Enzalutamid, Apalutamid, Darolutamid) erhalten haben, dann kann bei vorliegender BRAC1/2-Mutation auch eine Monotherapie mit dem PARP-Inhibitor Olaparib erfolgen. Dies wurde in der randomisierten Phase-III-Studie PROFOUND untersucht.4 Hier erhielten Patienten entweder Olaparib oder einen NHA-Wechsel auf Abirateron/Enzalutamid. Das rPFS war signifikant länger im Behandlungsarm mit Olaparib (7,4 vs. 3,6 Monate; HR: 0,34; 95% CI: 0,25– 0,47, p<0,001).4 Auch das Gesamtüberleben zeigte sich signifikant verlängert durch eine Behandlung mit dem PARP-Inhibitor (18,5 vs. 15,1 Monate; HR: 0,64, 95% CI: 0,43–0,97, p=0,02).4
Biomarker-unabhängige Therapien
COU-302- und PREVAIL-Studie
Bei Patienten ohne HRR-Alteration sind für die Therapiewahl in der kastrationsresistenten Situation die Anzahl und Art der Vorbehandlungen entscheidend, welche die Patienten in der hormonsensitiven Situation erhalten haben. Für Patienten, welche zur Behandlung des HSPC eine alleinige Androgendeprivationstherapie (ADT) erhalten haben, kann bei gering symptomatischer Erkrankung eine weitere endokrine Therapie mit ADT plus Abirateron oder Enzalutamid erfolgen. Diese wurde in zwei randomisierten Phase-III-Studien untersucht (COU-302 und PREVAIL).5,6
PEACE-3-Studie
Seit der ESMO-Konferenz 2024 besteht für Patienten mit alleiniger Knochenmetastasierung auch die Möglichkeit, Enzalutamid in Kombination mit dem Alphastrahler Radium-223 (6 Zyklen alle 4 Wochen) zu erhalten. In der randomisierten Phase-III-Studie PEACE 3 wurde gezeigt, dass durch die Kombination aus Enzalutamid plus Ra223 im Vergleich zu Enzalutamid alleine sowohl das rPFS (19,4 Monate vs. 16,4 Monate; HR: 0,69; 95% CI: 0,54–0,87, p=0,0009) als auch das Gesamtüberleben (42,3 Monate vs. 35 Monate; HR: 0,69; 95% CI: 0,52–0,90; p=0,0031) signifikant verlängert wurden. Voraussetzung ist die Behandlung mit einer knochenprotektiven Substanz (z.B. Denosumab) zur Frakturprophylaxe. Allerdings erhält heute die Mehrheit der Patienten bereits in der metastasierten, hormonsensitiven Situation eine endokrine Kombinationstherapie, weshalb die Behandlungsmöglichkeit analog der PEACE-3-Studie in Österreich sicher eine untergeordnete Rolle spielt.
VISION-Studie
Nach Progress auf eine endokrine Kombinationstherapie für das HSPC stellt die Behandlung mit Docetaxel die Standard-Erstlinientherapie im kastrationsresistenten Setting dar, auch wenn die Daten der randomisierten Phase-III-Studie TAX-327 auf einer Ära vor den NHAs beruhen.7 Nach Behandlung mit einem NHA und Docetaxel sollte eine Therapie mit dem Radioliganden 177Lutetium-PSMA-617 zum Einsatz kommen. In der randomisierten Phase-III-Studie VISION erhielten Patienten in dieser Situation entweder vier bis sechs Zyklen 177Lutetium-PSMA-617 plus Standardbehandlung oder eine alleinige Standardbehandlung, welche hauptsächlich einer Therapie mit Abirateron oder Enzalutamid entsprach (Chemotherapie, Immuntherapie und Radium-223 waren in der Studie nicht erlaubt).8 Voraussetzung waren das Vorhandensein von PSMA-positiven Läsionen und das Fehlen von PSMA-negativen Läsionen, wobei die PSMA-Positivität definiert war als eine im Ausgangsstaging stärkere Aufnahme von 68Ga-PSMA-11 in Metastasen als im Leberparenchym.8 Sowohl für das rPFS (8,7 vs. 3,4 Monate; HR: 0,4; 99,2% CI: 0,29–0,57; p<0,001) als auch das Gesamtüberleben (15,3 vs. 11,3 Monate; HR: 0,62; 95% CI: 0,52–0,74; p<0,001) ergab sich ein signifikanter Vorteil durch die Behandlung mit der Radioligandentherapie.8
CARD-Studie
Sollte eine 177Lutetium-PSMA-617-Therapie nicht oder nicht unmittelbar verfügbar sein, kann im Progress nach Docetaxel für das mCRPC eine Behandlung mit Cabazitaxel angeboten werden.
Dies wurde in der randomisierten Phase-III-Studie CARD untersucht.9 Hier erhielten Patienten mit mCRPC nach Vorbehandlung mit Abirateron oder Enzalutamid und Docetaxel entweder eine Chemotherapie mit Cabazitaxel oder den jeweils anderen Androgen-Signalweg-Inhibitor (Abirateron oder Enzalutamid). Es ergab sich ein signifikanter Vorteil für den Cabazitaxel-Therapiearm, sowohl das rPFS (8,0 vs 3,7 Monate; HR: 0,54; 95% CI: 0,40–0,73, p <0,001) als auch das Gesamtüberleben (13,6 vs 11,0 Monate; HR: 0,64; 95% CI: 0,46–0,89, p=0,008) betreffend.9
Eine besondere Herausforderung sind Patienten, die bereits für das HSPC eine Dreifachkombination aus ADT und Docetaxel und Abirateron oder Darolutamid erhalten haben.10,11 Für diese Situation gibt es keine gute Evidenz aus prospektiven Studien. Mögliche Behandlungsoptionen sind aber auch hier die Radioligandentherapie oder eine Chemotherapie mit Cabazitaxel.
Ausblick 2025
PSMAfore-Studie
Erwartet wird ein Vorrücken der Radioligandentherapie in die Erstlinienbehandlung des mCRPC. Dies wurde in der randomisierten Phase-III-Studie PSMAfore untersucht.12 Taxan-naive Patienten, die einen Progress unter ADT- und NHA-Therapie zeigten, wurden randomisiert in eine Behandlung mit 6 Zyklen 177Lutetium-PSMA-617 oder mit einem alternativen NHA (Abirateron oder Enzalutamid). In Bezug auf den primären Endpunkt der Studie ergab sich durch die Radioligandentherapie ein signifikant verlängertes rPFS (11,6 vs 5,6 Monate; HR: 0,49; 95% CI: 0,39–0,61, p<0,001).12 Das Gesamtüberleben zeigte bisher keinen signifikanten Unterschied und ist bei einem Cross-over von 78% auch nicht zu erwarten.12
SPLASH-Studie
In der randomisierten Phase-III-Studie SPLASH wurde ein neues PSMA-Radioligandenmolekül getestet, das 177Lutetium-PNT2002. Es unterscheidet sich vom bekannten 177Lutetium-PSMA-617 lediglich durch ein anderes Verbindungselement (Chelator) zwischen Tracer und PSMA-Bindungseinheit. Auch in dieser Studie zeigte sich das rPFS durch die Radioligandentherapie signifikant verlängert im Vergleich zum alternativen NHA (9,5 Monate vs. 6 Monate; HR: 0,71; 95% CI: 0,55–0,92; p=0,0088). Noch nicht vollständig geklärt sind die optimale Anzahl der Zyklen, die Dosierung und das Dosierungsintervall der Radioligandentherapie.
„Bispecific T-cell engagers“
Eine spannende neue Therapieoption in der soliden Onkologie stellen die „T-cell engagers“ dar, sogenannte BITEs („bispecific T cell engagers“), welche bereits erfolgreich in der Behandlung des kleinzelligen Lungenkarzinoms eingesetzt werden. Welche Rolle sie für das mCRPC spielen, ist noch unklar. BITEs sind rekombinant hergestellte Moleküle, die durch Verknüpfung der variablen Domäne von zwei verschiedenen Antikörpern entstehen. Eine Seite des BITE bindet an ein tumorspezifisches Antigen, während die andere Seite an die CD3-Untereinheit des T-Zell-Rezeptors bindet und dadurch zur T-Zell-Rekrutierung in den Tumor führt. Ein mögliches Antigen beim mCRPC ist STEAP-1, da hier eine Expression von 77–83% auch an Metastasen berichtet wurde. Xaluritamig zeigte in einer Phase-I-Studie bereits beeindruckende PSA-Abfälle um 50% bei 49% der Patienten.13 Xaluritamig wird derzeit in einer Phase-III-Studie im Vergleich zu Cabazitaxel bei Patienten mit mCRPC getestet. Auch PSMA-zielgerichtete BITEs sind in Erprobung.
Literatur:
1 Saad F et al.: Olaparib plus abiraterone versus placebo plus abiraterone in metastatic castration-resistant prostate cancer (PROpel): final prespecified overall survival results of a randomised, double-blind, phase 3 trial. Lancet Oncol 2023; 24(10): 1094-108 2 Agarwal N et al.: Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet 2023; 402(10398): 291-303 3 Chi KN et al.: Niraparib plus abiraterone acetate with prednisone in patients with metastatic castration-resistant prostate cancer and homologous recombination repair gene alterations: second interim analysis of the randomized phase III MAGNITUDE trial. Ann Oncol 2023; 34(9): 772-82 4 de Bono J et al.: Olaparib for metastatic castration-resistant prostate cancer. NEngl J Med 2020; 382(22): 2091-102 5 Ryan CJ et al.: Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013; 368(2): 138-48 6Beer TM et al.: Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014; 371(5): 424-33 7Tannock IF et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351(15): 1502-12 8 Sartor O et al.: Lutetium-177-PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021; 385(12): 1091-103 9de Wit R et al.: Cabazitaxel versus abiraterone or enzalutamide in metastatic prostate cancer. N Engl J Med 2019; 381(26): 2506-18 10 Smith MR et al.: Darolutamide and survival in metastatic, hormone-sensitive prostate cancer. N Engl J Med 2022; 386(12): 1132-42 11 Fizazi K et al.: Abiraterone plus prednisone added to androgen deprivation therapy and docetaxel in de novo metastatic castration-sensitive prostate cancer (PEACE-1): a multicentre, open-label, randomised, phase 3 study with a 2 x 2 factorial design. Lancet 2022; 399(10336): 1695-707 12Morris MJ et al.: (177)Lu-PSMA-617 versus a change of androgen receptor pathway inhibitor therapy for taxane-naive patients with progressive metastatic castration-resistant prostate cancer (PSMAfore): a phase 3, randomised, controlled trial. Lancet 2024; 404(10459): 1227-39 13 Kelly WK et al.: Xaluritamig, a STEAP1 x CD3 XmAb 2+1 immune therapy for metastatic castration-resistant prostate cancer: results from dose exploration in a first-in-human study. Cancer Discov 2024; 14(1): 76-89
Das könnte Sie auch interessieren:
AI, EBRT und Co – Zukunft des Stagings beim muskelinvasiven Blasenkarzinom
Im Rahmen des Michael J. Marberger Meetings wurde Zukunftsweisendes zum Einsatz von Artificial Intelligence (AI) beim Blasenkarzinom präsentiert. Es tut sich aber auch einiges abseits ...
Organisiertes Prostatakrebs-Screening inÖsterreich
Das Prostatakarzinom ist die häufigste Krebserkrankung bei Männern in Österreich und eine der Hauptursachen für krebsbedingte Todesfälle weltweit. Die europäischen Leitlinien empfehlen ...
Update zum Nierenzellkarzinom vom ASCO GU 2025
Der diesjährige ASCO GU wurde von 14. bis 16.2.2025 in San Francisco abgehalten. Die Veranstaltung hat sich im Laufe vieler Jahre als eine der wichtigsten uroonkologischen Plattformen ...