Neues vom ASCO GU zum Prostatakarzinom
Unsere Gesprächspartnerin:
Dr. Nastasiia Artamonova
Universitätsklinik für Urologie Innsbruck
E-Mail: nastasiia.artamonova@tirol-kliniken.at
Das Interview führte Christian Fexa
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Rahmen des ASCO GU 2025 in San Francisco wurden eine Vielfalt von neuen praxisrelevanten Studien zum Prostatakarzinom präsentiert. Mit Spannung wurde unter andem auch auf die finalen Resultate der TALAPRO-2-Studie gewartet, mit der unser Interview mit Dr. Nastasiia Artamonova, die an der Universitätsklinik für Urologie in Innsbruck arbeitet und die den ASCO GU besucht hat, auch beginnt.
Frau Dr. Artamonova, was waren für Sie die interessantesten Studien, die im Rahmen des ASCO GU 2025 präsentiert wurden?
N. Artamonova: Bei einer Diskussion über die Highlights des ASCO GU 2025 zum Prostatakarzinom kommt man an der TALAPRO-2-Studie nicht vorbei. Interessant waren dieses Jahr aber auch Studien zur metastasengerichteten Therapie. Das ist ein Thema, das uns im klinischen Alltag und im Rahmen von multidisziplinären Tumorboards beschäftigt, zu denen es bis jetzt aber wenige Daten gab.
Interessant. Beginnen wir also mit der TALAPRO-2-Studie – welche Resultate wurden gezeigt?
N. Artamonova: Die TALAPRO-2-Studie ist eine Phase-III-Studie, die die Wirksamkeit von Talazoparib in Kombination mit Enzalutamid als Erstlinientherapie bei Patienten mit metastasiertem kastrationsresistentem Prostatakarzinom (mCRPC) untersucht hat. In der Studie wurden Patienten randomisiert, die dann entweder die Kombination Talazoparib und Enzalutamid erhielten oder Placebo mit Enzalutamid. Am ASCO GU wurden nun endgültige Gesamtüberlebensdaten präsentiert. Wichtig zu wissen ist, dass es zwei Kohorten gab, eine unselektierte Kohorte mit 805 Patienten und eine zweite Kohorte mit HRR-defizienten Patienten. Die Ergebnisse für die unselektierte Kohorte haben eine signifikante Verlängerung des radiologischen progressionsfreien und des Gesamtüberlebens für die Kombinationstherapie gezeigt. Das mediane „overall survival“ (OS) betrug 45,8 Monate für die Kombinationstherapie im Vergleich zu 37,0 Monaten für Placebo + Enzalutamid, was einen Überlebensvorteil von etwa 9 Monaten darstellt.
In der zweiten Kohorte, die die HRR-defizienten Patienten untersucht hatte, wurden 399 Patienten randomisiert. Auch in dieser Kohorte zeigte sich für die Kombinationstherapie eine signifikante Verlängerung von radiologischem PFS und Gesamtüberleben. Die besten Ergebnisse wurden dabei für Patienten mit BRCA-Mutationen gezeigt im Vergleich mit anderen HRR-defizienten Patienten. Die Kombinationstherapie hat aber leider auch eine höhere Nebenwirkungsrate gezeigt, besonders häufig waren dabei Neutropenie und Thrombozytopenie. Etwa 50% der Teilnehmer unter der Kombinationstherapie entwickelten eine Thrombozytopenie, wobei bei 49% der Patienten diese als Grad 3 oder 4 eingestuft wurde. Damit trat diese Nebenwirkung in der Kombinationstherapie deutlich häufiger auf als in der Vergleichsgruppe mit Placebo und Enzalutamid. 22% der Patienten der Kombinationstherapiegruppe haben die Therapie wegen schwerwiegender Nebenwirkungen beendet.
Welche interessanten Ergebnisse gab es noch?
N. Artamonova: Eine weitere Studie zu PARP-Inhibitoren, TRITON-3, untersuchte die Wirksamkeit von Rucaparib im Vergleich zu Docetaxel oder ARPI bei chemotherapie-naiven Patienten mit mCRPC und BRCA1/2- sowie ATM-Mutationen.
Was waren die Resultate der TRITON-3-Studie?
N. Artamonova: Es hat sich eine Verlängerung des radiografischen progressionsfreien Überlebens (rPFS) gezeigt, aber keine Verlängerung des OS. In der Studie haben Patienten mit BRCA-Mutationen viel besser angesprochen als Patienten mit ATM-Mutationen. Unter Rucaparib trat aber auch eine höhere Inzidenz von Anämie und Thrombozytopenie im Vergleich zu anderen Therapien auf. Zu beachten ist die höhere Cross-over-Rate, da Patienten aus der Kontrollgruppe nach radiologischer Progression in die Rucaparib-Gruppe gewechselt sind. Daher ist auch die Interpretation der OS-Daten schwierig.
Wenn wir weiterhin über HRR-Mutationen im Prostatakarzinom sprechen, ist es wichtig, die EvoPAR-Studie zu erwähnen, die sich derzeit in der Rekrutierungsphase befindet. Es handelt sich um eine Phase-III-Studie, die den selektiven PARP-1-Inhibitor Saruparib in Kombination mit einem ARPI beim hormonsensitiven Prostatakarzinom untersucht. Die Studie, in die etwa 1800 Teilnehmer randomisiert werden, umfasst zwei Kohorten: Patienten mit HRR-Mutationen und solche ohne. Da Saruparib ein selektiver PARP-1-Inhibitor ist, erwartet man weniger Nebenwirkungen wie Thrombozytopenie und Neutropenie. Der primäre Endpunkt ist das rPFS. Ziel ist es, herauszufinden, ob eine zusätzliche Gabe von PARP-Inhibitoren zur neuen hormonellen Therapie die Behandlungsergebnisse bei hormonsensitiven Patienten verbessern kann und sich so eine neue Behandlungsstrategie bietet, in der PARP-Inhibitoren schon in einem früheren Erkrankungsstadium eingesetzt werden können.
Sie hatten eingangs Ergebnisse zu metastasengerichteten Therapien erwähnt …
N. Artamonova: Hier ist die Studie WOLVERINE, eine Metaanalyse zur metastasengerichteten Therapie (MDT) bei oligometastasierten Prostatakarzinompatienten, zu nennen. In dieser Metaanalyse wurden individuelle Patientendaten aus mehreren randomisierten Studien zur MDT bei oligometastasierten Prostatakarzinomen kombiniert. Inkludiert waren die Studien STOMP, ORIOLE, ARTO, SABR-COMET und EXTEND. Die Metaanalyse hat bessere Ergebnisse im rPFS sowie in der Freiheit von Kastrationsresistenz im Vergleich zur Standardtherapie allein gezeigt. Das mediane PFS wurde im Vergleich zu 14,9 Monaten unter Standardtherapie allein auf 32 Monate verlängert, wenn eine MDT mit der Standardtherapie kombiniert wurde. Die Schwierigkeit bei der Interpretation der Daten dieser Studie liegt darin, dass in den zugrundeliegenden Studien die Definition des oligometastasierten Prostatakarzinoms variierte. So waren sowohl die Anzahl der Metastasen als auch die verwendete Bildgebung in den Studien unterschiedlich, da manche Studien noch aus der Zeit vor der PSMA-PET-CT-Ära stammen. Die Metaanalyse basiert zudem auch auf den genannten kleineren Phase-II-Studien, weswegen ein größerer und genauer randomisierter Vergleich besser wäre als die individuelle Patientendatenanalyse.
Welche Resultate gab es noch zur MDT?
N. Artamonova: Interessant bezüglich MDT war auch die gepoolte Analyse von SOLAR und SATURN. Dabei wurde die MDT bei de novo und bei rezidivierendem oligometastasiertem Prostatakarzinom verglichen. Auch hier ist es die Definition der Oligometastasierung, die die Interpretation schwierig macht, weil sie ebenfalls eine unterschiedliche Anzahl von Metastasen enthielt.
Die Patienten der SOLAR-Studie erhielten entweder eine radikale Prostatektomie mit Lymphknotendissektion, gefolgt von einer postoperativen Strahlentherapie bei Hochrisikomerkmalen, oder eine primäre Strahlentherapie. Im Gegensatz dazu wurden in die SATURN-Studie Patienten mit rezidivierendem oligometastasiertem Prostatakarzinom nach radikaler Prostatektomie eingeschlossen, unabhängig davon, ob sie zuvor eine postoperative Strahlentherapie erhalten hatten. Beide Studien umfassten zusätzlich eine sechsmonatige Kombinationstherapie aus Androgendeprivationstherapie (ADT), Abitareton mit Prednisolon sowie Apalutamid sowie eine stereotaktische Bestrahlung der Metastasen.
Die Analyse umfasste lediglich 24 Patienten aus der SOLAR-Studie und 26 Patienten aus der SATURN-Studie, was eine äußerst kleine Kohorte darstellt. Zudem war die Nachbeobachtungszeit mit 32 Monaten relativ kurz. Die Analyse ergab, dass die Ansprechrate bei de novo-Patienten mit 83% deutlich höher war als bei Patienten mit rezidivierenden Oligometastasierung, bei denen sie 50% betrug. Zudem zeigte sich ein längeres PFS bei de novo-Patienten im Vergleich zu Patienten mit rezidivierender Oligometastasierung.
Dies deutet darauf hin, dass der Einsatz der MDT im frühen Krankheitsstadium möglicherweise effektiver ist als bei einem Rezidiv.
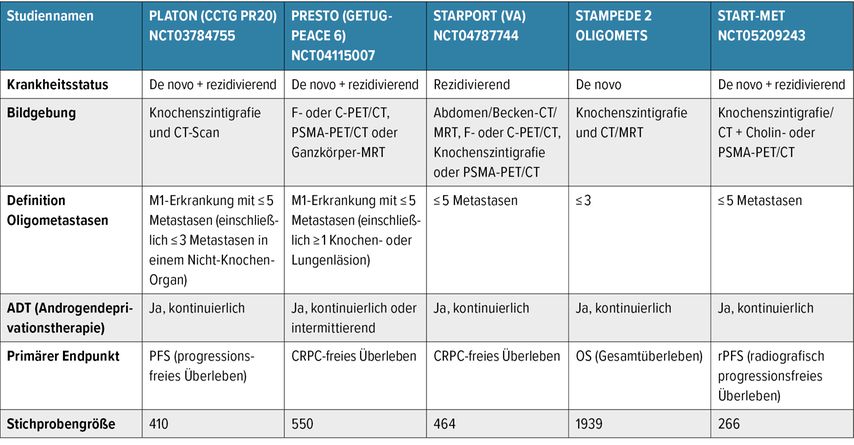
Laufende Studien zu MDT werden in Zukunft neue Erkenntnisse liefern, sodass diese Themengebiet weiterhin von Interesse bleibt (Tab. 1).
Tab. 1: Zukünftige Richtungen – laufende Studien (präsentiert am ASCO GU von Chad Tang mit freundlicher Genehmigung von Pierre Blanchard)
Gab es auch Spannendes, das Sie nicht anfangs erwähnt haben?
N. Artamonova: Ja, Interessantes gab es auch zur Radioligandentherapie. Eine der präsentierten Studien war die ENZA-p-Studie. Diese ist eine randomisierte Phase-II-Studie, in die 162 mCRPC-Patienten eingeschlossen und das Gesamtüberleben und die Lebensqualität unter der Kombination aus 177Lutetium-PSMA und Enzalutamid versus Enzalutamid alleine verglichen wurde.
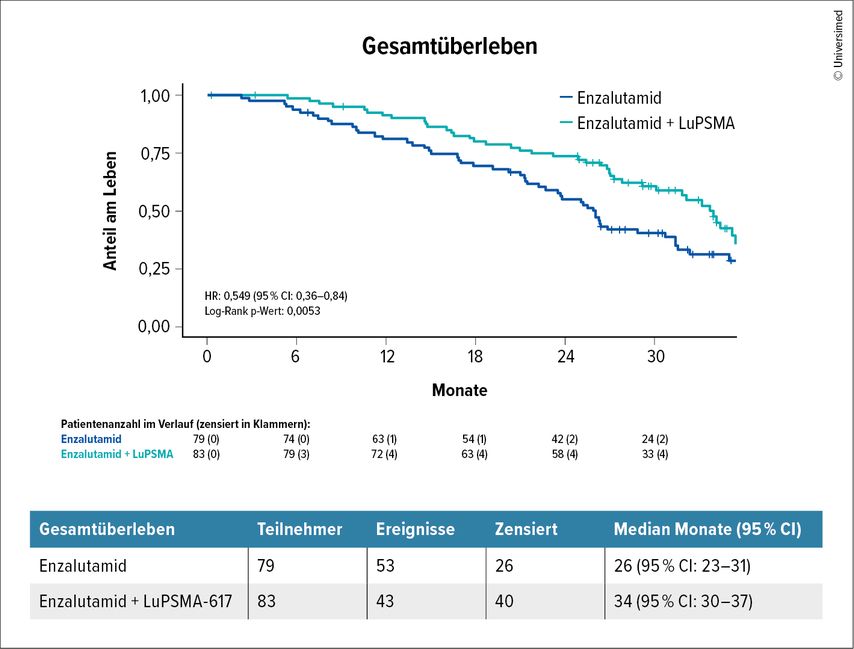
Die Rationale war, dass eine Androgenrezeptorblockade die PSMA-Expression erhöhen soll, was zu einem besseren Ansprechen auf die Lutetiumtherapie führen sollte. Die Ergebnisse bestätigten diese Annahme und zeigten, dass die Kombinationstherapie das Gesamtüberleben signifikant verlängerte: 34 Monate vs. 26 Monate unter alleiniger Enzalutamid-Therapie (Abb.1). Es zeigte sich eine Verbesserung der Lebensqualität, insbesondere in Bezug auf Schmerzen und Müdigkeit, was besonders relevant ist, da Müdigkeit eine bekannte Nebenwirkung von Enzalutamid ist. Zusammenfassend zeigt die Kombinationstherapie eine Verlängerung des Gesamtüberlebens um etwa acht Monate, ohne eine Zunahme der Nebenwirkungen, abgesehen von der für die Lutetiumtherapie typischen Mundtrockenheit. Eine Limitation der Studie besteht darin, dass nur 13% der ENZA-p-Patienten zuvor mit Abirateron behandelt wurden. Da mCRPC-Patienten heutzutage in der Regel bereits eine neue hormonelle Therapie in eine vorherige Therapielinie erhalten, ist die Übertragbarkeit dieser Ergebnisse auf die klinische Praxis eingeschränkt. Zudem erschwert die in ENZA-p verwendete adaptive Dosierung von Lutetium die Interpretation der Ergebnisse.
Abb. 1: ENZA-p-Studie: Die Kombinationstherapie Enzalutamid + ¹⁷⁷LuPSMA-617 verlängerte signifikant das Gesamtüberleben bei Patienten mit kastrationsresistentem Prostatakarzinom mit 34 Monaten versus 26 Monate unter Enzalutamid alleine. 38% (30 von 79) der Patienten mit Enzalutamid-Monotherapie erhielten ¹⁷⁷LuPSMA-617 als nachfolgende Behandlung außerhalb des Studienprotokolls
Derzeit gibt es mehrere Studien, die versuchen, den besten Partner für die Lutetiumtherapie zu finden. So wurde die Kombination von Lutetium mit Cabazitaxel und Olaparib untersucht, aber auch mit Radium und Pembrolizumab, um das Ansprechen auf die Lutetiumtherapie zu verbessern.
Wie sieht es beim Vergleich Prostatektomie versus Strahlentherapie aus? Das ist für viele Patienten ein Thema.
N. Artamonova: Zum Vergleich der Wirksamkeit einer radikalen Prostatektomie mit einer Strahlentherapie wurde eine interessante Studie bei Hochrisikoprostatakarzinompatienten präsentiert. Es handelte sich um eine randomisierte Analyse, die Patientendaten aus zwei Phase-III-Studien (NRG/RTOG und CALGB) zusammenführte. Die erste Studie untersuchte Strahlentherapie kombiniert mit langfristiger Androgendeprivation, während die zweite Studie Patienten mit RPE und personalisierter postoperativer Therapie betrachtete. Die Analyse mit dem medianen Follow-up von 6,4 Jahren hat 1290 Patienten erfasst, 547 davon erhielten eine Strahlentherapie und 733 eine radikale Prostatektomie. Der primäre Endpunkt war die Inzidenz von Fernmetastasen. Die Analyse zeigte, dass die Inzidenz von Fernmetastasen in der Strahlentherapiegruppe signifikant niedriger war (16% gegenüber 23% nach radikaler Prostatektomie). Es ist jedoch zu beachten, dass die Studienpopulationen Unterschiede aufwiesen: Patienten mit radikaler Prostatektomie waren tendenziell jünger. Zudem war die Nachbeobachtungszeit von 6,4 Jahren relativ kurz, was die Anzahl prostatakrebsspezifischer Mortalitätsereignisse begrenzte. Die Ergebnisse berücksichtigen nicht die aktuellen Behandlungsstandards, bei denen Abirateron plus Prednison in Kombination mit Strahlentherapie bei Hochrisikopatienten etabliert ist, anstelle einer alleinigen Bestrahlung mit ADT.
Wichtig zu erwähnen ist, dass 80% der Patienten die eine radikale Prostatektomie erhalten haben, weitere Therapien benötigten oder ein Rezidiv erlebt hatten, was betont, dass die adjuvante oder „Early salvage“-Therapie für diese Patientengruppe von entscheidender Bedeutung bleibt.
Vielen Dank für das Gespräch!
Das könnte Sie auch interessieren:
PCa-Früherkennung in Deutschland: individualisiert, risikoadaptiert, erfolgreich
Die Früherkennung des Prostatakarzinoms sollte personalisiert und risikoadaptiert gestaltet werden. Durch ein risikoadaptiertes Vorgehen, das PSA-Tests, ergänzende MRT-Bildgebung und ...
Aktuelle Entwicklungen und Erkenntnisse beim Urothelkarzinom
Auf dem diesjährigen Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO-GU-Kongress) wurden bedeutende Fortschritte in der Diagnose und Behandlung des ...
Aktuelles aus der 7. Version der S3-Leitlinie: wesentliche Leitlinienänderungen
Im Mai 2024 wurde die Prostatakarzinom-S3-Leitlinie unter der Federführung der Deutschen Gesellschaft für Urologie e.V. (DGU) im Rahmen des Leitlinienprogramms Onkologie in ihrer 7. ...