Roboterassistierte Nierenteilresektion: die (R)evolution der Nierenchirurgie
Autor:
Dr. Michael Abenhardt
Universitätsklinik für Urologie und Andrologie
Uniklinikum Salzburg
E-Mail: m.abenhardt@salk.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Fachgebiet der Urologie hat sich schon immer zum technologischen Fortschritt bekannt, und der DaVinci-Roboter ist das absolute Prestigesymbol dafür. Er ist nicht mehr aus dem urologischen Alltag wegzudenken.
Keypoints
-
Die roboterassistierte (DaVinci) hat die laparoskopische Nierenteilresektion abgelöst.
-
Zusätzliche intraoperative Diagnostik mittels Ultraschall oder Indocyanidgrün hat sich als neuer Standard etabliert.
-
Die roboterassistierte Nierenteilresektion ist der offenen in wichtigen Parametern (Blutung, Komplikation, KH-Aufenthalt) überlegen.
-
Transperitoneale Zugänge werden deutlich häufiger gewählt, retroperitoneale Zugänge eignen sich für posteriore oder hiläre Tumoren.
-
Mittels „Drop-in“-Ultraschallsonde kann das Operationsfeld abgeglichen und Tumorgrenzen können festgelegt werden.
-
Ein 3D-Modell stellt die arterielle Versorgung des Tumors plastisch dar und kann die interoperative Entscheidungsfindung unterstützen.
-
Fluoreszenztechnologie (ICG) lässt durchblutete von ischämischen Arealen abgrenzen.
Vor allem bei der Nierenteilresektion zeigt der DaVinci-Roboter seine Überlegenheit gegenüber der rein laparoskopischen oder offenen Operationstechnik und überzeugt durch das geringe Gewebstrauma, durch seine vielen Freiheitsgrade und die Tremorreduktion. Zusätzlich wurden in den letzten Jahren der intraoperative Einsatz von Ultraschalldiagnostik oder die Visualisierung mittels Indocyaningrün (ICG) implementiert.
Aufgrund der Konsole wird bei der roboterassistierten Chirurgie das OP-Gebiet „digitalisiert“. Dies hat (aktuell noch) den Nachteil des fehlenden haptischen Feedbacks, aber ermöglicht neben der enormen Vergrößerung und der hohen Auflösung den Einsatz von revolutionären Technologien. So könnten in naher Zukunft 3D-Modelle des OP-Gebiets im Sinne einer „Augmented Reality“ gematcht werden, um möglicherweise ein selektives Abklemmen und die Tumorlokalisation zu erleichtern oder um Resektionsgrenzen und die OP-Dauer zu verbessern.
Der aktuelle Stand der Technik
Offen vs. laparoskopisch vs. robotisch
Gemäß Leitlinie der EAU (European Association of Urology) sollte bei allen T1-Nierentumoren und bei ausgewählten T2-Nierentumoren (Operabilität, Einzelniere, chronische Nierenerkrankung) eine Nierenteilresektion durchgeführt werden.1 Laut Bradshaw et al. sollte sogar bei allen cT2a-Nierentumoren die Nierenteilresektion in erfahrenen Händen als Erstlinientherapie in Betracht gezogen werden.2
Mehrere retrospektive Studien demonstrieren die Vorteile der Nierenerhaltung („nephron-sparing surgery“) mit reduzierter Komorbidität und deshalb erhöhter Überlebensrate. Die Metaanalyse von Cacciamani et al. hat gezeigt, dass die minimalinvasive (roboterassistierte) Nierenteilresektion gegenüber offener Nierenteilresektion bei entscheidenden perioperativen Parametern, wie z.B. Blutverlust, Komplikationen und Dauer des Krankenhausaufenthalts, überlegen ist.3 Diese Überlegenheit lässt sich auch bei komplexen Nierentumorkonstellationen reproduzieren.4 Die Wahl des minimalinvasiven Verfahrens richtet sich hierbei nach Expertise und Fähigkeit des Chirurgen und sollte das perioperative Risiko sowie das onkologische und funktionelle Ergebnis nicht kompromittieren. In den letzten 10 Jahren hat die roboterassistierte DaVinci-Nierenteilresektion die laparoskopische Nierenteilresektion als präferiertes Verfahren abgelöst und bietet neben den o.g. offensichtlichen technischen Vorteilen einen höheren chirurgischen Komfort.5 In der Metaanalyse von Choi et al. zeigte sich die roboterassistierte Nierenteilresektion gegenüber der laparoskopischen Nierenteilresektion als überlegen, da die Konversionsrate auf eine offene oder auf eine radikale Operation signifikant niedriger war und kürzere warme Ischämiezeiten und eine kürzere Krankenhausaufenthaltsdauer vorlagen.6
Transperitonealer vs. retroperitonealen Zugang
Der Zugangsweg bei der roboterassistierten Nierenteilresektion kann transperitoneal oder retroperitoneal erfolgen.
Bei der transperitonealen roboterassistierten Nierenteilresektion wird der Patient bei 60° auf die kontralaterale Seite gelagert. Im Gegensatz dazu wird der Patient bei der retroperitonealen roboterassistierten Nierenteilresektion in strenger 90°-Seitenlagerung gelagert, um einen möglichst großflächigen Zugangsweg zwischen Rippenbogen und Becken zu ermöglichen.
Nach Andocken des OP-Roboters erfolgt beim transperitonealen Zugang zunächst die Mobilisierung des Darms. Auf der linken Seite ist die Mobilisierung der Milz mit Durchtrennung des Lig. lienorenalis, des Lig. lienocolicum und der seitlichen Milzaufhängung entscheidend. Die Exposition der Nierengefäße soll möglichst proximal am Abgang aus der Aorta erfolgen, um den Abschnitt der Nierenarterie vor einer Aufzweigung zu identifizieren und mit einem „vessel loop“ anzuschlingen.7
Der retroperitoneale Zugang erfolgt mittels offener Hassontechnik durch eine ca. 2cm lange Inzision kaudal der Spitze der 12. Rippe. Im Operationsverlauf wird unter Sicht ein 8mm-Trokar am Zusammentreffen der 12. Rippe und des M. erector spinae platziert und ein weiterer an der vorderen Axillarlinie. Die Gerotafaszie wird entlang des M. psoas in Richtung Zwerchfell inzidiert und der Nierenhilus dargestellt.7
Vergleich der operativen Zugangswege
Der transperitoneale Zugangsweg wird deutlich häufiger gewählt, da er mehr Arbeitsplatz und Übersicht bietet und eine bessere Orientierung an den großen Gefäßen und abdominellen Strukturen ermöglicht. Die Nachteile des transperitonealen Zugangs sind die notwendige Mobilisierung des Kolons und das einhergehende Risiko für eine Darmverletzung bzw. Narben- oder Hernienbildung. Zusätzlich ist die Gefahr einer Milz- oder Pankreasverletzung auf der linken Seite sowie einer Leber- oder Gallenblasenverletzung auf der rechten Seite höher. Zudem können Verwachsungen nach extensiver Abdominalchirurgie den transperitonealen Zugang deutlich erschweren. Das Pneumoperitoneum führt häufiger zu postoperativen Schmerzen und erhöht das Risiko für einen postoperativen Ileus bzw. eine postoperativ prolongierte Darmatonie im Vergleich mit einem rein retroperitonealen Vorgehen.8 Um posteriore Nierentumoren über den transperitonealen Zugangsweg operieren zu können, muss die Niere nicht selten komplett aus dem perirenalen Fettgewebe mobilisiert und umgeklappt werden. Dies ist sehr umständlich und nimmt viel Zeit in Anspruch. So wurde in der retrospektiven Studie von Harke et al. der retroperitoneale Zugangsweg häufiger für posteriore Nierentumoren genutzt. Er führte zu einer signifikant kürzeren OP-Zeit (119min vs. 139min; p<0,001) und einer signifikant kürzeren warmen Ischämiezeit (9min vs. 10min; p=0,003), während die Komplikationsraten und das funktionelle und onkologische Ergebnis mit dem transperitonealen Zugangsweg vergleichbar waren. Die Komplexität des Nierentumors war hierbei nicht entscheidend. So waren in beiden Subgruppen ca. 40% komplexe Nierentumoren bei einem medianen PADUA-Score von 9.9 Li et al. sehen ebenfalls den Vorteil des retroperitonealen Zugangs bei posterioren und hilären Tumoren und fordern eine flächendeckende Ausbildung und die differenzierte Anwendung von beiden Zugangswegen.10
Besondere Möglichkeiten der Visualisierung und der „image-guided surgery“10
Das größte Opfer, das mit der roboterassistierten minimalinvasiven Chirurgie gebracht wurde, ist der Verzicht auf das haptische Feedback. Dieser sensorische Verlust erschwert die intraoperative Orientierung durch die Identifizierung von Leitstrukturen und Gefäßen sowie der Tumorlokalisation.
Besondere Möglichkeiten der Visualisierung stehen dem Operateur zur Verfügung, um die fehlende Sensorik auszugleichen. Hierfür hat der Operateur die Möglichkeit, über die Konsole mithilfe der „Tile Pro“-Funktion zusätzlich zum Operationsfeld ein weiteres Bildsignal aufzurufen und gleichzeitig anzeigen zu lassen. Vor allem bei komplexen Nierentumoren spielen die unten genannten Anwendungen eine entscheidende Rolle.11
Anwendung einer Ultraschallsonde
Eine „Drop-in“-Ultraschallsonde wird über den Assistententrokar ins OP-Gebiet eingeführt und durch den Operateur mit einem robotisch gesteuerten Instrument dirigiert. Somit kann der Operateur via „Tile Pro“ das Ultraschallbild mit dem Operationsfeld korrelieren und die Tumorgrenzen definieren. Vor allem bei komplett endophytischen Tumoren und bei multiplen Nierenzysten ist die intraoperative Ultraschalldiagnostik unerlässlich und ermöglicht eine korrekte Dissektion unter Einhaltung der Tumorgrenzen und die Schonung von gesundem Gewebe. So konnten Sun et al. mit ihrer retrospektiven Studie über komplett endophytische Nierentumoren zeigen, dass Patienten mit intraoperativer Ultraschalldiagnostik signifikant weniger Blutverlust, eine kürzere Ischämiezeit, eine höhere Rate an negativen Resektionsrändern und ein besseres perioperatives Outcome hatten als die Vergleichsgruppe ohne intraoperative Ultraschalldiagnostik.12 Die intraoperative Ultraschalldiagnostik erlaubt zudem die korrekte Einschätzung der Größe und Lokalisation eines Tumorthrombus, falls dieser visuell nicht ausreichend beurteilt werden kann. Mittels Duplexsonografie kann die Perfusion des Tumors und somit z.B. die Qualität des selektiven Clampings oder einer globalen Ischämie beurteilt werden. Mittels CEUS-Technik („Contrast-Enhanced Ultrasonography“) können Nieren- und Tumorarchitektur inklusive der Blutgefäße hochauflösend und präzise dargestellt werden. Hierfür wird ein Kontrastmittel aus stabilisierten Mikrobläschen i.v. appliziert. Nach ca. 20 Sekunden kann die intrarenale räumliche Verteilung dieser Mikrobläschen mittels Reflexion durch den kontrastverstärkten Modus neben dem konventionellen B-Modus dargestellt werden. Im Vergleich zur u.g. ICG-Technik bietet die CEUS-Technik die Möglichkeit einer erneuten Anwendung innerhalb weniger Minuten. Die Mikrobläschen des Kontrastmittels SonoVue® sind zudem nicht nephrotoxisch. Das stabilisierte Schwefelhexachloridgas wird über die Lunge abgeatmet und kann so auch bei niereninsuffizienten Patienten angewendet werden.13
Anwendung von Indocyaningrün (ICG)
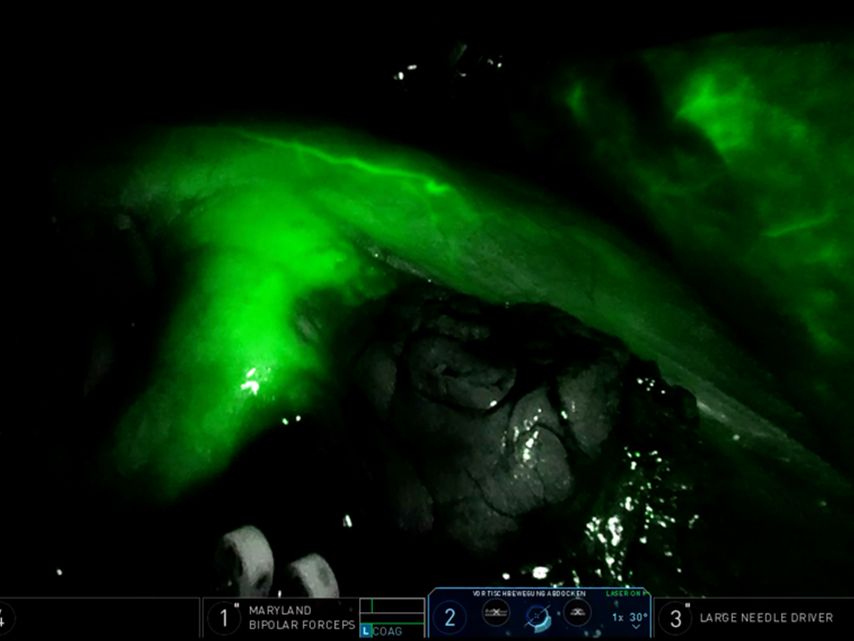
Indocyaningrün wird i.v. appliziert und kann nach ca. 3–5 Minuten durch den Operateur über die Konsole mithilfe der integrierten Fluoreszenztechnologie Firefly™ dargestellt werden. Diese Fluoreszenztechnologie ermöglicht bei selektivem Abklemmen eine exakte, farblich definierte Abgrenzung der Durchblutung vom ischämischen Gewebe (Abb. 1). Nach Umschalten in den Infrarotbereich leuchtet das durchblutete Areal grün, während das nicht durchblutete Gewebe dunkel bleibt. Ein Nachteil im Vergleich zur o.g. CEUS-Technik ist, dass die Untersuchung erst nach 20 Minuten wiederholt werden kann, wenn das primär applizierte ICG abgebaut ist. Yang et al. führen drei Möglichkeiten an, wie ICG intraoperativ hilfreich ist. Durch ICG kann selbst eine komplexe arterielle Gefäßversorgung des Tumors identifiziert und z.B. (super)selektiv geclampt werden, sodass gesundes Nierengewebe bestmöglich geschont wird. Diese Erkenntnis sehen die Autoren auch als Begründung für ihr Studienergebnis, dass die ICG-Gruppe weniger Blutverlust erlitt als die Nicht-ICG-Gruppe und früh postoperativ eine bessere Nierenfunktion aufwies. Laut Autoren ist der zweite große Vorteil, dass der Nierentumor nach ICG-Gabe unter Fluoreszenzdarstellung dunkler erscheint als das gesunde Nierengewebe. Somit kann die Tumorgrenze schneller identifiziert und infolgedessen die Ischämiezeit verkürzt werden, ohne dass die Rate an positiven Schnitträndern (R1-Resektionen) zunimmt. Der Grund für die schlechtere ICG-Aufnahme im Tumorgewebe liegt an der geringeren Expression des Transmembranproteins Bilitranslokase im Vergleich zum gesunden Nierengewebe. Drittens kann mithilfe von ICG die Perfusion des gesunden Gewebes am Ende der OP überprüft werden. Ein möglicher Ischämieschaden, z.B. durch eine zu enge Renorrhafie, kann mittels ICG noch intraoperativ erkannt und direkt behoben werden.14
Abb. 1: Anwendung von Indocyaningrün (ICG): Nach i.v. Gabe von ICG färbt sich das perfundierte Nierenparenchym grün. Der tumortragende Anteil zeigt sich ischämisch schwarz
Die ICG-Proteinkomplexe werden von der Leber durch die Galle ausgeschieden, sodass der Einsatz von ICG bei Leberinsuffizienz kontraindiziert ist. Zudem befinden sich geringe Iodanteile im Marker, sodass eine Iodallergie ebenfalls eine Kontraindikation darstellt.
Zukünftige Technologien & Anwendung von „Augmented Reality“
Bereits im Jahr 2014 wurde an Möglichkeiten geforscht, um digitale Orientierungshilfen über die OP-Konsole einzusetzen.15 Die Nierenteilresektion ist hierbei prädestiniert für diese Art von digitaler Unterstützung. Die hohe individuelle Vielfalt der Hilusgefäße sowie die teilweise komplett endophytische Tumorlokalisation und die Lagebeziehung des Tumors in Bezug auf Gefäße und Kelchsystem stellen hohe Ansprüche an den Chirurgen.
Die flächendeckend verfügbare und präoperativ obligatorische Computertomografiediagnostik erstellt einen 2D-Datensatz, der seit Jahrzehnten für die Nieren-OP-Planung genutzt wird. Mittels 4-Phasen-CT-Urografie-Untersuchung können hochauflösende Bilder <1mm Schichtdicke erzeugt werden, die eine präzise Visualisierung der venösen und arteriellen Gefäßversorgung, der Nierenarchitektur inklusive Kelchsystem sowie der exakten Tumorlokalisation ermöglichen.
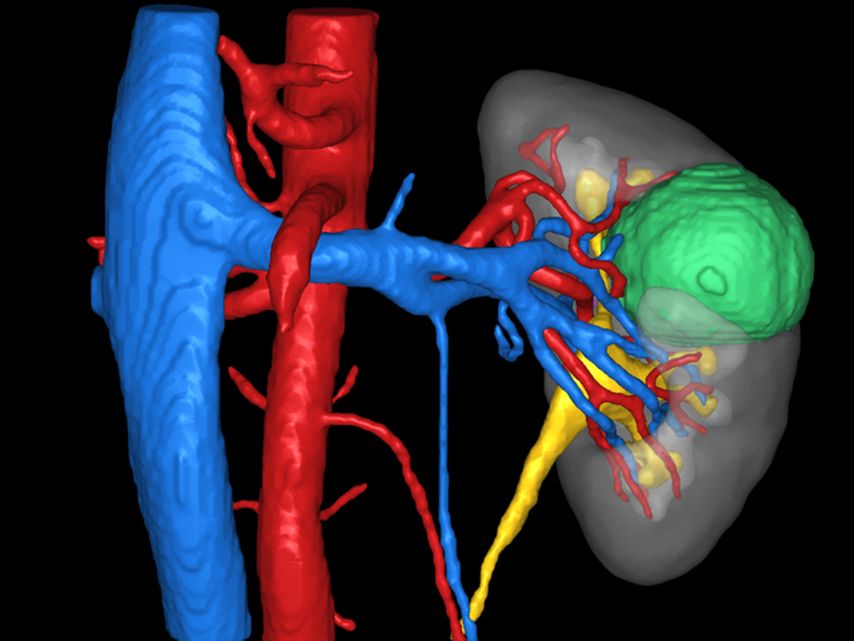
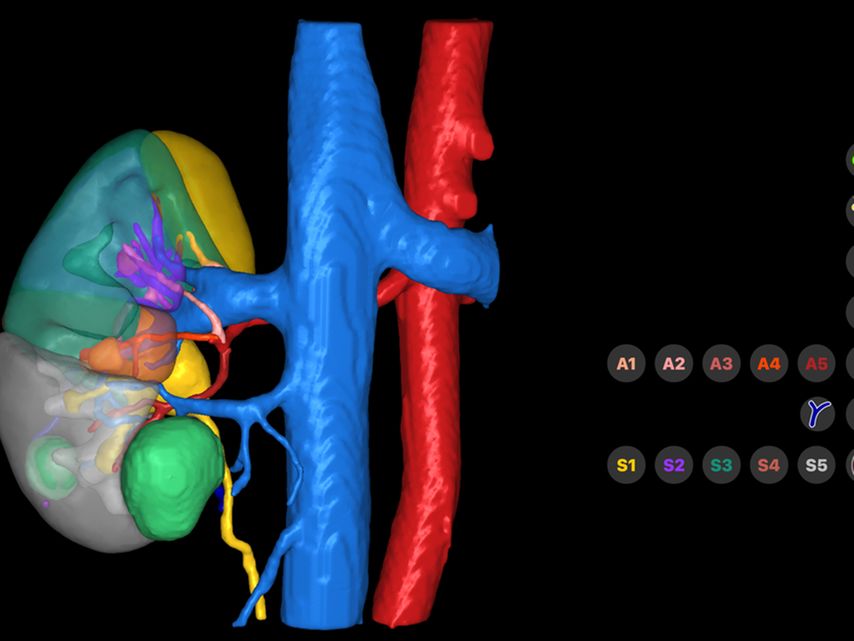
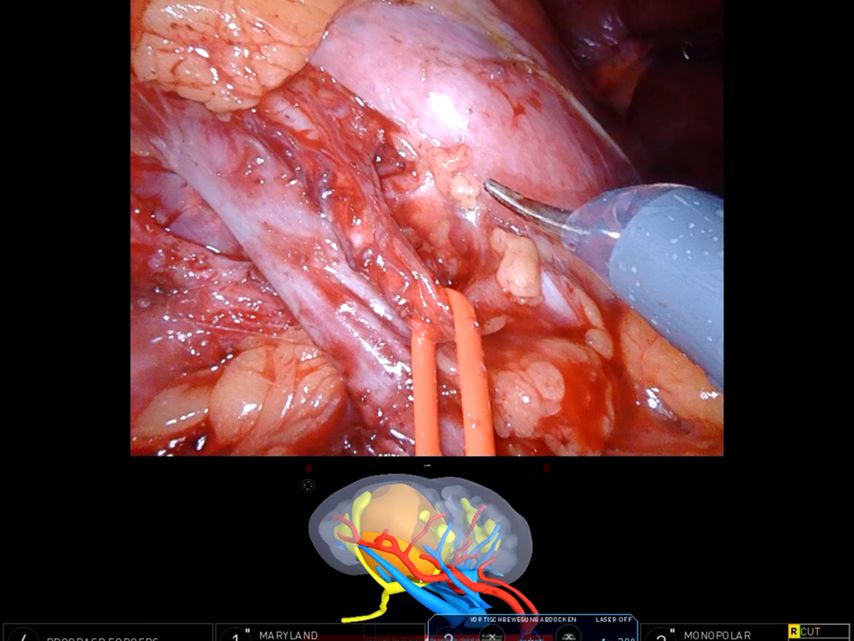
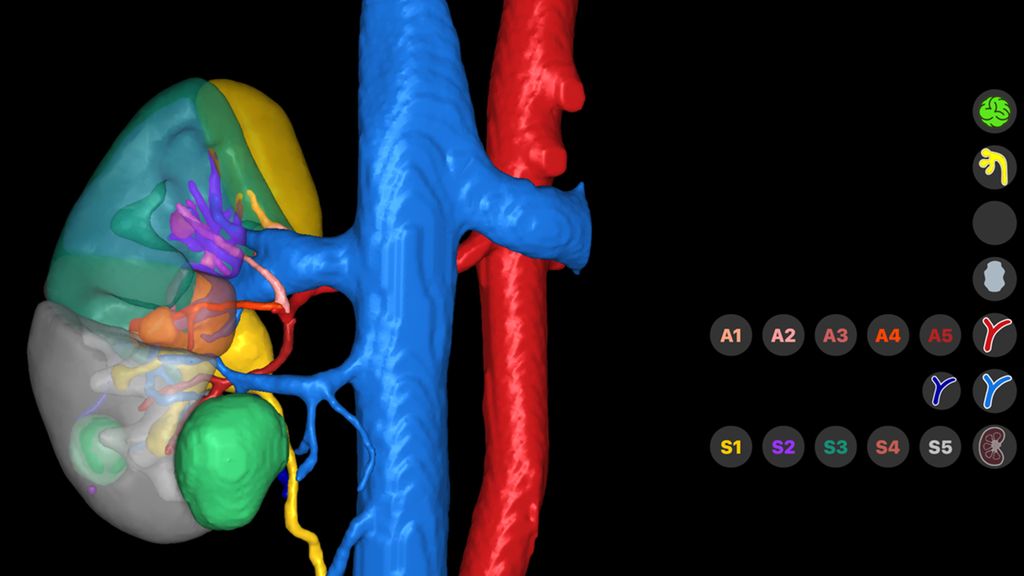
Firmen wie Innersight Labs Ltd. oder Medics3D erstellen aus diesen Datensätzen 3D-Modelle, die Vorteile in der präoperativen Planung und in der operativen Umsetzung bringen. Bei der Erstellung und Implementierung dieser 3D-Modelle werden bereits Zukunftstechnologien, wie künstliche Intelligenz und maschinelles Lernen, eingesetzt.16 So kann z.B. aus einem hochauflösenden CT-Datensatz die wahrscheinliche arterielle Versorgung eines Nierentumors berechnet werden. Die entsprechende grafische Umsetzung im 3D-Modell ermöglicht dem Operateur eine optimierte Entscheidungsfindung in Bezug auf die intraoperative Herangehensweise und z.B. ein selektives Clamping (Abb. 2, 3 und 4).
Abb. 2: 3D-Modell von Innersight Labs Ltd.: Der hauptsächlich endophytische Nierentumor (grün) mit enger Lagebeziehung zum oberen Kelchsystem (gelb) bietet anatomisch die Möglichkeit des selektiven Clampings (s. Pfeil)
Abb. 3: 3D-Modell von Innersight Labs Ltd.: zwei Nierentumoren (grün) mit enger Lagebeziehung zur unteren Kelchgruppe sowie zum Nierenbecken (gelb). Auf der rechten Seite können die segmentale Gefäßversorgung, aber auch das Nierenparenchym und das Kelchsystem (transparent) ein- oder ausgeschaltet werden
Abb. 4: 3D-Modell von Medics3D in der „Tile Pro“-Ansicht: Der intraoperative Vergleich mit einem 3D-Modell erlaubt eine schnelle und sichere Orientierung, auch wenn das „matching“ aktuell noch manuell erfolgt
Porpiglia et al. zeigten, dass die Anwendung von „Augmented Reality“ (AR) im Vergleich zur ultraschallgeführten Operation eine höhere Rate an Tumorenukleationen und eine bessere Blutstillung ermöglichte. Dadurch wurde gesundes Nierengewebe geschont und das Kelchsystem weniger häufig verletzt. Das AR-Patientenkollektiv benötigte weniger Bluttransfusionen, hatte eine kürzere OP-Zeit und benötigte postoperativ im Vergleich zur US-Gruppe keine Embolisation und keine DJ-Versorgung.17 Die größte Herausforderung einer möglichen intraoperativen Anwendung von AR ist das „matching“ oder die Registrierung, d.h., mit dieser Funktion passt sich das 3D-Modell möglichst automatisch und realistisch an das Live-OP-Feld an. Hierbei müssen mehrere Faktoren berücksichtigt werden. Zum einen wird der Patient anders als in der präoperativen CT-Untersuchung seitengelagert. Außerdem verschieben sich die Niere und die Hilusanatomie im Rahmen der Nierenfreilegung, sodass das 3D-Modell entsprechend in jeder räumlichen Achse verzerrt und angepasst werden muss. Neben Software-basierten Lösungen wird über die Durchführung einer intraoperativen CT-Diagnostik und Navigation nachgedacht.18
Zukunft der roboterassistierten Nierenteilresektion
Die roboterassistierte Nierenteilresektion hat sich gegenüber der offenen und der laparoskopischen Nierenteilresektion durchgesetzt und wird auch in Zukunft die dominierende OP-Technik bleiben.19
Die Monopolstellung des DaVinci-Roboters von Intuitive Surgical ist beendet. Interessante und kostengünstigere Konkurrenzmodelle wie das Hugo™RAS System20 oder die Senhance® Robotic Platform21 wurden bereits in kleinen Patientenkollektiven getestet und erhöhen den Innovationsdruck auf den Platzhirsch. Die Machbarkeit der roboterassistierten (transperitonealen sowie retroperitonealen) Nierenteilresektion mit dem DaVinci-Single-Port-System wurde bereits in Amerika und in Asien bewiesen,22 und eine europäische Markteinführung wird nach erfolgreicher CE-Zertifizierung in den kommenden Jahren erwartet.23 Vor allem für den begrenzten retroperitonealen Raum könnte das Single-Port-System eine vielversprechende und revolutionäre Technologie sein. Hierfür wurden bereits neue OP-Techniken publiziert, die nun in größeren Patientenkollektiven evaluiert werden müssen.24
Die Zukunft der roboterassistierten Nierenchirurgie liegt in der Fähigkeit der integrierten Bildgebung und Navigation inklusive automatisierter AR sowie in einem erweiterten sensorischen Funktionsumfang wie z.B. der Fähigkeit eines haptischen Feedbacks.25
Literatur:
1 Ljungberg B et al.: EAU-Guidelines on renal cell carcinoma 2023. Präsentiert am EAU Annual Congress, Milan 2023. ISBN 978-94-92671-19-6 2 Bradshaw AW et al.: Robotic partial nephrectomy vs minimally invasive radical nephrectomy for clinical T2a renal mass: a propensity score-matched comparison from the ROSULA (Robotic Surgery for Large Renal Mass) Collaborative Group. BJU Int 2020; 126(1): 114-23 3 Cacciamani GE et al.: Impact of surgical factors on robotic partial nephrectomy outcomes: comprehensive systematic review and meta-analysis. J Urol 2018; 200: 258-74 4 Garisto J et al.: Robotic versus open partial nephrectomy for highly complex renal masses: comparison of robotic partial nephrectomy. Urol Oncol 2018; 36(10): 471.e1-9 5 Rogers C et al.: Robotic partial nephrectomy: the real benefit. Curr Opin Urol 2011; 21(1): 60-4 6 Choi JE et al.: Comparison of perioperative outcomes between robotic and laparoscopic partial nephrectomy: a systematic review and meta-analysis. Eur Urol 2015; 67(5): 891-901 7 Albers P, Heidenreich A: Standardoperationen in der Urologie. Kapitel 1.3: Roboterassistierte organerhaltende Nierentumorchirurgie. 2. Auflage. Stuttgart, New York, Delhi, Rio: Georg Thieme Verlag KG, 2014. 36-8 8 Martinez O et al.: Feasibility of adopting retroperitoneal robotic partial nephrectomy after extensive transperitoneal experience. World J Urol 2020; 38(5): 1087-97 9 Harke NN et al.: Retroperitoneal versus transperitoneal robotic partial nephrectomy: a multicenter matched-pair analysis. Eur Urol Focus 2020; 7(6): 1363-70 10 Li M et al.: Laparoscopic and robotic-assisted partial nephrectomy: an overview of hot issues. Urol Int 2020; 104(9-10): 669-77 11 Buffi NM et al.: Robot-assisted partial nephrectomy for complex (PADUA Score ≥10) tumors: techniques and results from a multicenter experience at four high-volume centers. Eur Urol 2020; 77(1): 95-100 12 Sun Y et al.: Intraoperative ultrasound: technique and clinical experience in robotic-assisted renal partial nephrectomy for endophytic renal tumors. Int Urol Nephrol 2021; 53(3): 455-63 13 Di Cosmo G et al.: Intraoperative ultrasound in robot-assisted partial nephrectomy: state of the art. Arch Ital Urol Androl 2018; 90(3): 195-8 14 Yang YK et al.: Clinical benefits of indocyanine green fluorescence in robot-assisted partial nephrectomy. Cancers 2022; 14(12): 3032 15 Hughes-Hallett A et al.: Image guidance for all--TilePro display of 3-dimensionally reconstructed images in robotic partial nephrectomy. Urology 2014; 84(1): 237-42 16 De Backer P et al.: Improving augmented reality through deep learning: real-time instrument delineation in robotic renal surgery. Eur Urol 2023; 84(1): 86-91 17 Porpiglia F et al.: Three-dimensional augmented reality robot-assisted partial nephrectomy in case of complex tumours (PADUA ≥10): a new intraoperative tool overcoming the ultrasound guidance. Eur Urol 2020; 78(2): 229-38 18 Nimmagadda N et al.: Patient-specific, touch-based registration during robotic, image-guided partial nephrectomy. World J Urol 2022; 40(3): 671-7 19 Autorino R, Porpiglia F: Robotic-assisted partial nephrectomy: a new era in nephron sparing surgery. World J Urol 2020; 38(5): 1085-6 20 Gallioli A et al.: Initial experience of robot-assisted partial nephrectomy with Hugo™ RAS system: implications for surgical setting. World J Urol 2023; 41(4): 1085-91 21 Samalavicius NE et al.: Robotic surgery using Senhance® robotic platform: single center experience with first 100 cases. J Robot Surg 2020; 14(2): 371-6 22 Rich JM et al.: Transperitoneal versus retroperitoneal single-port robotic-assisted partial nephrectomy: an analysis from the Single Port Advanced Research Consortium. Eur Urol Focus 2023; 2405-4569 23 Carbonara U et al.: Single-port robotic partial nephrectomy: impact on perioperative outcomes and hospital stay. Ther Adv Urol 2023; 15: 17562872231172834 24 Pellegrino AA et al.: Simplifying retroperitoneal robotic single-port surgery: novel supine anterior retroperitoneal access. Eur Urol 2023; 84(2): 223-8 25 Malthouse T et al.: The future of partial nephrectomy. Int J Surg 2016; 36(Pt C): 560-7
Das könnte Sie auch interessieren:
Neue Daten zum Nierenzellkarzinom
Auf dem ASCO-Kongress 2024 wurden auf dem Gebiet des Nierenzellkarzinoms (RCC) zwar keine Daten präsentiert, die einen Paradigmenwechsel herbeiführen werden, es gab jedoch einige ...
Highlights zum Prostatakarzinom
Am diesjährigen Kongresses der American Society of Clinical Oncology (ASCO) standen bei der Behandlung des Prostatakarzinoms ein Update der EMBARK-sowie der NEPTUNES-Studie im Fokus.
Hodentumoren: Neues vom ASCO 2024
Obwohl dieses Jahr am ASCO wenige neue Daten und Erkenntnisse zum Thema Hodentumoren vorgestellt wurden, lässt sich ein Poster von Dr. Khalid Alkhatib hervorheben.