CED und Schwangerschaft: Therapie in einer sensiblen Lebensphase
Autor:innen:
Dr. Simone Megymorecz
Innere Medizin und Gastroenterologie & Hepatologie, Endokrinologie, Rheumathologie und Nephrologie
Zentrale Aufnahme- und Erstversorgungseinheit (ZAE)
Klinikum Klagenfurt am Wörthersee
E-Mail: simone.megymorecz@kabeg.at
Univ.-Prof. Dr. Clemens Dejaco
Innere Medizin III, Abteilung Gastroenterologie & Hepatologie
Medizinische Universität Wien, AKH
E-Mail: clemens.dejaco@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Frauen im gebärfähigen Alter, die eine chronisch-entzündliche Darmerkrankung (CED) haben, können im Zusammenhang mit einem bestehenden Kinderwunsch mit Unsicherheit und Ängsten zu kämpfen haben. Aktuelle europäische Leitlinien bieten Orientierung hinsichtlich einer möglichst interdisziplinären Betreuung vor, während und nach einer Schwangerschaft.
Keypoints
-
Es gibt für CED-Patientinnen keinen Grund, auf eine Schwangerschaft zu verzichten.
-
Unter Remission sind der zu erwartende Schwangerschaftsverlauf und die Chance auf ein gesundes Kind jenen von Frauen ohne CED gleichzusetzen.
-
Dementsprechend sollten remissionserhaltende Medikamente nicht willkürlich abgesetzt werden und Erkrankungsschübe rasch und effizient, wie bei nicht schwangeren Patientinnen, behandelt werden.
-
Stillen wird empfohlen, eine präkonzeptionelle Planung bzw. eine Beratung für junge CED-Patientinnen wäre wünschenwert.
CED wie Morbus Crohn (MC) und Colitis ulcerosa (CU) werden zumeist in einem Lebensalter diagnostiziert, in dem Sexualität und Kinderwunsch eine wichtige Rolle spielen. Immunsuppressive und -modulierende Therapien stellen signifikant erfolgreiche Behandlungsmöglichkeiten dar, wenngleich siezur Remissionserhaltungmittel- bis langfristig fortgeführt werden müssen.
Für Frauen im gebärfähigen Alter, die eine CED haben, und deren behandelnde Ärzt:innen führt ein Kinderwunsch oft zu Unsicherheit und Ängsten aufgrund unzureichender Daten und restriktiver Fachinformationen, wenngleich nachgewiesene embryo- oder fetotoxische Effekte durch die Therapie der Erkrankungnicht vorliegen. Diese Problematik hat sich aktuell mit den zahlreichen neu zugelassenen Substanzen verstärkt.
Ein österreichischer Konsensusbericht der Österreichischen Gesellschaft für Gastroenterologie & Hepatologie (OEGGH) und der Österreichischen Gesellschaft für Rheumatologie (ÖGR) aus dem Jahr 2019 hat sich bereits mit dieser Thematik beschäftigt und einen praktischen Leitfaden für den Einsatz von Immunsuppressiva und Biologika während der Schwangerschaft und Stillzeit geliefert.1
Die 2022 publizierten, neuen „European Crohn’s and Colitis Guidelines on Sexuality, Fertility, Pregnancy and Lactation“ bieten nun zusätzliche Sicherheit mit Empfehlungen hinsichtlich neu zugelassener Substanzen und der Optimierung einer möglichst interdisziplinären Betreuung während und nach einer Schwangerschaft.2
Orale Kontrazeptiva und Kinderwunsch
Noch vor einem Kinderwunsch stellt sich CED-Patientinnenoft die Frage nach oralen Verhütungsmitteln und deren Einsatz. Da deren Resorption im Dünndarm stattfindet, ist es plausibel, dass die Effektivität bei Patientinnen mit einer ausgeprägten Dünndarmaktivität oder auch nach längerstreckigen Resektionen vermindert ist, wobei es hierzu keine hilfreichen Studiendaten gibt.3
Betrachtet man die vorhandenen Sicherheitsdaten, so lässt sich kein erhöhtes Risiko bezüglich einer Schubaktivierung unter Verwendung oraler Kontrazeptiva feststellen. Generell wird aber eine sorgfältige Risikobewertung hinsichtlich eines erhöhten Thromboserisikos empfohlen.4
Bei Verwandten ersten Grades besteht ein um 12 bis 20% erhöhtes Risiko, eine CED zu entwickeln, wobei das Risiko für die Entwicklung eines Morbus Crohn höher ist (8x erhöht) als das einer CU-Entwicklung (4x erhöht). Das Risiko steigt aber signifikant weiter an, wenn beide Eltern von einer CED betroffen sind.5–7
Eine präkonzeptionelle Beratung sollte des Weiteren den Ausgleich einer eventuellen Malnutrition umfassen sowie das Absetzen potenziell teratogener Substanzen wie Methotrexat. Patientinnen mit einer laufenden Sulfasalazintherapie sollten eine höher dosierte Folsäuresubstitution von 2mg pro Tag erhalten.8,9
Prinzipiell kann eine Schwangerschaft das Risiko für einen Schub bei CU erhöhen sowie zu Komplikationen beim MC führen, insbesondere wenn zum Zeitpunkt der Empfängnis eine aktive Erkrankung besteht.10 Postpartal scheint das Schubrisiko bei Colitis-ulcerosa-Patientinnen gegenüber Morbus-Crohn-Patientinnen erhöht zu sein, wie eine prospektive Multicenter-Studie mit 209 Patientinnen zeigte.10
Eine aktive Erkrankung erhöht ebenso das Risiko für einen Abort, Schwangerschaftskomplikationen und eine Frühgeburt, während eine Remission zum Zeitpunkt der Konzeption das Risiko auf das der Normalbevölkerung herabsetzt.11
Des Weiteren ist eine aktive Erkrankung mit einer verminderten Fertilität bei Frauen und Männern assoziiert.12,13 Die meisten CED-Medikamente haben allerdings keinen Einfluss auf die Fertilität, lediglich Sulfasalazin ist mit einer reversen Oligospermie und Asthenozoospermie assoziiert und Männer mit Kinderwunsch sollten daher auf Mesalazin umgestellt werden.13
Bezüglich des Monitorings während der Schwangerschaft bleibt das fäkale Calprotectin ein verlässlicher Parameter, während beispielsweise bei CRP und Hämoglobin nur eine Trendbeobachtung sinnvoll ist.14 Die Darmsonografie ist sicher die Methode der Wahl zur Detektion von Komplikationen und Krankheitsaktivität, bei klinischer Notwendigkeit kann während einer Schwangerschaft aber auch sicher endoskopiert werden. Ein MRT (ohne Gadolinium) sollte ganz klar einem CT vorgezogen werden, eine Kapselendoskopie gilt als kontraindiziert.15–17 Bezüglich einer Antikoagulation während der Schwangerschaft sollten vor allem Patientinnen mit einer aktiven Erkrankung vor der Konzeption auf mögliche zusätzliche Risikofaktoren gescreent werden.18
Medikamentöse Therapien
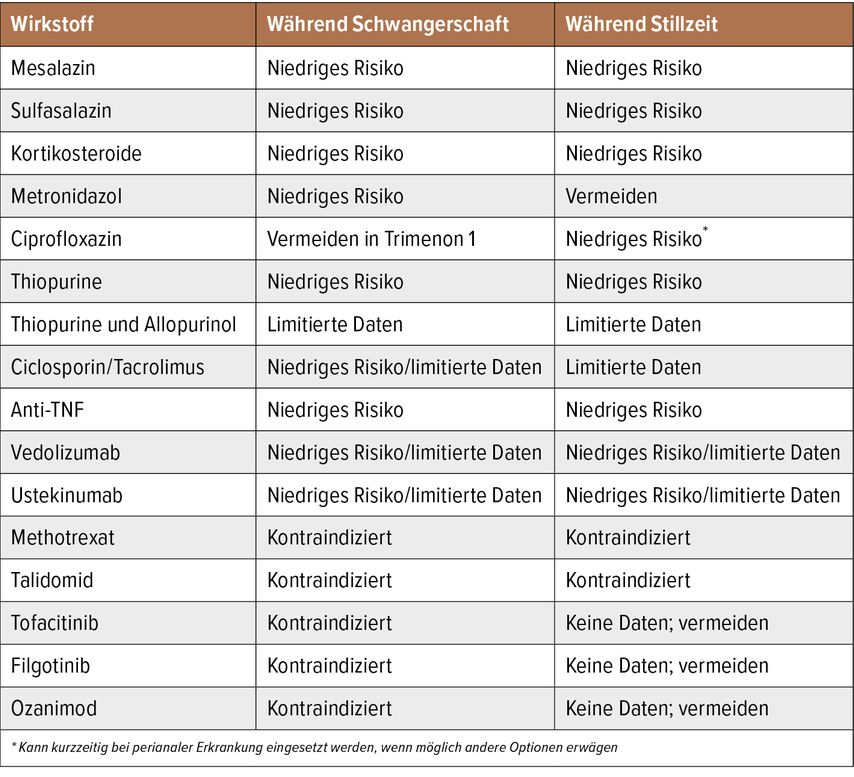
Akute Schübe sollen während der Schwangerschaft prinzipiell entsprechend den aktuellen Guidelines für „nicht schwangere“ Patientinnen behandelt werden, da das Risiko für unerwünschte Ereignisse unter der Behandlung mit Antibiotika, 5-Aminosalizylaten, Kortikosteroiden und Anti-TNF-Blockern niedrig ist.19,20
Unter prolongiertem Einsatz von Kortikosteroiden steigt das Risiko für Infektionen, Hypertonie, Diabetes und Präeklampsie, daher sollten in diesem Fall TNF-alpha-Blocker präferiert werden. Bei milderer Erkrankung kommt auch Budesonid als Alternative infrage, obwohl es dazu weniger Daten gibt.21,22
Bei CED-Patientinnen mit akutem Schub stellen Anti-TNF-Präparate sicher die erste Wahl dar, bei fulminanter CU kann zur Vermeidung einer Operation auch Ciclosporin eingesetzt werden.23Eine Therapie mit Thiopurinen sollte aufgrund des Risikos für idiosynkratische Reaktionen und des langsamen Wirkeintritts während einer Schwangerschaft nicht begonnen werden, allerdings wird das Fortführen einer bestehenden, remissionserhaltenden Therapie empfohlen.24
Eine Anti-TNF-Therapie gilt als sicher und unbedenklich für Mutter und Embryo bzw. Fötus, sodass generell eine Fortführung während der Schwangerschaft empfohlen wird. Die große prospektive PIANO-Studie fand unter Anti-TNF-Therapie, mit und ohne Kombination mit Thiopurinen, kein erhöhtes Risiko für kongenitale Malformationen, Spontanaborte, Frühgeburten, für niedriges Geburtsgewichts oder kindliche Infektionen.9
Bei Patientinnen in Remission wird eine Unterbrechung der TNF-alpha-Therapie vor dem 3. Trimester nicht empfohlen, weil es das Risiko für einen Relaps erhöht. Die letzte Gabe eines TNF-Hemmers im 3. Trimester kann aber mit dem zu erwartendem Geburtstermin akkordiert werden, um das Expositionsrisiko des Kindes zu reduzieren. Bei Patientinnen, die eine Unterbrechung wünschen, sollte die Therapie nach der Geburt wieder fortgeführt werden.25
Vedolizumab und Ustekinumab können nach sorgfältiger Nutzen-Risiko-Abwägung und Information der Patientin während einer Schwangerschaft verwendet werden, wenngleich die vorliegende, schwache Datenlage noch keine allgemein sichere Empfehlung erlaubt. In der prospektiven NOVA-Studie mit 50 Vedolizumab-exponierten Schwangeren und in der retrospektiven CONCEIVE-Studie (n=79) konnten keine negativen Signale bezüglich maternaler und neonataler Outcomes festgestellt werden, In den meisten Fällen gab es keine Events unter den Therapien.9,26
Aufgrund weitgehend fehlender Daten beim Menschen und potenziell teratogener Effekte im Tierversuch gelten JAK-Inhibitoren und S1P-Rezeptor-Modulatoren aktuell als kontraindiziert während der Schwangerschaft, hier wird ein rechtzeitiges Absetzen bzw. eine effektive Verhütung empfohlen.
Eine multidisziplinäre Therapieentscheidung bei komplizierten Schwangerschaftsverläufen ist im Sinne des besten Outcomes anzustreben, sodass bei klinischer Notwendigkeit die Entscheidung für eine Operation nicht verzögert werden sollte.19
Die Art der Entbindung – vaginal vs. Sectio – scheint generell keinen Einfluss auf den Krankheitsverlauf einer CED zu haben, insbesondere in Hinblick auf Entwicklung oder Verschlechterung einer perianalen Erkrankung. Bei Patientinnen mit aktiver perianaler Erkrankung, vorangegangener rektovaginaler Fistel und nach Proktokolektomie sollte nach interdisziplinärer Beratung eher eine Sectio favorisiert werden.27,28
Stillzeit/Impfungen
Stillen kann generell für CED-Patientinnen empfohlen werden, da Stillen einen protektiven Effekt für das Kind mit sich bringt. Aufgrund sehr geringer bis minimaler Medikamenten- bzw. Biologikaspiegel in der Muttermilch gilt Stillen als unbedenklich, wasdie während der Schwangerschaft verabreichten Präparate betrifft.
Bezüglich Impfungen des Säuglings im 1. Lebensjahr bleibt die Empfehlung aufrecht, dass in utero Biologika-exponierte Kinder innerhalb des 1. Lebensjahrs keine Lebendimpfungen erhalten sollen. InÖsterreich betrifft das vor allem die Rotavirus-Impfung und eventuell auch MMR (Impfempfehlung 9–12 Monate), falls dasBiologikum durchgehend verabreicht wurde.29
Literatur:
1 Puchner A et al.: Immunosuppressives and biologics during pregnancy and lactation: A consensus report issued by the Austrian Societies of Gastroenterology and Hepatology and Rheumatology and Rehabilitation. Wien. Klin. Wochenschr 2019; 131: 29-44 2 Torres J et al.: European Crohn’s and Colitis Guidelines on Sexuality, Fertility, Pregnancy, and Lactation. J Crohns Colitis 2023; 17: 1-27 3 Zapata LB et al.: Contraceptive use among women with inflammatory bowel disease: A systematic review. Contraception 2010; 82: 72-85 4 Curtis KM et al.: U.S. Medical Eligibility Criteria for Contraceptive Use, 2016. MMWR Recomm Rep 2016; 65: 1-103 5 Orholm M et al.: Familial occurrence of inflammatory bowel disease. N Engl J Med 1991; 324: 84-8 6 Peeters M et al.: Familial aggregation in Crohn’s disease: Increased age-adjusted risk and concordance in clinical characteristics. Gastroenterol 1996; 111: 597-603 7 Loftus EV: Clinical epidemiology of inflammatory bowel disease: incidence, prevalence, and environmental influences. Gastroenterol 2004; 126: 1504-17 8 Abhyankar A et al.: Meta-analysis: the impact of disease activity at conception on disease activity during pregnancy in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2013; 38: 460-6 9 Mahadevan U et al.: Inflammatory bowel disease in pregnancy clinical care pathway: A report from the American Gastroenterological Association IBD Parenthood Project Working Group. Gastroenterol 2009; 156: 1508-24 10 Pedersen N et al.: The course of inflammatory bowel disease during pregnancy and postpartum: a prospective European ECCO-EpiCom Study of 209 pregnant women. Aliment Pharmacol Ther 2013; 38: 501-12 11 Bröms G et al.: Birth outcomes in women with inflammatory bowel disease: effects of disease activity and drug exposure. Inflamm Bowel Dis 2014; 20(6): 1091-8 12 Palomba S: Inflammatory bowel diseases and human reproduction: A comprehensive evidence-based review. World J Gastroenterol 2014; 20: 7123 13 Ananthakrishnan AN et al.: Paternal disease activity is associated with difficulty in conception among men with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2019; 17: 203-4 14 Rottenstreich A et al.: Clinical utility of fecal calprotectin in monitoring disease activity and predicting relapse in pregnant patients with inflammatory bowel diseases. Eur J Intern Med 2020; 77: 105-10 15 Bandorski D et al.: Contraindications for video capsule endoscopy. World J Gastroenterol 2016; 22: 9898 16 Ludvigsson JF et al.: Outcomes of pregnancies for women undergoing endoscopy while they were pregnant: a nationwide cohort study. Gastroenterol 2017; 152: 554-63.e9 17 Stern MD et al.: Magnetic resonance enterography in pregnant women with Crohn’s disease: case series and literature review. BMC Gastroenterol 2014; 14: 146 18 Bates SM et al.: American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy. Blood Adv 2018; 2: 3317-59 19 Torres J et al.: ECCO Guidelines on therapeutics in Crohn’s disease: medical treatment. J Crohns Colitis 2020; 14: 4-22 20 Raine T et al.: ECCO guidelines on therapeutics in ulcerative colitis: medical treatment. J Crohns Colitis 2022; 16: 2-17 21 Gur C et al.: Pregnancy outcome after first trimester exposure to corticosteroids: a prospective controlled study. Reprod Toxicol 2004; 18: 93-101 22 Beaulieu DB et al.: Budesonide induction and maintenance therapy for Crohnʼs disease during pregnancy: Inflamm Bowel Dis 2009; 15: 25-8 23 Branche J et al.: Cyclosporine treatment of steroid-refractory ulcerative colitis during pregnancy: Inflamm Bowel Dis 2009; 15: 1044-8 24 Langagergaard V et al.: Birth outcome in women treated with azathioprine or mercaptopurine during pregnancy: a Danish nationwide cohort study. Aliment Pharmacol Ther 2007; 25: 73-81 25 Nguyen GC et al.: The Toronto Consensus Statements for the management of inflammatory bowel disease in pregnancy. Gastroenterol 2016; 150: 734-57.e1 26 Martin PL et al.: Development in the cynomolgus macaque following administration of ustekinumab, a human anti-IL-12/23p40 monoclonal antibody, during pregnancy and lactation. Birth Defects Res B Dev Reprod Toxicol 2010; 89: 351-63 27 Foulon A et al.: Defining the most appropriate delivery mode in women with inflammatory bowel disease: a systematic review. Inflamm Bowel Dis 2017; 23: 712-20 28 Cheng AG et al.: Impact of mode of delivery on outcomes in patients with perianal Crohnʼs Disease. Inflamm Bowel Dis 2014; 20: 1391-8 29 Park SH et al.: Safety and optimal timing of BCG Vaccination in infants born to mothers receiving Anti-TNF therapy for inflammatory bowel disease. J Crohns Colitis 2020; 14: 1780-4
Das könnte Sie auch interessieren:
Vorsorgekoloskopie und Polypektomienachsorge
In ihrem Vortrag zum Darmkrebs-Screening in Österreich an der SGG-Jahrestagung 2024 ermöglichte Univ.-Prof. Dr. med. Monika Ferlitsch, Wien, einen Blick über den Tellerrand. Sie zeigte ...
Interdisziplinäres Management bei Divertikulitis
Bei der Behandlung der Divertikulitis ist eine enge, interdisziplinäre Zusammenarbeit zwischen Gastroenterologen und Chirurgen unerlässlich. Eine enge Kooperation ermöglicht eine ...
Schwere Pankreatitis – intensivmedizinische Therapiekonzepte
Die schwere akute Pankreatitis geht mit einer hohen Mortalität einher. Da häufig Organversagen und lokale Komplikationen mit ihr assoziiert sind, ist die intensivmedizinische Behandlung ...