Diagnostische Fallstricke der myometrialen Raumforderungen
Autorin:
Dr. med. Hubertina Reina
Frauenklinik
Universitätsspital Basel
E-Mail: hubertina.reina@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Leiomyome (Myome oder Fibrome) sind die häufigsten Tumoren des weiblichen kleinen Beckens, jedoch verfügen wir aktuell über keine nichtinvasiven Diagnosemittel, die sie uns von den deutlich selteneren (circa 3–9% aller uterinen Tumoren), aber aggressiven Sarkomen sicher unterscheiden lässt. Der «Basel Sarcoma Score» ist ein diagnostisches Tool zur Beurteilung myometrialer Raumforderungen, um das Risiko für maligne Tumoren wie Leiomyosarkome in der Gebärmutter abzuschätzen.
Daten einer Studie, deren Ziel es war, zu verifizieren, wie viele präoperativ unerkannte Sarkome in den postoperativen Präparaten histologisch gesichert wurden, zeigt, dass das Risiko mit dem Alter der operierten Frau steigt. So war die Inzidenz in der Altersgruppe zwischen 25 und 29 Jahren 1:575, in der Altersgruppe zwischen 50 und 54 Jahren 1:216 und in der Altersgruppe zwischen 75 und 79 Jahren 1:98.1 Wenn man bedenkt, dass diese malignen mesenchimalen Tumoren keine spezifischen Symptome aufweisen, keine andere sichere niederschwellige Diagnostikmöglichkeit bieten (wie z.B. eine Pipelle de Cornier), oft im fortgeschrittenen Stadium diagnostiziert werden und meistens eine schlechte Prognose haben, wird deutlich, dass deren Erkennung in der Routinebildgebung in der gynäkologischen Praxis sehr herausfordernd ist.
In einer retrospektiven Studie, die in europäischen Ultraschallzentren durchgeführt wurde, wurden 78,5% der 195 Sarkome von den Experten korrekt als solche präoperativ diagnostiziert. Sonografisch zeigten sich die meisten Sarkome als solide Raumforderungen (79,5%) mit inhomogener Echogenität (77,4%), manchmal mit irregulären zystischen Arealen (33,8%) und nur selten mit fächerartigem posteriorem Schallschatten (2,1%). Die Durchblutung von Sarkomen in der Doppler-Untersuchung war moderat bis stark (67,9%).2 Die Metaanalyse von Raffone et al. hat unter den insgesamt 317 Fällen zusätzlich die hohe Prävalenz von solitären Läsionen (81,5%) unterstrichen.3
«Basel Sarcoma Score» (BSS)
Die Mehrzahl der myometrialen Raumforderungen wird jedoch primär im normalen Praxisalltag beurteilt und nur bei Zweifeln ins Ultraschallzentrum zur Zweitmeinung überwiesen. An der Frauenklinik Basel wird seit 2015 der «Basel Sarcoma Score» (BSS) eingesetzt, ein Triagemittel, das für jeden, vom Facharzt bis zum Erstjahresassistenzarzt, einfach zu erlernen ist. 2023 dazu publizierte Daten von 545 Fällen bestätigen einen negativen prädiktiven Wert (NPV) von 99,8%.4
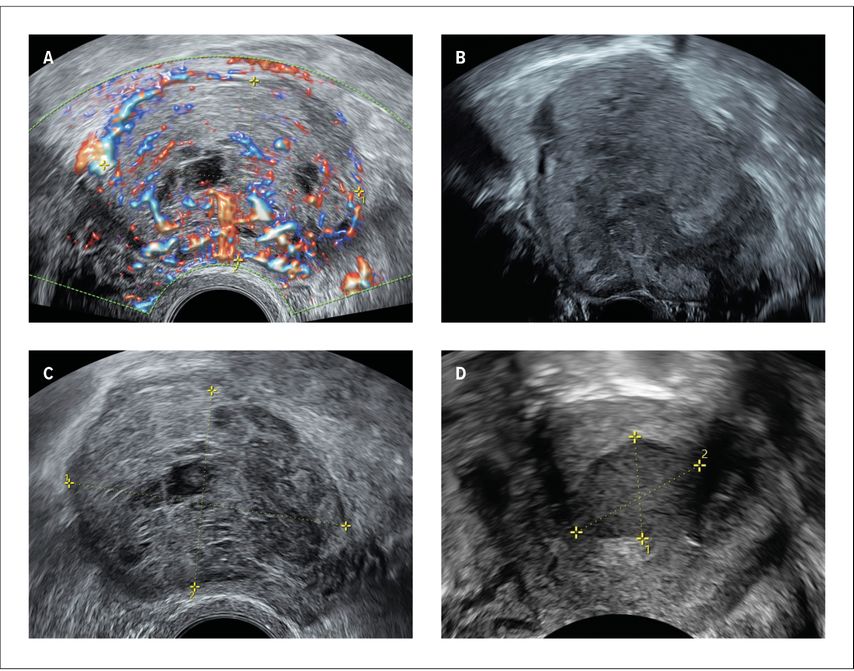
Der BSS umfasst sechs teils klinische, teils sonografische Kriterien (Tab. 1, Abb. 1): starkes Wachstum in den letzten drei Monaten (Volumenzunahme von >20%), atypisches Wachstum (z.B. in der Postmenopause, unter GNRH-Analoga), starker Blutfluss («Color Score 4» nach IOTA)5, unregelmässige Begrenzung, zentrale Nekrose und die Präsenz als ovale solitäre Läsion. Sind eines oder mehrere Kriterien in der Postmenopause oder zwei oder mehr in der Prämenopause positiv, gilt der Score als verdächtig und somit bedarf die Patientin einer Form von weiterführender Diagnostik, sei es die einfache sonografische Verlaufskontrolle nach drei Monaten (siehe Kriterium 1), die Zuweisung zur Zweitmeinung oder der Einsatz eines MRI Abdomen/Becken.6 Das Wachstum innerhalb von drei Monaten kann nur nach einer zeitgerechten Verlaufskontrolle angegeben werden.
Abb. 1:«Basel Sarcoma Score» – sonografische Kriterien: A: starker Blutfluss, B: unregelmässige Begrenzung, C: Nekrose, D: ovale solitäre Läsion
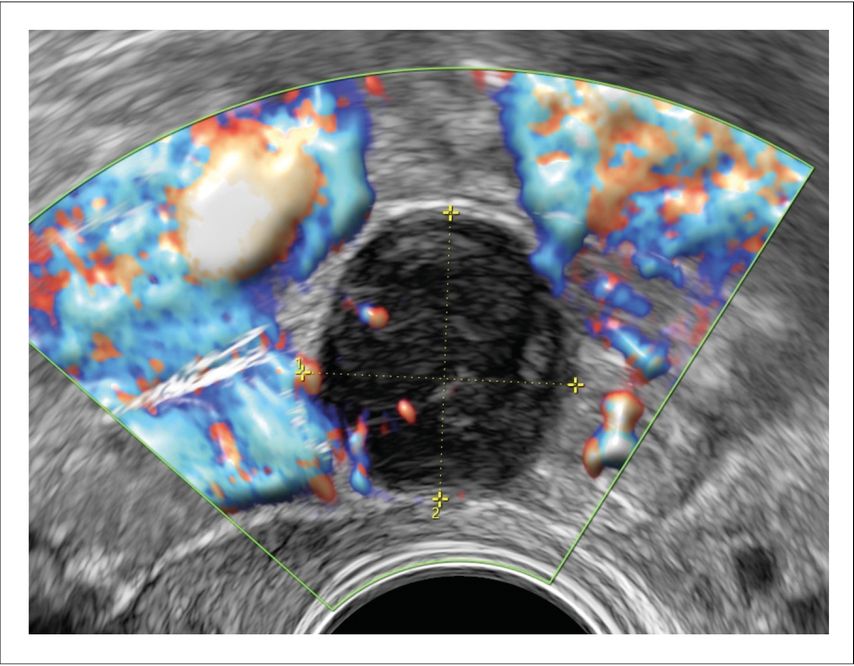
Auch im Falle von Tumoren im kleinen Becken, deren Ursprung unklar bleibt, sendet der BSS ein Warnsignal bei sonografisch suspekten Merkmalen wie z.B. die starke Durchblutung oder die unregelmässige Begrenzung. Es kann aber auch im Gegenzug, bei negativem Score, eine Deeskalation ermöglichen. Zur Letzteren gehörte der Fall einer 64-jährigen Patientin mit einem soliden Befund in der rechten Adnexloge von 16mm Durchmesser. Der Tumormarker CA125 war mit 9,9U/ml im Normbereich. Die Patientin unterzog sich 2005 einer Hysterektomie mit Adnexektomie links und Teilovarektomie rechts bei Endometriose ARSM IV. Sie erlitt im Jahr 2003 und erneut im Jahr 2023 ein Melanom mit Lymphknotenbefall, weswegen sie unter Immuntherapie war. Sonografisch zeigte sich ein unauffälliges Restovar rechts und eine in der 3-Monats-Kontrolle grössenstabile, runde, glatt begrenzte, elastische, moderat vaskularisierte, solide Raumforderung im Douglas rechts (Abb. 2). Der BSS war negativ mit einem Score von 0/5. Das postmenopausale Wachstum war nicht beurteilbar, da die Diagnosestellung erst postmenopausal erfolgte und man über keine Vergleichsbilder verfügte. Wegen der medizinischen Vorgeschichte der Patientin entschied man sich trotzdem für die operative Abklärung, somit folgte die laparoskopische Entfernung des an einer Dünndarmschlinge adhärenten Befundes. Die definitive histologische Diagnose ergab ein Leiomyom vom Dünndarm ausgehend und bestätigte somit die Gutartigkeit der Raumforderung.
Abb. 2: Solide Raumforderung im kleinen Becken rechts bei St.n. Hysterektomie. BSS 0/5. Starkes Wachstum in den letzten 3 Monaten, starker Blutfluss, unregelmässige Begrenzung, zentrale Nekrose, ovale solitäre Läsion
Adenomyosis uteri
Eine weitere Herausforderung in der sonografischen Diagnostik des Myometriums in der Peri- und Postmenopause stellt die Adenomyosis uteri dar. Sie entsteht durch heterotope endometriale Drüsen und Stroma im Myometrium und verursacht histologisch eine reaktive Hypertrophie und Fibrose des Myometriums selbst. Zwar geht eine Adenomyosis bekannterweise mit Dysmenorrhö und Blutungsstörungen einher, die primär eine Problematik der Frau im reproduktiven Alter darstellen, jedoch können eine Endometriose und/oder Adenomyosis auch in der Menopause symptomatisch sein. Dies betrifft ca. 4% der Fälle, wobei der Mechanismus noch unklar bleibt. Man vermutet eine Mitwirkung von der Hormonersatztherapie oder von Tamoxifen, jedoch können diese Herde auch eine eigene Östrogenproduktion und eine Reduktion der Progesteron-Rezeptoren aufweisen. Unabhängig von den Symptomen ist das Endometrium bei Patientinnen mit Adenomyosis oft extrem schlecht abgrenzbar.7–9
In einem Experten-Konsensus von 2022 wurden die Kriterien der «Morphological Uterus Sonographic Assessment»(MUSA)- Gruppe beurteilt und die sonografischen Merkmale für die Diagnose einer Adenomyosis definiert.10 Diese umfassen drei direkte (diagnostische) Kriterien (intramurale Zysten, hyperechogene Areale und subendometriale Linien und Knospen) und sechs indirekte (verdächtige) Kriterien (asymmetrische Wandverdickung, fächerartiger Schallschatten, globulärer Uterus, transläsionäre Vaskularisation, unregelmässiger endomyometrialer Übergang und unterbrochener endomyometrialer Übergang).
Die Adenomyosis kann über die Jahre zu solchen Veränderungen der Struktur der Gebärmutter und vom endomyometrialen Übergang führen, dass die Messung von der Endometriumdicke manchmal gar nicht mehr möglich ist. Sehr wichtig ist es, bei Zweifeln keine Messung zu «schätzen», sondern eine Messung nur dann anzugeben, wenn man das Endometrium tatsächlich abgrenzen kann. Noch wichtiger ist es, den Patientinnen, bei denen es technisch durchführbar ist, eine Hydrosonografie anzubieten. Dies hat sich auch im Falle einer Malignität im Hinblick auf Zellstreuung als sicher erwiesen.11
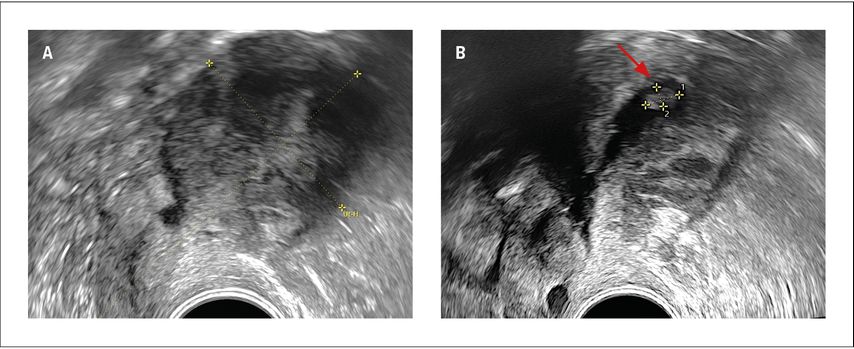
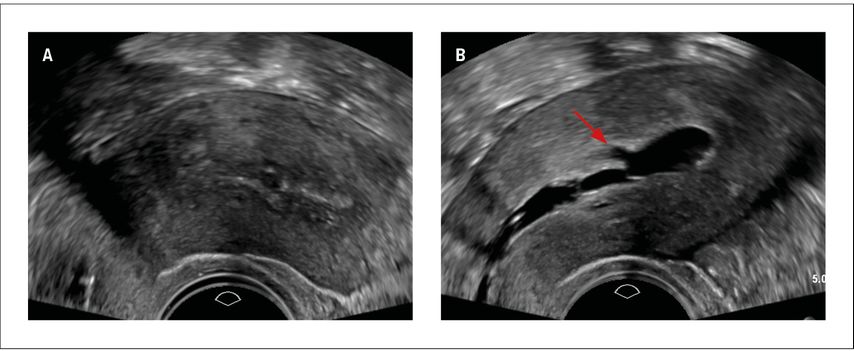
Die folgenden Beispiele unterstreichen, wie sehr man sich mit der Endometriummessung bei Adenomyosis uteri verschätzen kann. Im ersten Beispiel (Abb. 3) handelte es sich um eine postmenopausale Patientin mit vaginaler Blutung unter Hormonersatztherapie. Das Endometrium schien hoch aufgebaut vor allem an der Vorderwand, wo man sogar eine Infiltration vermuten konnte, aber eine genaue Messung war definitiv nicht möglich. Mittels Hydrosonografie konnte man eine polypoide Struktur am Fundus klar nachweisen, die in B-Mode nicht darzustellen war. Der zweite Fall (Abb. 4) zeigt die Ultraschallbilder einer perimenopausalen Patientin mit Dauerblutung unter Gestagenpille. Initial hatte man einen Endometriumpolyp vermutet, aber bei direkten Zeichen einer Adenomyosis mit hyperechogenen Arealen und subendometrialen Knospen hatte man sich für eine Diagnostik mittels Hydrosonografie entschieden. Tatsächlich konnte man somit eindeutig ein atrophes Endometrium dokumentieren und die Verbindung vom Cavum zu einer subendometrialen Adenomyosiszyste darstellen. Erst die korrekte sonografische Diagnose ermöglichte die korrekte therapeutische Wahl.
Abb. 3: A: Transvaginale Sonografie bei einer Patientin mit postmenopausaler Blutung unter Hormonersatztherapie; das Endometrium ist nicht messbar. B: Hydrosonografie derselben Patientin mit Nachweis einer polypoiden Struktur im Cavum (Pfeil)
Abb. 4: A: Uterus mit schlecht abgrenzbarem Endometrium bei einer perimenopausalen Patientin mit Blutungsstörung unter Gestagenpille und V.a. Polyp. B: Hydrosonografie derselben Patientin mit Nachweis von atrophem Endometrium und einer subendometrialen Adenomyosiszyste (Pfeil)
Fazit
Aktuell verfügen wir noch über keine sicheren sonografischen Diagnosekriterien für die Differenzierung von Myomen zu Sarkomen, jedoch kann die Erkennung von einfachen Ultraschallmerkmalen (wie z.B. beim «Basel Sarcoma Score») bei der Triagierung von myometrialen Raumforderungen unterstützen und die Aufmerksamkeit auch von weniger erfahrenen Untersuchern wecken.
Die Adenomyosis uteri kann auch postmenopausal Symptome verursachen sowie die Diagnostik von Endometrium- und anderen Myometriumpathologien erschweren. Wichtig ist es, sich nicht mit einer ungewissen Endometriummessung zufriedenzugeben, sondern niederschwellig an eine weiterführende Abklärung mittels Hydrosonografie zu denken.
Literatur:
1 Brohl AS et al.: Age-stratified risk of unexpected uterine sarcoma following surgery for presumed benign leiomyoma. Oncologist 2015; 20(4): 433-9 2 Ludovisi M et al.: Imaging in gynecological disease (15): Clinical and ultrasound characteristics of uterine sarcoma. Ultrasound Obstet Gynecol 2019; 54(5): 676-87 3 Raffone A et al.: Prevalence of sonographic signs in women with uterine sarcoma: A systematic review and meta-analysis. Ultraschall Med 2024; 45(3): 293-304 4 Knipprath-Mészáros AM et al.: High negative prediction for the Basel sarcoma score: Sonographic assessment of features suspicious of uterine sarcoma. Gynecol Oncol 2023; 174: 182-9 5 Timmerman D et al.: Terms, definitions and measurements to describe the sonographic features of adnexal tumors: A consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group. Ultrasound Obstet Gynecol 2000; 16(5): 500-5 6 Raffone A et al.: Diagnostic accuracy of MRI in the differential diagnosis between uterine leiomyomas and sarcomas: A systematic review and meta-analysis. Int J Gynaecol Obstet 2024; 165(1): 22-33 7 Lister JE et al.: Ultrasound appearance of adenomyosis mimicking adenocarcinoma in a postmenopausal woman. J Clin Ultrasound 1988; 16(7): 519-21 8 Naftalin J et al.: Endometrial cancer and ultrasound: Why measuring endometrial thickness is sometimes not enough. Ultrasound Obstet Gynecol 2012; 39(1): 106-9 9 Benagiano G et al.: The history of endometriosis. Gynecol Obstet Invest 2014; 78(1): 1-9 10 Harmsen MJ et al.: Consensus on revised definitions of Morphological Uterus Sonographic Assessment (MUSA) features of adenomyosis: Results of modified Delphi procedure. Ultrasound Obstet Gynecol 2022; 60(1): 118-31 11 Van Den Bosch T et al.: Typical ultrasound features of various endometrial pathologies described using International Endometrial Tumor Analysis (IETA) terminology in women with abnormal uterine bleeding. Ultrasound Obstet Gynecol 2021; 57(1): 164-72
Das könnte Sie auch interessieren:
ERAS: Was wissen und machen wir in Österreich?
Im September 2024 fand in der Nähe von Málaga in Spanien der 10. Weltkongress der Internationalen Gesellschaft für „Enhanced Recovery After Surgery“ (ERAS) statt. Im Rahmen des ...
Morbus Paget der Vulva
Nach Definition der WHO stellt der Morbus Paget der Vulva eine intraepitheliale Neoplasie und obligate Präkanzerose dar, die von pluripotenten Stammzellen der interfollikulären Epidermis ...
„Eine Kombination könnte eine personalisierte und prädiktive Medizin ermöglichen“
Wir müssen uns eingestehen, dass auch in der heutigen Medizin manche Vorgehensweisen als unmodern und geradezu primitiv anzusehen sind. Dies gilt auch für Vorsorge und Früherkennung von ...