«Women’s Sleep is Special»
Autor:innen:
Dr. med. Petra Cassel1
Dipl.Psych. Werner Cassel2
1Praxis Frauenärztinnen Giessen
2Schlafmedizinisches Zentrum Giessen
Giessen
E-Mail: info@frauenaerztinnen-giessen.de
Guter Schlaf ist bestimmend für körperliche und seelische Gesundheit. Schlaf wird durch ein komplexes Zusammenspiel psychischer, neurophysiologischer und endokrinologischer Faktoren gesteuert. Die menschliche Reproduktion bedingt eine besondere weibliche Physiologie und Endokrinologie, die mit dafür verantwortlich ist, dass Frauen anders schlafen als Männer.
Schon in Kindheit, Jugend und jungem Erwachsenenalter zeigen sich charakteristische Besonderheiten des weiblichen Schlafs. Melatonin als wichtiges schlafregulierendes Hormon interagiert mit weiblichen Sexualhormonen. Schlaf ist zyklusabhängig und hat Einfluss auf die Fruchtbarkeit. Wissen um die spannenden und interessanten Besonderheiten des weiblichen Schlafs und die Integration von psychologischen, schlafmedizinischen und chronobiologischen Faktoren in die frauenärztliche Versorgung können der Entwicklung von Schlafstörungen vorbeugen.
Da Schlaf unser Bewusstsein ausschaltet, entzieht er sich der direkten Wahrnehmung. Wie bei Säugetieren und Vögeln ist menschlicher Schlaf kein stabiler, gleichförmiger Zustand der Bewusstlosigkeit, sondern ein hochaktiver Prozess, der neben der Erholung zahlreiche weitere wichtige Funktionen hat.
Zellreparatur, Wachsen, Wundheilung und Stärkung des Immunsystems sind ebenso bedeutsam wie Lernen, Vergessen, Konfliktverarbeitung und Demenzprophylaxe, um nur einige zu nennen.
Schlafregulation – die Funktion der inneren Uhr
Etwa seit der Jahrtausendwende wurden wichtige, den Schlaf beeinflussende Faktoren aufgeklärt. Schlaf ist nicht allein homöostatisch geregelt, sondern es gibt eine Vielzahl miteinander interagierender Faktoren, die den Schlaf regulieren. Der dabei wichtigste Einzelfaktor ist Licht. 1998 wurde erstmals beschrieben,1 dass eine Untergruppe (etwa 1–3%) der auf der lichteinfallzugewandten Seite der Retina sitzenden retinalen Ganglienzellen nicht nur, wie andere retinale Ganglienzellen, visuelle Information aus Stäbchen und Zapfen verschalten und zum visuellen Kortex weiterleiten. Diese besonderen Zellen sind selbst lichtsensibel und sie projizieren nicht bzw. nur sehr eingeschränkt in den visuellen Kortex, sondern die von ihnen ausgehenden Nervenfasern zweigen an der Kreuzung der Sehnerven in den darüberliegenden suprachiasmatischen Nukleus (SCN)2 ab.
Der SCN regelt unter anderem die Sekretion des Hormons Melatonin in der Zirbeldrüse. Melatonin wird bei gesunden Menschen fast ausschliesslich nachts sezerniert. Die Melatoninausschüttung wird durch zwei Faktoren bestimmt: Relative Dunkelheit für etwa 90 Minuten gibt die Melatoninausschüttung frei. Zudem existiert ein auf etwa 24 Stunden getakteter Rhythmusgenerator im SCN, der Melatoninsekretion bewirkt. Durch die Kombination dieser beiden Signale steigt meist ab etwa 21 Uhr die Melatoninsekretion deutlich an.3
Gesunder Schlaf läuft in 4–5 Zyklen von etwa 90-minütiger Länge ab. Nach dem Einschlafen kommen wir zunächst in das Leichtschlafstadium N1, dann in das Stadium N2 (ebenfalls Leichtschlaf). Darauf folgt meist Tiefschlaf (N3). Danach gelangen wir über das Leichtschlafstadium N2 in die erste, meist noch kurze Phase des Rapid-Eye-Movement(REM)-Schlafs, in der wir zum ersten Mal episodisch träumen. Damit ist der erste Schlafzyklus abgeschlossen. In den nachfolgenden Schlafzyklen werden die Tiefschlafphasen sukzessiv kürzer und die REM-Phasen länger. Neben der zyklischen Natur des Schlafs zeigt sie häufige Aufwachvorgänge. Trotz erlebten Durchschlafens erwachen Erwachsene im Durchschnitt 25-mal pro Nacht, woran sich junge gesunde Personen nicht erinnern. Diese Wachphasen sind in der Regel unter einer Minute lang. Wir werden dabei nicht hellwach, sind aber leicht ansprechbar und reagieren auf Umweltreize. Warum ist uns das häufige Erwachen am nächsten Tag nicht bewusst?
Wahrscheinlich wird durch die schlafgebundene Gedächtnisbildung das Abspeichern neuer Inhalte im Langzeitgedächtnis unterbunden. Daher erinnern wir uns nicht an Träume, obwohl wir jede Nacht 4–5-mal träumen und in diesen Träumen meist intensive emotionale Erlebnisse haben. Auch das Vergessen der physiologischen, etwa 25 nächtlichen Wachphasen, deren evolutionsbiologischer Sinn wahrscheinlich der Schutz vor nachtaktiven Raubtieren ist, beruht auf diesem Mechanismus. Fester Schlaf ohne Erwachen mit dauerhaftem Tiefschlaf ist also ein Mythos, der zwar dem subjektiven Schlaferleben junger gesunder Personen entspricht, aber nicht der Realität. Leider richten sich unsere Ansprüche an den Schlaf oft nach diesem Mythos. Sobald dann z.B. zyklusabhängig, in Schwangerschaft und Stillzeit oder in der Menopause biologisch verursachter schlechterer Schlaf auftritt und nächtliche Wachphasen etwas länger dauern, werden diese bewusst und wir erleben das eigentlich normale nächtliche Erwachen als pathologisch. Dadurch geht die Gelassenheit gegenüber dem Schlaf verloren und es entwickelt sich eine ängstlich angespannte Haltung zum Schlaf, die häufig die Chronifizierung einer eigentlich passageren Schlafstörung verursacht.
Ein- und Durchschlaf- bzw. Wiedereinschlafstörungen und frühes Erwachen gehören zu den häufigsten Gesundheitsproblemen in industrialisierten Ländern. Jeder hat wohl schon schlechte Nächte erlebt. Von einer krankhaften Insomnie geht man aus, wenn drei oder mehr subjektiv schlechte Nächte pro Woche auftreten über einen Zeitraum von mindestens einem Monat und eine klare Beeinträchtigung des Tagesbefindens vorliegt. Einzelnen schlechten Nächten sollte dagegen möglichst keine grosse Bedeutung beigemessen werden, denn die kritische Selbstanalyse des eigenen Schlafs ist ein wichtiger schlafstörender Faktor. Anders sieht es bei dauerhaften Schlafstörungen aus. Sie erhöhen die Auftretenswahrscheinlichkeit vieler Erkrankungen von Adipositas über Diabetes bis hin zu Krebs, Demenz, Angststörungen und Depressionen und sind ein unabhängiger Risikofaktor für Suizidalität. Ausser im Säuglings- und Kleinkindalter sind Frauen häufiger von Insomnie betroffen als Männer. Dafür gibt es geschlechtsspezifische, also frauenheilkundlich bedeutsame Gründe.
Bereits im jüngeren Erwachsenenalter berichten Frauen mehr Ein- und Durchschlafprobleme als Männer.4 Prämenopausal zeigen sich zyklusbedingte Besonderheiten. In der postovulatorischen Lutealphase gehen hohe Östrogen- und Progesteronspiegel mit erhöhter EEG-Aktivität im Bereich von 12–16Hz einher. Diese sogenannten Schlafspindeln sind mit verbessertem Schlaferleben assoziiert. Bei fallenden Progesteronspiegeln ist die Spindelaktivität niedrig und der Schlaf oft subjektiv schlechter.5
Schlaf in der Schwangerschaft
Ein- und Durchschlafstörungen
In der Schwangerschaft zeigen Frauen ein geändertes Schlafverhalten. Durch die hohen Progesteronspiegel im ersten Trimenon sind die Schwangeren oft ständig müde, da Progesteron direkt auf gabaerge schlafauslösende Rezeptoren wirkt. Im späteren Verlauf der Gravidität wird es zunehmend schwieriger, eine bequeme Schlafposition zu finden. Kindsbewegungen, Uteruskontraktion und häufiger Harndrang halten die Schwangere wach.
Knapp die Hälfte aller Frauen berichtet schlechteren Schlaf in der Schwangerschaft.6 Während dies im letzten Trimester der Schwangerschaft auch durch Schlafmessungen objektivierbar ist, zeigen polysomnografische Messungen im ersten Trimester oft längeren und wahrscheinlich progesteroninduziert eher guten Schlaf mit mehr Tiefschlaf, obwohl der subjektive Schlaf bereits beeinträchtigt ist.7 Im Laufe der Schwangerschaft verkürzt sich der objektivierte Schlaf und besonders im letzten Trimester reduziert sich der REM-Anteil. Im Gegensatz dazu verlängert sich die berichtete Schlafdauer über die Schwangerschaftstrimester minimal, aber die Zufriedenheit mit dem Schlaf fällt über den Verlauf der Schwangerschaft deutlich ab.8 Ein wichtiger Risikofaktor für insomnische Beschwerden in der Schwangerschaft ist das Lebensalter. Ältere Schwangere berichten häufiger schlechteren Schlaf.9 Bei milden Schlafproblemen ist ausser Information und Beruhigung meist keine spezifische Intervention nötig. Stärkere Beschwerden mit Schlafdauern unter 6 Stunden sollten aber schlafmedizinisch abgeklärt werden. Sie gehen mit einem erhöhten Risiko für arterielle Hypertonie im 3. Trimester einher10 und steigern das Risiko für eine Sectio deutlich.11
Restless-Legs-Syndrom
Das Restless-Legs-Syndrom (RLS) ist eine sensorisch-motorische Erkrankung, die einhergeht mit:
-
besonders in Ruhesituationen Bewegungsdrang der Extremitäten mit Parästhesien wie Kribbeln, Schmerzen, Kälte- oder Hitzegefühl am häufigsten in den Waden;
-
vorübergehender Erleichterung durch Bewegung;
-
verstärktem Auftreten am Abend bzw. in der Nacht.12
Die Prävalenz für RLS liegt in der deutschen Bevölkerung bei 3–5%. RLS tritt bei Frauen doppelt so häufig auf wie bei Männern, in der Schwangerschaft ist die Prävalenz dieser Erkrankung mit 27–30% deutlich erhöht.13 Im 8. und 9. Schwangerschaftsmonat leidet jede 3. Schwangere an RLS. In fast allen Fällen geht RLS mit nächtlichen Extremitätenbewegungen einher. Dies sind meist unwillkürliche ein- oder beidseitige Bein-, Fuss- oder auch nur Zehenbewegungen, die rhythmisch etwa alle 15–40 Sekunden auftreten. Diesen teils vielen hunderten nächtlichen Bewegungen gehen kurze Aktivierungsreaktionen voraus, die oft, aber nicht immer den Schlaf stören. Bei diesen Bewegungen kommt es so regelhaft zu Herzfrequenzakzelerationen und Blutdruckanstiegen im Bereich von etwa 15mmHg,14 was bei der hohen Ereignisanzahl eine klinisch relevante kardiovaskuläre Belastung in der eigentlichen Ruhephase bedeutet.
Wie bei fast allen Erkrankungen gibt es eine genetische Disposition für das RLS-Risiko. Dies geht oft mit Störungen des Eisenstoffwechsels einher. Eisen ist als Kofaktor an der Synthese der Tyrosinhydroxylase beteiligt, durch die die Transformation von Tyrosin zu Dopamin ermöglicht wird. Durch Dopaminmangel im Rückenmark fehlt ein wichtiger hemmender Mechanismus, wodurch dann wahrscheinlich sowohl der Bewegungsdrang im Wachzustand als auch die nächtlichen Spontanbewegungen entstehen.15
In der Schwangerschaft kann erhöhter Eisenbedarf die Eisenspeicher leeren und so bei vulnerablen Frauen zu RLS führen. Ein schweres RLS bewirkt eine extreme Beeinträchtigung der Lebensqualität und kann den Schlaf sehr verschlechtern. Die häufigen nächtlichen Blutdruckschwankungen erschweren das Hypertonie-Management in der Schwangerschaft. RLS in der Schwangerschaft ist assoziiert mit einem erhöhten Risiko für Depressionen in und nach der Schwangerschaft, für Gestationsdiabetes und für Schwangerschaftshypertonie mit Präeklampsie.7 Zudem verschwindet zwar bei den meisten Betroffenen nach der Entbindung RLS zunächst, das Lebenszeitrisiko bleibt aber deutlich erhöht. Die RLS-Prävalenz von über 60-jährigen Nulliparen ist dagegen nicht höher als bei Männern16 – dies spricht dafür, dass eine Schwangerschaft das Lebenszeitrisiko für RLS deutlich erhöht.
Falls in der gynäkologischen Praxis die typischen RLS-Symptome berichtet werden, sollte bei Ferritinwerten unter 75µg/l eine orale Eisensubstitution eingeleitet werden. Wenn im zweiten und dritten Trimester Werte < 30µg/l beobachtet werden, sollten Eiseninfusionen in Erwägung gezogen werden.7 Eine darüber hinausgehende Behandlung sollte interdisziplinär in neurologischer Kooperation erfolgen und kann ab dem 2. Trimester z.B. mit Gabapentin oder Levodopa erfolgen, wobei die ansonsten oft gewählte Kombination von Levodopa mit Benserazid in der Schwangerschaft vermieden werden sollte, da Benserazid die Knochenbildung beeinträchtigen kann.
Schlafbezogene Atmungsstörungen
Durch östrogenbedingte Proliferation der Nasenschleimhaut sowie die physiologische Gewichtszunahme und die Beeinträchtigung der Zwerchfellmotilität während der Schwangerschaft steigt das Risiko für Atmungsstörungen im Schlaf. Dabei kommt es in der Inspiration zu Verengung oder Verschluss des weichen Pharynx mit konsekutiver intermittierender Hypoxie. Bevor für Mutter und Kind gefährliche Entsättigungen erreicht werden, kommt es meist zu Aktivierungsreaktionen, durch die der Verschluss der Atemwege aufgehoben wird. Dadurch wird aber der Erholungswert des Schlafs beeinträchtigt und es kann zu einem erhöhten Sympathikotonus kommen. Bei 2472 Schwangeren zeigte sich im 2. Trimester mit 8,3% eine erhöhte Prävalenz der obstruktiven Schlafapnoe.17 Bei vor der Schwangerschaft adipösen Frauen (BMI > 30) mit einem weiteren Risikofaktor (Diabetes, frühere Präeklampsie, Zwillingsschwangerschaft) zeigten 47% in der Spätschwangerschaft (>28. Woche) eine obstruktive Schlafapnoe.17 Das Vorliegen einer obstruktiven Schlafapnoe bei der werdenden Mutter geht mit schlechtem Schlaf, Tagesschläfrigkeit, erhöhtem Risiko für Schwangerschaftsdiabetes, Präeklampsie und einer erhöhten Sectiorate einher. Für das Kind ist sie assoziiert mit Frühgeburtlichkeit, niedrigerem Geburtsgewicht, häufigeren hypoxischen Hirnschädigungen, niedrigerem APGAR-Score und höherem Bedarf intensivmedizinisch-neonatologischer Betreuung.7,9
Hauptrisikofaktoren für obstruktive Atmungsstörungen in der Schwangerschaft sind Adipositas und Lebensalter. Wegen der eindeutigen negativen Konsequenzen einer unbehandelten Atmungsstörung sollte diese besonders bei adipösen Patientinnen in der frauenärztlichen Anamnese abgeklärt werden: Wenn Schnarchen berichtet wird und arterielle Hypertonie bekannt ist, müssen eine schlafmedizinische Abklärung und ggf. Behandlung der Schlafapnoe erfolgen.
Melatonin
Das oft als «Schlafhormon» bezeichnete Hormon Melatonin durchdringt sowohl die Blut-Hirn-Schranke als auch die Plazenta problemlos.18 Die Zirbeldrüse des Neugeborenen schüttet wahrscheinlich noch kein Melatonin aus, da die nervale Verbindung zwischen SCN und Zirbeldrüse über das periphere sympathische System noch nicht funktionell ist.20 Das in der Zirbeldrüse der Mutter vorwiegend nachts ausgeschüttete Melatonin ist für die bereits entwickelte innere Uhr des Ungeborenen das wahrscheinlich wichtigste Signal des Tag-Nacht-Rhythmus und erklärt die entsprechenden Schwankungen der Körpertemperatur und der Sauerstoffaufnahme des Fötus. Durch Dauerlichtexposition der Mutter werden diese fetalen Rhythmen aufgehoben und es kommt zu deutlichen Änderungen der Genexpression im SCN des Ungeborenen. Im Tierversuch verursachen Dauerlicht oder simulierte Schichtarbeitsbedingungen im letzten Trimester der Schwangerschaft im späteren Leben Adipositas, geänderte Insulin- und Glukosetoleranz sowie Verhaltensauffälligkeiten. In der Humanmedizin zeigt sich in industrialisierten Ländern eine enge Korrespondenz zwischen der Zunahme von Adipositas, metabolischem Syndrom, Autismus-Spektrum-Störungen sowie Aufmerksamkeitsdefizits-Störungen und dem Ausmass an nächtlicher Exposition mit hellem künstlichem Licht.21
Schwangere mit Präeklampsie haben niedrigere Melatoninspiegel in der Plazenta22 und niedrigere nächtliche Melatoningipfel23 als gesunde Kontrollen. Generell ist die Plazenta sehr hohem oxidativem Stress ausgesetzt, was wahrscheinlich ein Grund dafür ist, dass in der menschlichen Plazenta das Antioxidans Melatonin in erheblichen Mengen synthetisiert wird.24 In einer ersten Behandlungsstudie25 hat hoch dosiertes Melatonin bei Schwangeren mit Präeklampsie im Vergleich zu Kontrollen die Zeit bis zur Geburtseinleitung um sechs Tage verlängert und die Notwendigkeit antihypertensiver Therapie in der letzten Schwangerschaftswoche reduziert. Allerdings wurde in der Therapiegruppe ein niedrigeres Geburtsgewicht beobachtet.
Im ersten Trimester der Schwangerschaft steigen die nächtlichen Melatoninwerte an, was wahrscheinlich gemeinsam mit höheren Progesteronspiegeln den objektiv besseren Schlaf in dieser Phase erklärt. Als Antioxidans schützt es die stoffwechselaktive Plazenta und ist wahrscheinlich für die Organanlage und neuronale Entwicklung wichtig. Niedrige nächtliche Melatoninwerte der Mutter gehen z.B. mit einem erhöhten Risiko des Kindes für Autismus-Spektrum-Störungen einher.26 Im zweiten Trimester sinken die nächtlichen Melatoninwerte etwas ab, um dann im letzten Trimester wieder anzusteigen. Die höchsten Melatoninwerte werden kurz vor der Entbindung erreicht.23 Gemeinsam mit Oxytocin fördern hohe Melatoninspiegel die Kontraktibilität der Uterusmuskulatur. Der Geburtsprozess beginnt überzufällig häufig mit nächtlicher Wehentätigkeit,27, 28 also bei hohen Melatoninspiegeln. Bei Hochschwangeren (>38. Gestationswoche) reduziert Lichtexposition (10000 Lux) um 23 Uhr nächtliche Melatoninspiegel und die Wehentätigkeit.29
Melatonin beeinflusst den Schlaf der werdenden Mutter, hat grosse Bedeutung für die Funktion der Plazenta und die Organogenese des Ungeborenen, wirkt neuroprotektiv, unterstützt die Entwicklung der inneren Uhr des Ungeborenen und beeinflusst den Geburtszeitpunkt. In der Schwangerenberatung sollten also chronobiologische Aspekte und ein biologisch sinnvoller Umgang mit Kunstlicht berücksichtigt werden.
Bei milden Schlafproblemen ist ausser Information und Beruhigung meist keine spezifische Intervention nötig. In der Behandlung ist hier das wichtigste Ziel, die akute Fokussierung auf den Schlaf aufzubrechen. Dies ist durch die kognitiv-behaviorale verhaltensmedizinische Behandlung leistbar, die Effektivität dieser Behandlungsansätze ist belegt.30 Im Rahmen der verhaltensmedizinischen Beratung wird u.a. vermittelt, dass man in der nächtlichen Ruhephase nicht schlafen MUSS. Hierzu ist es hilfreich, Fehlerwartungen an den Schlaf zu korrigieren. So erleben junge gesunde Menschen zwar Durchschlafen, in Wirklichkeit wachen sie aber pro Nacht etwa 25-mal auf, können sich aber nicht daran erinnern.31 Das Wissen um die Normalität nächtlichen Erwachens, welches ältere Menschen eher bewusst erleben, wirkt oft sehr erleichternd, da das Aufwachen nicht mehr als Versagen erlebt wird.
Da mit einer Schlafdauer von unter 6 Stunden viele medizinische Risiken verbunden sind, sollten solche Beschwerden schlafmedizinisch abgeklärt und behandelt werden.32 Gemäss der europäischen Leitlinie zur Behandlung der Insomnie sollte als Erstlinienbehandlung der Insomnie eine kognitive Verhaltenstherapie für Insomnie (KVT-I) durchgeführt werden. Die Zugänglichkeit dieser auch in der Schwangerschaft effektiven Behandlungsmethode ist zumindest in Deutschland durch digitale Gesundheitsanwendungen wesentlich gebessert worden, ohne dass die Effektivität im Vergleich zur «Face-to-face»-Therapie schlechter wäre.
Schlaf in der Menopause
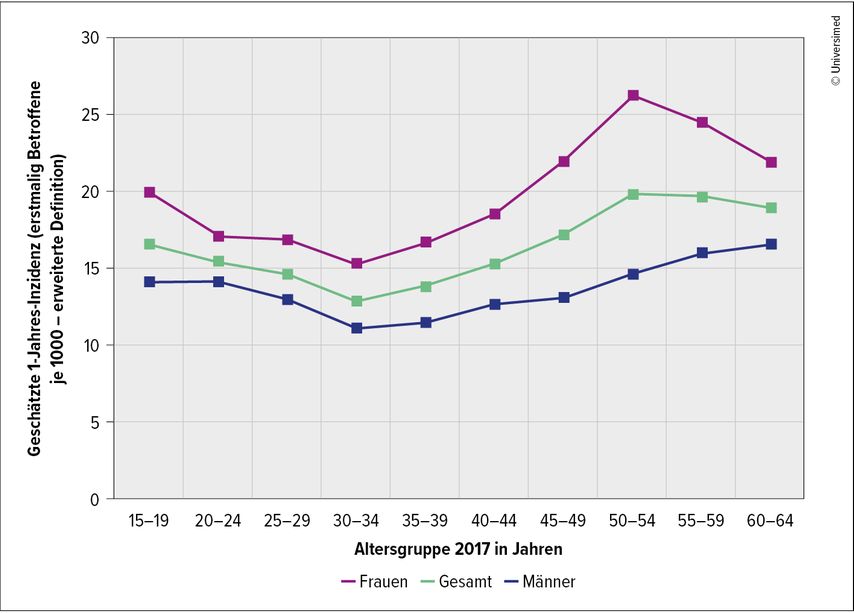
Der generell etwas schlechtere Schlaf von Frauen wird peri- und postmenopausal durch die dramatischen hormonellen Veränderungen in der Menopause noch häufiger, sodass aus dieser Gruppe 40–60% schlechten Schlaf berichten.4 Eine chronische Insomnie erleben 26%.33 Gemäss objektiver Daten (Barmer Gesundheitsreport 2019)kommt es in dieser Lebensphase zwischen dem 45. und 60. Lebensjahr zur höchsten Inzidenz von insomnischen Beschwerden (Abb. 1).
Abb. 1: Geschätzte Inzidenz von Ein- und Durchschlafstörungen bei Erwerbspersonen 2017 nach Alter und Geschlecht (Ausschluss von vorausgehend Betroffenen über zwölf Jahre), modifiziert nach Barmer Gesundheitsreport 2019
In dieser hormonellen Umstellungsphase wird bei Frauen zusätzlich die innere Uhr besonders schnell verstellt. Die Perimenopause geht mit einer zusätzlichen, etwa einstündigen Verstellung der inneren Uhr einher, da sich der nächtliche Melatoninanstieg im Gegensatz zur Pubertät nun nach vorn in Richtung Morgentyp verlagert.34 Zudem reduzieren sich in dieser Zeit die nächtlichen Melatoninspiegel recht deutlich, sodass eine kausale Rolle des Melatoninabfalls für den Eintritt der Menopause diskutiert wird.35
Neben den Änderungen der inneren Uhr und der reduzierten Melatoninproduktion führen in dieser Lebensphase der Frauen vasomotorische Symptome wie Hitzewallungen und Nachtschweiss, die bei 60–80% der Frauen vorkommen, zu schlechterem Schlaf.36 Bedingt durch Östrogenmangel wird die thermoneutrale Zone schmaler. Wie wir inzwischen wissen, erfolgt die Kommunikation in den thermoregulatorischen Zentren des Nucleus praeopticus medialis über die östrogensensitiven KNDy-Neurone, Kisspeptin, Neurokin B und Dynorphin. Bedingt durch den menopausalen Östrogenmangel kommt es zu einer Hypertrophie und Mengenzunahme der KNDy-Neurone und einer verstärkten Freisetzung von Neurokin B, das über eine Kopplung an den NK3-Rezeptor an die Neuronen der thermoregulatorischen Zentren diese aktiviert. Die thermoneutrale Zone wird schmaler und es kommt leichter zur Hitzewallung.37 Sie zeigen die engste Korrespondenz zur erlebten Schlafqualität. Besonders wenn sie lang andauernd sind38 und in der ersten Nachthälfte auftreten,39 führen sie zu subjektiv schlechtem Schlaf. Der physiologische Schlafbeginn und der Übergang in tiefere Schlafphasen sind neben dem steilen Anstieg der Melatoninproduktion durch einen deutlichen Abfall der Körperkerntemperatur charakterisiert. Dieser wird durch periphere Vasodilatation mit Wärmeverlust über die Körperoberfläche bewirkt.40 Bei postmenopausalen Frauen ist der abendliche Abfall der Körperkerntemperatur im Rahmen der vasomotorischen Veränderungen durch Östrogenmangel deutlich abgeschwächt.34
Zudem sinken sowohl Östrogen- als auch Progesteronspiegel mit der Menopause dauerhaft. Vereinfacht wird somit die oft zu beobachtende kurze zyklusbedingte Phase schlechten Schlafs der jungen Frau zum Dauerzustand. Niedrige Progesteronspiegel machen den Schlaf leichter störbar.41
Folgen des schlechten Schlafs sind Müdigkeit am Tag mit erhöhtem Unfallrisiko, Aufmerksamkeits- und Gedächtnisprobleme mit nachfolgender Abnahme der Leistungsfähigkeit. Mit sinkender Schlafqualität steigt das Risiko für kardiovaskuläre Erkrankungen, Adipositas, Insulinresistenz und Diabetes. Dauerhaft schlechter Schlaf erhöht das Risiko für psychische Erkrankungen wie z.B. Depression, Angststörung, Psychosen und Suchterkrankungen.42 85% der Menschen mit Depression schlafen schlecht. Im Langzeitmassstab ist schlechter Schlaf ein unabhängiger Risikofaktor für Depression und Suizidalität.43
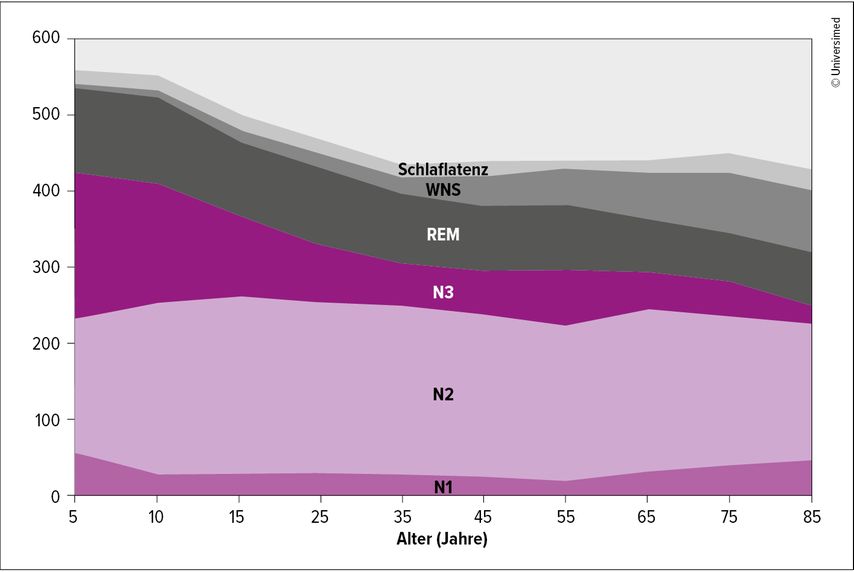
Diese Vorverlagerung des Chronotyps vereinfacht zwar das erste Einschlafen, führt aber dazu, dass der Schlaf in der zweiten Hälfte der Ruhephase oft verschlechtert ist. Ausserdem steht weniger Melatonin als Schlafstabilisierer zur Verfügung. Im Ergebnis schlafen ältere Menschen weiterhin gut ein, aber das Wiedereinschlafen nach nächtlichem Erwachen ist erschwert. Daher steigt die Wachheit nach dem Schlafbeginn («wake after sleep onset», WASO) im Alter deutlich an. Zudem nimmt der Tiefschlafanteil beim älteren Menschen ab (Abb. 2).44
Abb. 2: Veränderungen des Schlafs über das Lebensalter für die Einschlaflatenz (Schlaflatenz), Wachheit nach Schlafbeginn (WNS), REM-Schlaf (REM), Tiefschlaf (N3) und Leichtschlaf (N2 und N1) in Minuten (modifiziert nach Ohayon MM et al.)43
Altersbedingter Melatoninmangel, vasomotorische Symptome, Progesteron- und Östrogenmangel sowie die Vorverlagerung der inneren Uhr können also den besonders durch Durchschlafprobleme charakterisierten schlechten Schlaf der menopausalen Frau erklären, bieten aber auch Ansatzpunkte zu therapeutischen Interventionen. Diese sollten und müssen wir nutzen. Längsschnittstudien zeigen eine Verdoppelung der Prävalenz von Depressionen mit der Menopause.45–47 Noch vor Hitzewallungen haben Schlafprobleme den grössten kurzfristigen Einfluss auf Stimmung und Lebensqualität.48 Im Langzeitmassstab ist schlechter Schlaf ein unabhängiger Risikofaktor für Depression und Suizidalität.49 In der NESARC-III-Studie mit 34714 Probanden konnte gezeigt werden, dass die Insomnie den grössten Verlust qualitätsadjustierter Lebensjahre unter allen untersuchten Erkrankungen bewirkt.
Die kognitive Verhaltenstherapie bei Insomnie, Hormonersatztherapie, Melatonineinnahme und chronobiologisch-verhaltensmedizinische Interventionen sind Erfolg versprechende Therapieoptionen. Seit 2024 ist der NK3-Rezeptor-Antagonist Fezolinetant als erfolgreiche Therapiealternative zur Behandlung vasomorischer Beschwerden hinzugekommen. Für 2025 wird die Zulassung eines kombinierten NK1- und NK3-Rezeptorblockers zur Behandlung von Hitzewallungen und Schlafstörungen erwartet. Der oft deutlich verschlechterte postmenopausale Schlaf sollte wegen der klaren Effekte auf Stimmung und Lebensqualität also nicht als naturgegeben hingenommen werden. Die Wechseljahre verschlechtern den Schlaf, aber wir können inzwischen vielen betroffenen Frauen helfen und deren Lebensqualität deutlich verbessern. Zudem können wir so dazu beitragen, dass im beruflichen Bereich die Leistungsfähigkeit dieser Gruppe von berufserfahrenen und oft hochqualifizierten Frauen der Gesellschaft weiter zur Verfügung steht.
Ein weitergehender Überblick zu Schlaf und Wechseljahren findet sich in unserer Arbeit von 2019.50
Literatur:
1 Provencio I et al.: Proc Natl Acad Sci U S A 1998; 95(1): 340-345 2 Mohawk JA, Takahashi JS: Trends Neurosci 2011; 34(7): 349-358 3 Stahl SM, Muntner N: Stahl’s essential psychopharmacology. Neuroscientific basis and practical application, 4. Aufl. Cambridge Medicine 2013. Cambridge University Press, Cambridge 4 Zhang B, Wing Y-K: Sleep 2006; 29(1): 85-93 5 Baker FC et al.: Sleep 2007; 30(10): 1283-1291 6 Sedov ID et al.: Sleep quality during pregnancy: A meta-analysis. In: Slee Med Rev 2018; 38: 168-176 7 Bazalakova M: Semin Neurol 2017; 37(6): 661-668 8 Richter D et al.: Sleep 2019; 42(4): zsz015 9 Silvestri Rosalia, Aricò I: Sleep Sci 2019; 12(3): 232-239 10 Williams M et al.: Sleep 2010; 33 (10): 1363-1371 11 Lee Kathryn A et al.: Am J of Obstet Gynecol 2004; 191(6): 2041-2046 12 The international classification of sleep disorders (2014). Third edition. Darien [Illinois]: American Academy of Sleep Medicine 13 Manconi M et al.: Sleep Med Rev 2012; 16(4): 297-307 14 Cassel W et al.: Sleep Med 2016; 17: 109-120 15 Clemens S et al.: Neurology 2006; 67(1): 125-130 16 Cesnik E et al.: Neurology 2010; 75(23): 2117-2120 17 Facco FL et al.: Obstet Gynecol 2017; 129(1): 31-41 18 Facco FL et al.: Am J Perinatol 2014; 31 (10): 899-904 19 Okatani Y et al.: J Pineal Res 1998; 25(3): 129-134 20 Reiter RJ: Endoc Rev 1991; 12(2): 151-180 21 Hardeland R et al.: J Pineal Res 2012; 52(2): 139-166 22 Lanoix D et al.: J Pineal Res 2012; 53(4): 417-425 23 Nakamura Y et al.: J Pineal Res 2001; 30(1): 29-33 24 McCarthy R et al.: Front Endocrinol (Lausanne) 2019; 10: 616 25 Hobson SR et al.: J Pineal Res 2018; 65(3) 26 Braam W et al.: Res Dev Disabil 2018; 82: 79-89 27 Lindow SW et al.: BJOG 2000; 107(9): 1145-1148 28 Cagnacci A et al.: American J Obstet Gyn 1998; 178(1): 140-145 29 Olcese J et al.: Reprod Sci 2013; 20(2): 168-174 30 Trauer JM et al.: Ann Intern Med 2015; 163(3): 191-204 31 Bassetti CL et al.: ESRS European sleep medicine textbook. 2014. European Sleep Research Society, Regensburg 32 Williams MA et al.: Sleep 2010; 33 (10): 1363-1371 33 Caruso D et al.: Maturitas 2019; 123: 78-81 34 Gómez-Santos C: Menopause 2016; 23(6): 682-690 35 Gursoy AY et al.: Climacteric 2015; 18(6): 790-796 36 Joffe H et al.: Menopause 2013; 20(9): 905-914 37 Davis SR, Baber RJ: Nat Rev Endocrinol 2022; 18(8): 490-502 38 Savard MH et al.: Menopause 2013; 20(10): 997-1005 39 Freedman RR, Roehrs TA: Menopause 2007; 14(5): 826-829 40 van Someren EJW: In: Kalsbeek A (Hrsg.): Hypothalamic integration of energy metabolism, Bd 153. Elsevier, Amsterdam 2006; 309-324 41 Caufriez A et al.: J Clin Endocrinol Metab 2011; 96(4): E614-23 42 Riemann D et al.: S3-Leitlinie Nicht erholsamer Schlaf/Schlafstörungen. Kapitel Insomnie bei Erwachsenen (AWMF Registriernummer 063-003), Update 2016. Somnologie 2017; 20(Suppl s2): S97-S180 43 Bjørngaard JH et al.: Sleep 2011; 34(9): 1155-1159 44 Ohayon MM et al.: Sleep 2004; 27(7): 1255-1273 45 Freeman EW: JAMA Psychiatry 2014 71(1): 36-43 46 Cohen LS et al.: Arch Gen Psychiatry 63(4): 385-390 47 Bromberger JT et al.: Psychol Med 2011; 41(9): 1879-1888 48 Burleson MH et al.: Menopause 2010; 17(1): 87-95 49 Bjørngaard JH et al.: Sleep 2011; 34(9):1155–1159 50 Cassel W, Cassel P: Gynäkologe 2021; 54:783-790
Das könnte Sie auch interessieren:
ERAS: Was wissen und machen wir in Österreich?
Im September 2024 fand in der Nähe von Málaga in Spanien der 10. Weltkongress der Internationalen Gesellschaft für „Enhanced Recovery After Surgery“ (ERAS) statt. Im Rahmen des ...
Morbus Paget der Vulva
Nach Definition der WHO stellt der Morbus Paget der Vulva eine intraepitheliale Neoplasie und obligate Präkanzerose dar, die von pluripotenten Stammzellen der interfollikulären Epidermis ...
„Eine Kombination könnte eine personalisierte und prädiktive Medizin ermöglichen“
Wir müssen uns eingestehen, dass auch in der heutigen Medizin manche Vorgehensweisen als unmodern und geradezu primitiv anzusehen sind. Dies gilt auch für Vorsorge und Früherkennung von ...