L’implantation de valves aortiques par voie transcathéter (TAVI) pour tous?
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La sténose de la valve aortique est, en Europe et en Amérique du Nord, la valvulopathie cardiaque la plus fréquente, avec une prévalence croissante à mesure que la population vieillit. Tout comme Andreas Grüntzig pratiqua la première dilatation par ballonnet d’un vaisseau coronaire à l’Hôpital universitaire de Zurich, Alain Cribier a fait entrer la cardiologie interventionnelle dans une nouvelle ère avec la première implantation d’une valve aortique par voie transcathéter (TAVI) en 2002. Initialement considéré uniquement comme une alternative pour les patients qui ne pouvaient pas être opérés ou ne le pouvaient qu’au prix d’un haut risque, ce traitement s’est, depuis son autorisation CE en 2007, de plus en plus substitué à la chirurgie de remplacement de la valve aortique, jusqu’alors considérée comme le traitement standard.
Keypoints
-
Le TAVI représente une alternative sûre au remplacement chirurgical biologique de la valve aortique avec une mortalité et un taux d’AVC comparables ou inférieurs selon la classe de risque.
-
La durabilité des bioprothèses aortiques transcathéters et chirurgicales est comparable.
-
Selon les études actuelles, un posttraitement à l’aspirine est suffisant. Chez les patients ayant une indication d’anticoagulation, aucune administration supplémentaire d’inhibiteurs de l’agrégation plaquettaire n’est nécessaire.
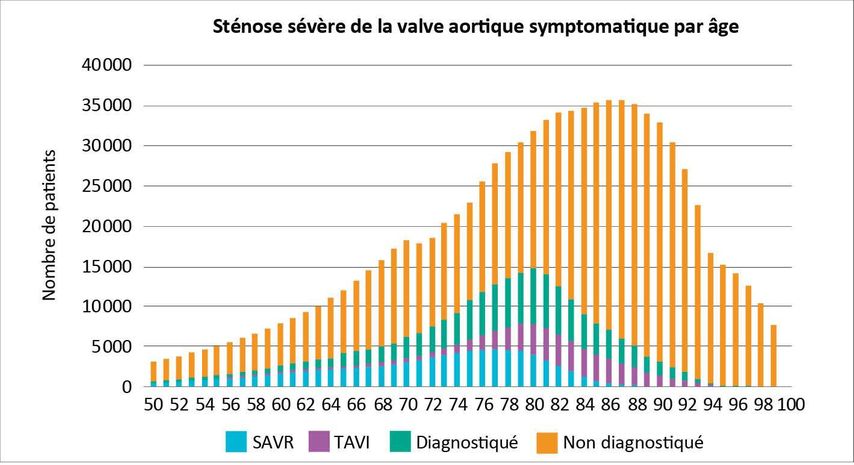
Seuls quelques traitements ont été contrôlés par des études randomisées à grande échelle de la même manière que le TAVI. Dans l’ensemble, ce nouveau traitement s’est avéré au moins équivalent ou supérieur à la procédure chirurgicale. Le développement constant des systèmes TAVI, l’amélioration des techniques chirurgicales et la normalisation du traitement ont fait du TAVI une alternative efficace et sûre à la chirurgie de remplacement de la valve aortique pour la plupart des patients aujourd’hui, bien qu’une forte part des sténoses aortiques ne soit toujours pas diagnostiquée (Fig. 1).
Fig. 1: Estimation du nombre de patients dans l’Union européenne présentant une sténose sévère de la valve aortique diagnostiquée et non diagnostiquée qui ont subi un remplacement valvulaire aortique chirurgical (SAVR) ou par voie transcathéter (TAVI). Répartition par âge (adapté d’après et avec l’aimable autorisation de: Thoenes et al.: J Thorac Dis 2018; 10: 5584-94 doi: 10.21037/jtd.2018.09.02 [CC BY-NC-ND 4.0 International Licence])
La «révolution du TAVI»: aperçu des études
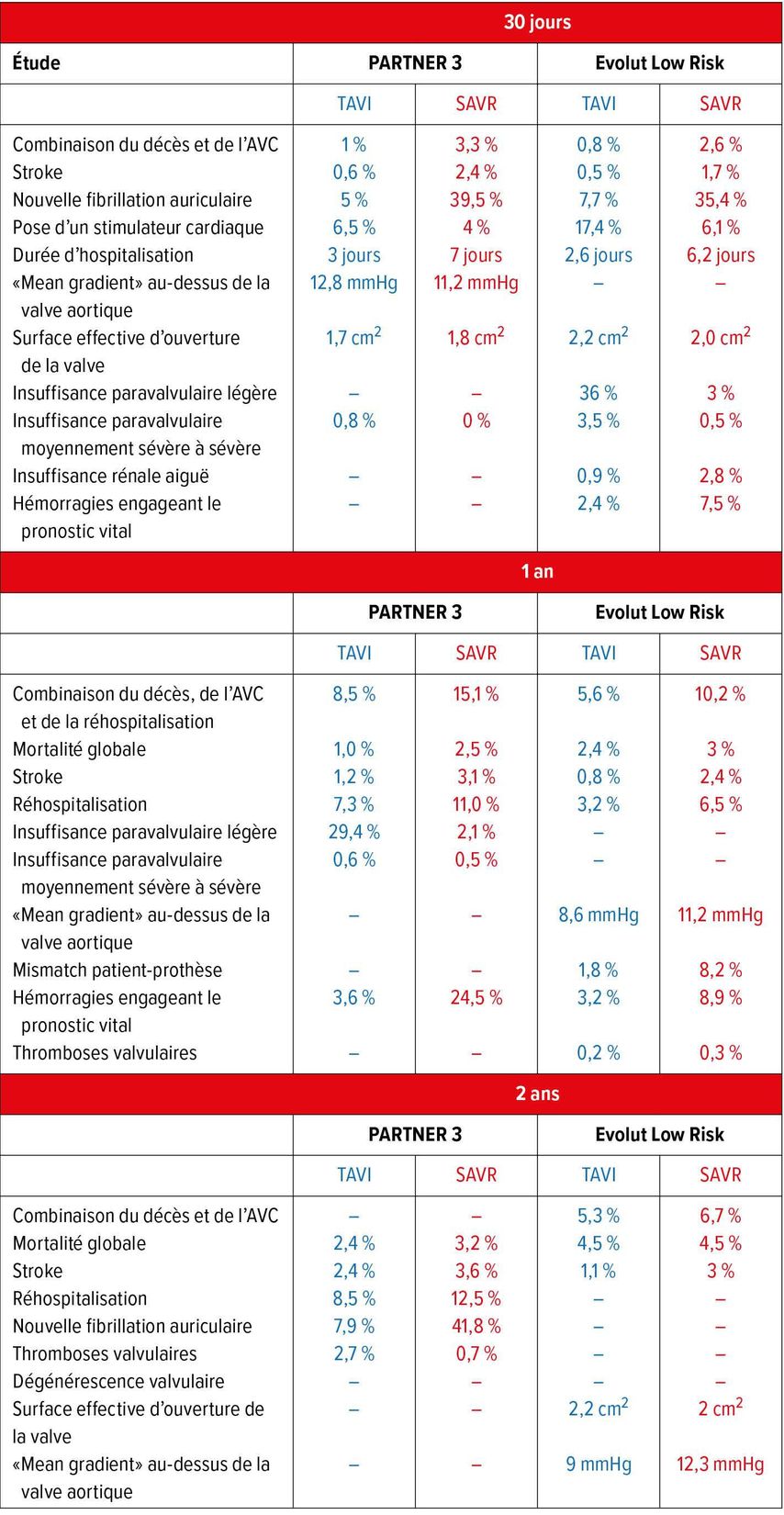
Il y a dix ans, les résultats de la première étude PARTNER (1B)1 ont démontré de façon impressionnante la supériorité du TAVI avec la valve expansible par ballonnet SAPIEN par rapport au traitement médicamenteux conservateur chez les patients inopérables. Cette étude a été suivie, un an plus tard, par la publication de l’étude PARTNER 1A,2 qui a démontré l’équivalence du TAVI au traitement chirurgical chez les patients à haut risque chirurgical. Les mêmes résultats ont été obtenus pour le groupe de patients à risque moyen, le TAVI étant plus performant lorsqu’une voie d’accès transfémorale a été choisie3 ou lorsque la dernière génération de valves SAPIEN 3 a été mise en œuvre.4 Une non-infériorité a également été démontrée pour la valve CoreValve auto-expansible dans l’étude sur les patients à haut risque CoreValve5 et l’étude SURTAVI6. Comme il fallait s’y attendre, les études ont également produit des résultats positifs chez les patients présentant un faible risque chirurgical: l’étude PARTNER 37 a fait ressortir une supériorité pour la valve SAPIEN 3 et l’étude Evolut-Low-Risk8 resp. l’étude scandinave NOTION9 tout au moins une non-infériorité par rapport à l’alternative chirurgicale (Tab. 1). L’année dernière, les deux systèmes ont été autorisés en Amérique (FDA) et en Europe (CE) pour le traitement des patients à faible risque.
À l’heure actuelle, des études sont en cours pour répondre à différentes questions en suspens: l’étude REBOOT-PARADOX vise à déterminer si le TAVI présente un avantage par rapport à une pharmacothérapie chez les patients présentant une sténose de la valve aortique à bas débit/bas gradient. L’étude EARLY-TAVR cherche à savoir si un TAVI est approprié chez les patients asymptomatiques présentant une sténose de la valve aortique de haut grade. L’étude TAVR-UNLOAD vise à déterminer si les patients présentant une sténose de la valve aortique de grade moyen (surface d’ouverture de la valve >1,0 et ≤1,5cm2) et une insuffisance cardiaque préexistante avec fonction de pompage du ventricule gauche (VG) réduite et suite à décompensation cardiaque profitent d’un TAVI.
Durabilité des valves cardiaques transcathéters
Bien que la longue durée de vie des valves cardiaques mécaniques soit un avantage, les jeunes patients sont également demandeurs de l’implantation d’une valve aortique biologique, dont la durée de vie est généralement plus courte. La raison de ce phénomène: la nécessité d’une anticoagulation et les restrictions associées dans la vie quotidienne des patients après l’insertion d’une valve cardiaque mécanique. Ces dernières années, des valves aortiques biologiques ont été implantées, par chirurgie, chez un nombre croissant de jeunes patients. Un argument en faveur de cette stratégie est qu’en cas de dégénérescence de la bioprothèse, un TAVI peut, dans la plupart des cas, aisément être réalisé lors d’une seconde intervention, à titre d’alternative à une réopération. La durée de vie des valves cardiaques chirurgicales biologiques est comprise entre 5 et 20 ans, selon le type de valve et le fabricant,10 des données de registre11 font cependant état d’une durée de vie médiane de seulement 8 ans. Les grandes études randomisées sur le TAVI menées à ce jour ont une période de suivi de 5 ans, et mettent en évidence une très bonne durée de vie des valves aortiques transcathéters avec des paramètres hémodynamiques comparativement plus favorables.12, 13 L’incidence d’un dysfonctionnement structurel des valves bioprothétiques avec la valve SAPIEN 3 expansible par ballonnet était faible dans le suivi sur 10 ans, ce dont il résulte que ces nouvelles valves cardiaques transcathéters peuvent durer aussi longtemps que les valves chirurgicales.14 Également pour la valve CoreValve auto-expansible, l’étude NOTION a démontré une incidence significativement plus faible de la dégénérescence valvulaire structurelle chez des patients plutôt jeunes et à faible risque après 6 ans, par rapport aux valves aortiques biologiques implantées par voie chirurgicale.15 À l’avenir, davantage de données à long terme sur la durabilité des prothèses seront disponibles, étant donné que la plupart des grandes études actuelles ont des périodes de suivi allant jusqu’à 10 ans.
Tab. 1: Comparaison des résultats à 30 jours de l’implantation d’une valve aortique par voie transcathéter (TAVI) par rapport au remplacement chirurgical de la valve aortique (SAVR) chez les patients à faible risque chirurgical dans les études randomisées PARTNER 37 et Evolut Low Risk8
Défis actuels et futurs
Valves aortiques bicuspides
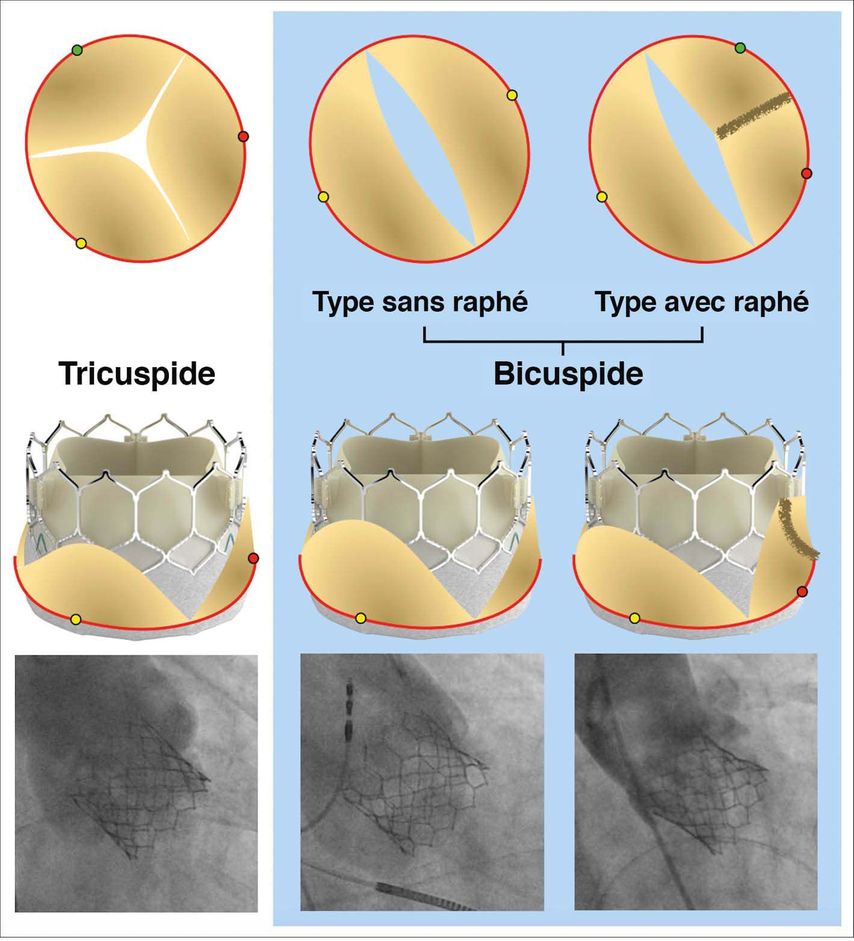
Avec une prévalence de 0,5 à 2%, la valve aortique bicuspide est la malformation cardiaque congénitale la plus courante, le sexe masculin étant 3 à 4 fois plus souvent touché. La valve peut être constituée de deux poches uniquement (type sans raphé) ou deux des trois poches sont agglomérées (type raphé) (Fig. 2). Au sein de cette population, les sténoses sévères de la valve aortique sont plus fréquentes et surviennent plus tôt. En raison de l’anatomie différente des valves aortiques bicuspides, qui présentent des calcifications asymétriques et plus marquées, en particulier dans le type sans raphé, des risques supplémentaires sont à prévoir en cas de TAVI. Ruptures de l’annulus, AVC, insuffisances paravalvulaires et taux de stimulateurs sont plus fréquents selon le type de valve transcathéter utilisé.
Les études concernant le TAVI en cas de valves bicuspides sont limitées, d’autant plus que ces dernières ont été exclues des grandes études randomisées. Toutefois, une analyse rétrospective du registre nord-américain de la Society of Thoracic Surgeons (STS) affiche des résultats comparables pour le traitement par TAVI des valves bicuspides et tricuspides, à l’exception d’un taux d’AVC et d’un taux de conversion au remplacement de la valve à cœur ouvert légèrement plus élevés.16 Ceci correspond à nos propres expériences, notamment lors de l’utilisation de valves aortiques transcathéters de dernière génération. Les résultats de registres potentiels, tels que les registres Bivolut-X et Bicuspid-TAVR, sont attendus dans un avenir proche.
Fig. 2: Exemples de TAVI dans les valves aortiques bicuspides par rapport aux valves aortiques tricuspides. Des résultats comparables peuvent être obtenus avec les nouvelles générations de valves transcathéters, ici SAPIEN 3 Ultra, dans les deux variantes anatomiques
Le TAVI valve-in-valve
Le TAVI valve-in-valve s’est imposé comme une alternative à faible risque pour le traitement des bioprothèses chirurgicales dégénérées, d’autant plus qu’il permet d’éviter une réopération souvent difficile sur le plan technique et associée à un taux de complications plus élevé. Cependant, en particulier dans le traitement des petites bioprothèses chirurgicales (<21mm de diamètre nominal), un risque d’inadéquation entre le patient et la prothèse avec gradient résiduel accru existe. Dans cette situation, le choix d’un système de valve supra-annulaire (p.ex. Medtronic CoreValve™ ou Evolut™) peut présenter des avantages. À titre d’alternative, afin de pouvoir implanter de valves transcathéters plus grandes, le «valve cracking» avec ouverture du cadre en plastique de la plupart des valves chirurgicales par un ballonnet à haute pression s’est imposé. Cette technique est utilisée de préférence avec les systèmes intra-annulaires expansibles par ballonnet (Edwards SAPIEN).
Un autre problème est le risque d’occlusion coronaire, avec un risque particulier pour les patients dont la racine aortique est très étroite et qui ont été traités avec des prothèses chirurgicales spéciales (p.ex. Sorin Mitroflow ou St. Jude Triflecta™). Dans ces cas, il est possible d’utiliser une procédure BASILICA pour fendre les voiles des valves chirurgicales par intervention et assurer ainsi la circulation du sang dans les artères coronaires.
Une étude rétrospective multicentrique américaine publiée récemment a montré que les patients présentant un risque opératoire élevé et une dégénérescence de la valve aortique bioprothétique qui avaient reçu un TAVI valve-in-valve présentaient à la fois une mortalité et une morbidité plus faibles ainsi que moins de complications hémorragiques et des séjours hospitaliers plus courts après 30 jours que les patients qui avaient subi une nouvelle opération.17
Fig. 3: Accès coronaire après TAVI. A–D: circulation sanguine diastolique et possibilité d’accès coronaire avec (A) valve aortique transcathéter intra-annulaire avec possibilité d’accès au-dessus et à travers les mailles de l’endoprothèse et (B) valve aortique transcathéter supra-annulaire avec possibilité d’accès à travers les mailles de l’endoprothèse uniquement. Possibilité d’accès coronaire après TAVI dans TAVI avec (C) valve aortique transcathéter intra-annulaire avec possibilité d’accès au-dessus du cadre de l’endoprothèse et (D) valve transcathéter supra-annulaire avec accès coronaire limité. E–F: accès coronaire en fonction de l’alignement «anatomique» de la valve (alignement commissural). (E) Alignement optimal de la valve avec valve aortique chirurgicale, (F) alignement non optimal de la valve avec accès coronaire problématique, en particulier dans les systèmes de valves supra-annulairesLVOT: «left ventricular outflow track»; THV: «transcatheter heart valve»
TAVI et coronaropathies/TAVI dans TAVI
Un aspect qui gagne en importance consiste dans la sécurité de l’accès coronaire après TAVI, étant donné que de plus en plus de jeunes patients présentant un faible risque opératoire et une longue espérance de vie sont traités. Chez ces patients en particulier, au fil du temps, une nouvelle coronaropathie peut se développer ou une maladie préexistante peut progresser, de sorte que des interventions coronariennes ultérieures peuvent devenir nécessaires. Une distinction fondamentale est à faire entre systèmes de TAVI supra-annulaires et intra-annulaires. Alors que dans les prothèses intra-annulaires, la valve implantée est placée au niveau de la valve aortique naturelle et que l’accès aux artères coronaires, dont le point de départ se situe généralement au-dessus, est généralement possible sans problème, dans les systèmes supra-annulaires, la valve implantée est située au niveau des sorties coronaires. Cela peut poser un problème notamment lorsque les commissures de la valve implantée ne correspondent pas à la valve naturelle (alignement commissural, Fig. 3 E–F). Sur les systèmes actuellement autorisés, l’alignement commissural est purement aléatoire et l’accès coronaire est donc souvent difficile, voire impossible. Il faut espérer que dans les systèmes futurs, un alignement exact des valves transcathéters sera possible.
En outre, chez les patients jeunes, il faut s’attendre à ce que la valve transcathéter implantée dégénère au fil du temps et qu’une deuxième intervention (TAVI dans TAVI) soit éventuellement nécessaire. Alors qu’un TAVI dans TAVI dans les systèmes intra-annulaires ne pose généralement aucun problème en ce qui concerne l’accès coronaire ultérieur, celui-ci est souvent impossible dans les systèmes supra-annulaires (Fig. 3 A–D). Un autre point à prendre en compte est le calendrier des interventions en cas de coronaropathie préexistante à titre supplémentaire. Les sténoses coronaires pertinentes préexistantes peuvent augmenter le risque d’ischémie et donc d’instabilité hémodynamique. Inversement, une sténose aortique sévère peut augmenter le risque de complications sévères au cours d’une intervention coronarienne (ICP). Des données rétrospectives suggèrent que les patients ayant un score Syntax inférieur à 8 présentent un risque plus faible de complications hémodynamiques pendant le TAVI.18 Une étude multicentrique internationale initiée par notre équipe, l’étude TAVI-PCI, vise à préciser le timing optimal des deux interventions chez les patients présentant une sténose de haut grade de la valve aortique et une coronaropathie significative.
Voies d’accès
L’accès transfémoral s’est imposé comme voie d’accès standard pour la plupart des patients, d’autant plus que dans le sillage du développement technique des systèmes de cathéters, les gaines d’accès sont devenues nettement plus fines. Actuellement, la plupart des valves transcathéters peuvent être implantées au moyen de gaines de 14–18French, selon le fabricant, ce qui signifie à travers les artères du bassin de 5,5 à 6,5mm. Dans les centres expérimentés, environ 95% des patients peuvent être traités en toute sécurité par un accès transfémoral. Les grandes études randomisées sur le TAVI ont démontré que l’accès transfémoral, en particulier, présente des avantages par rapport aux approches transapicales et autres. L’accès transaxillaire et l’accès par l’artère carotide se sont imposés comme une alternative dans de nombreux centres. Ces dernières années, la voie d’accès transcave s’est également imposée comme une alternative dans de nombreuses cliniques nord-américaines et dans un petit nombre de centres en Europe.19 Cette année, le premier patient à haut risque a été traité avec succès grâce à cette nouvelle voie d’accès à l’Hôpital universitaire de Zurich.
Systèmes de protection cérébrale
La signification clinique des systèmes de protection cérébrale pour la prévention d’un AVC au cours d’un TAVI demeure peu claire à l’heure actuelle. En outre, une partie des AVC ne se produit pas immédiatement pendant la procédure de TAVI, mais des semaines ou des mois plus tard. Le perfectionnement technique vertigineux et l’expertise croissante rendent les procédures TAVI de plus en plus sûres, et le taux d’AVC est également nettement inférieur pour les nouvelles générations de valves. Cependant, un nombre croissant de jeunes patients chez lesquels il convient d’éviter à tout prix des lésions cérébrales durables sont traités. Des études utilisant l’imagerie par résonance magnétique cérébrale montrent que, selon le type de valve, jusqu’à 100% de tous les patients après un TAVI présentaient des lésions cérébrales, même si, dans la plupart des cas, celles-ci n’étaient pas accompagnées de symptômes cliniques.20 Divers systèmes de protection sont actuellement disponibles pour prévenir les événements emboliques. Une distinction fondamentale est faite entre les systèmes de filtres et de déflecteurs, qui sont placés dans les artères cérébrales ou dans l’arc aortique et peuvent filtrer le matériel embolique ou le faire passer à côté des artères cérébrales. Il convient de noter que l’utilisation de ces systèmes est une mesure invasive supplémentaire qui comporte ses propres risques de complications et que l’intervention est par conséquent considérablement prolongée. Dans notre pratique, l’utilisation des systèmes de protection dépend du risque potentiel (p.ex. valves bicuspides, interventions complexes), de l’âge des patients et du système de valves utilisé.
Posttraitement
La prévention des événements cérébrovasculaires est la principale indication de traitement antithrombotique après un TAVI. Les lignes directrices européennes actuelles 2017 recommandent, après un TAVI, en l’absence d’une autre indication d’anticoagulation orale (degré de recommandation IIa, niveau C), une double inhibition de l’agrégation plaquettaire (DAPT) de 3 à 6 mois, suivie d’un traitement à vie à l’aspirine (degré de recommandation IIb, niveau C). Cependant, une méta-analyse d’essais randomisés comparant une monothérapie d’inhibition de l’agrégation antiplaquettaire (SAPT) à une DAPT n’a fait ressortir aucune réduction du taux d’AVC sous DAPT avec risque d’hémorragies sévères et potentiellement mortelles multiplié par 2.21 L’étude POPular TAVI a déjà montré que l’ajout d’un inhibiteur de l’agrégation plaquettaire ne réduit pas les événements vasculaires cérébraux et entraîne davantage d’hémorragies chez les patients ayant une indication à long terme d’anticoagulation orale. Plusieurs études sont actuellement en cours pour déterminer la meilleure stratégie antithrombotique possible. Sur la base des études actuelles, nous traitons les patients sans indication d’anticoagulation avec 100mg d’aspirine par jour (SAPT), et ce durablement. Les patients avec une indication d’anticoagulation sont réanticoagulés tôt après le TAVI et ne reçoivent pas d’inhibition supplémentaire de l’agrégation plaquettaire.
Bilan
«TAVI pour tous les patients» dont l’anatomie s’y prête, qui refusent un remplacement de valve aortique mécanique ou comme deuxième intervention privilégiée lorsque la bioprothèse aortique chirurgicale présente des signes de dégénérescence. Opération chez les jeunes patients ainsi que dans les cas de risques anatomiques visibles au CT, comme des valves massivement calcifiées et des sorties coronaires basses. Concernant la durabilité des valves aortiques transcathéters, les premières données présentent un faible taux de dégénérescence après 10 ans et donc une comparabilité avec les bioprothèses chirurgicales.
Auteurs:
Dr méd. Angela Heidenfelder
Jonathan Michel
Prof. Dr méd.Christian Templin
PD Dr méd.Barbara E. Stähli
PD Dr méd. A. Markus Kasel
Strukturelle Herzinterventionen/
Andreas-Grüntzig-Labore
Universitäres Herzzentrum, Klinik für Kardiologie
Universitätsspital Zürich
Adresse de correspondance:
PD Dr méd. A. Markus Kasel
Andreas-Grüntzig-Herzkatheterlabore
Leiter strukturelle Herzinterventionen
Universitäres Herzzentrum, Klinik für Kardiologie
Universitätsspital Zürich
Rämistrasse 100
8006 Zürich
E-mail:
markus.kasel@usz.ch
Littérature:
1 Leon MB et al.: N Engl J Med 2010; 363: 1597-607 2 Smith CR et al.: N Engl J Med 2011; 364: 2187-98 3 Leon MB et al.: N Engl J Med 2016; 374: 1609-20 4 Thourani VH et al.: Lancet 2016; 387: 2218-25 5 Adams DH et al.: N Engl J Med 2014; 370: 1790-8 6 Reardon MJ et al.: N Engl J Med 2017; 376: 1321-31 7 Mack MJ et al.: N Engl J Med 2019; 380: 1695-705 8 Popma JJ et al.: N Engl J Med 2019; 380: 1706-15 9 Thyregod HG et al.: J Am Coll Cardiol 2015; 65: 2184-94 10Webb JG, Dvir D: Circulation 2013; 127: 2542-50 11 Dvir D et al.: Circulation 2018; 137: 388-99 12 Mack MJ et al.: Lancet 2015; 385: 2477-84 13 Kapadia SR et al.: Lancet 2015; 385: 2485-91 14 Sathananthan J et al.: JACC Cardiovasc Interv 2020; 13: 235-49 15 Sondergaard L et al.: J Am Coll Cardiol 2019; 73: 546-53 16 Makkar RR et al.: JAMA 2019; 321: 2193-202 17 Hirji SA et al.: Eur Heart J 2020; 41: 2747-55 18 D’Ascenzo F et al.: EuroIntervention 2018; 14: e1169-77 19 Ott I et al.: EuroIntervention 2015; 11: 782-4 20Auffret V et al.: J Am Coll Cardiol 2016; 68: 673-84 21Maes F et al.: Am J Cardiol 2018; 122: 310-5
Das könnte Sie auch interessieren:
Meilleure fonction de la greffe après un don de rein vivant
De nombreux arguments plaident en faveur du don de rein provenant d’un donneur vivant: humains, fonctionnels et économiques. Mais Il faut également penser aux conséquences de l’ ...
Prise en charge clinique de l’AIT, du stroke mimic et de l’AVC caméléon
Dans cet article, nous nous penchons sur les questions suivantes: quand un traitement ambulatoire des patients atteints d’AIT est-il justifiable? Si un patient victime d’un stroke mimic ...
Chatbots in der Medizin
Die künstliche Intelligenz (KI) ist im Begriff, viele Bereiche zu verändern, darunter auch das Gesundheitswesen. Sie bringt vielversprechende Innovationen, aber auch Herausforderungen ...