Behandlungsempfehlung kutane Sarkome
Autor*innen:
Dr. med. Melike Ak1,2
Dr. med. Chantal C. Bachmann3
Prof. Dr. med. Reinhard Dummer1,2
PD Dr. med. Marjam-Jeanette Barysch-Bonderer1,2
1Klinik für Dermatologie, Universitätsspital Zürich
2Medizinische Fakultät, Universität Zürich
3Cosmodermis Einsiedeln, Schwyz
Korrespondierender Autor:
Prof. Dr. med. Reinhard Dummer
E-Mail: Reinhard.Dummer@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Kutane Sarkome sind seltene, von der Dermis ausgehende mesenchymale Tumoren. Aufgrund der niedrigen Prävalenz ist die Datenlage hinsichtlich Staging, Therapie und Nachsorge bisher schwach. Deshalb werden im Folgenden, unter Berücksichtigung der aktuellen Leitlinien und Literatur, unsere klinikinternen interdisziplinären Empfehlungen hinsichtlich Behandlung und Nachsorge hierzu dargestellt.
Zu den kutanen Sarkomen können das atypische Fibroxanthom (AFX), das pleomorphe dermale Sarkom (PDS), das Dermatofibrosarcoma protuberans (DFSP) und die atypische intradermale glattmuskuläre Neoplasie (ehemals kutanes Leiomyosarkom) gezählt werden.1–3
Von den kutanen Sarkomen sollten die Weichteilsarkome der tiefen Hautschichten und das DFSP mit fibrosarkomatöser Transformation abgegrenzt werden.2,3 Diese können einen aggressiven Verlauf mit einem höheren Metastasierungsrisiko (in bis zu 50% der Fälle) aufweisen.2,3 Ebenfalls sollte das Kaposi-Sarkom aufgrund der unterschiedlichen Ätiologie hiervon unterschieden werden.4
Atypisches Fibroxanthom (AFX) und pleomorphes dermales Sarkom (PDS)
AFX und PDS treten beide selten und vorzugsweise in chronisch sonnenexponierter Haut älterer Patienten auf.1,5 Klinisch präsentieren sie sich als rasch wachsende Knötchen insbesondere am Capillitium.1,5 Histologisch ist eine Proliferation von pleomorphen Spindelzellen nachweisbar, welche bis in die Dermis reichen können.1,5 Im Gegensatz zu AFX kann PDS eine perineurale Invasion sowie eine tiefere Infiltration in das subkutane Gewebe aufweisen; daher wird AFX als oberflächliche Variante von PDS beschrieben.1,5
Mittels Next-Generation Sequencing (NGS) kann eine hohe Mutationslast (>10 Mutationen/Megabase) nachgewiesen werden.1 Die Erstlinienbehandlung umfasst eine primär chirurgische Totalexzision mittels mikrografisch kontrollierter Chirurgie, wobei beim AFX ein zusätzlicher Sicherheitsabstand von mehr als 0,5cm erforderlich ist.6,7 Beim PDS wird eine Exzision mit weniger als 2cm Sicherheitsabstand als ein Risikofaktor für ein Tumorrezidiv beschrieben.8 Nach einer erfolgten kompletten Totalexzision mit Sicherheitsabstand beträgt das Risiko für ein lokoregionäres Rezidiv beim AFX unter 5%, beim PDS zwischen 5 und 28%.7,8 Fernmetastasierungen treten beim AFX nicht auf, beim PDS besteht ein Metastasierungsrisiko zwischen 4 und 10% – insbesondere bei inkomplett exzidiertem Tumor oder gleichzeitig bestehender hämatoonkologischer Grunderkrankung.6 Hierbei handelt es sich allerdings meist um Lymphknotenmetastasen; Fernmetastasen treten äusserst selten auf.7 Bei inoperablen Patienten kann eine Radiotherapie erwogen werden; im Fall eines metastasierten PDS mit hoher Mutationslast kann eine «off-label» Behandlung mit einem Checkpoint-Inhibitor mit Anti-PD-1-Antikörper in Betracht gezogen werden.1,7,9 Hinsichtlich der Nachsorge gibt es bis anhin keine evidenzbasierte Empfehlung, allerdings belaufen sich unsere Empfehlungen auf halbjährliche klinische Untersuchungen sowie Ultraschall der Lymphknoten und des Exzisionsgebietes für 5 Jahre; beim AFX genügen in der Regel klinische dermatologische Untersuchungen.
Dermatofibrosarcoma protuberans (DFSP)
DFSP hat eine Inzidenz von weniger als 1/100000 im Jahr.2 Das mittlere Alter bei Diagnose liegt zwischen 20 und 59 Jahren.2 Klinisch präsentiert sich das DFSP als langsam wachsende erythematöse Plaque oder als Knoten, häufig im Bereich des Stammes.2 Immunhistochemisch können CD-34+ spindelzellige Tumorzellen nachgewiesen werden, welche entlang der Septen bis in die Subkutis infiltrieren. Mittels Fluoreszenz-in-situ-Hybridisierung (FISH) kann in mehr als 90% der Fälle eine proliferationsfördernde Translokation in COL1A1/PDGFB («collagen type I alpha 1 chain»/«platelet-derived growth factor subunit B») nachgewiesen werden.10
Nach erfolgter chirurgischer Totalexzision wird eine Lokalrezidivrate in bis zu 40% beschrieben.2 Bei mikrografisch kontrollierter Totalexzision und zusätzlich 1–1,3cm Sicherheitsabstand wurde eine niedrigere Rate an Lokalrezidiven beobachtet.10 Die mittlere Dauer bis zum Auftreten eines Lokalrezidivs wurde in der Literatur mit 68 Monaten festgehalten. Eine Fernmetastasierung tritt nur selten auf.2 In inoperablen oder metastasierten Fällen kann eine zielgerichtete Therapie mit Imatinib evaluiert werden. Imatinib ist ein Tyrosinkinase-Inhibitor, welcher eine Aktivierung des PDGFB-Rezeptors verhindert, der durch die COL1A1-PDGFB-Translokation aktiviert wird.2,11 Eine Behandlung mit Imatinib im metastasierten Setting zeigt eine Ansprechrate von ca. 50%.2,10,11
Daten zu Empfehlungen bezüglich der Nachsorge sind gering, jedoch raten wir zu klinischen Kontrollen sowie Ultraschall des Exzisionsgebietes und der Lymphknoten halbjährlich über einen Zeitraum von 5 Jahren, gefolgt von jährlichen klinischen Kontrollen für weitere 5 Jahre.2,12
Atypische intradermale glattmuskuläre Neoplasie (früher kutanes Leiomyosarkom)
Die atypische intradermale glattmuskuläre Neoplasie, ehemals als kutanes Leiomyosarkom bekannt, geht von den glatten Muskelzellen der Dermis aus.3 Die Inzidenz beträgt 0,6/1000000 im Jahr.13 Sie tritt auf der Haut älterer Patienten in der 6. bis 8. Lebensdekade auf, häufig im Bereich der Unterschenkel. Klinisch kann sie als irreguläre schmerzhafte Plaques bis Knoten imponieren.3 Histologisch werden in der Dermis spindelzellige Tumorzellen, teilweise mit diskontinuierlichem Befall, nachgewiesen.3 Nach erfolgter chirurgischer Totalexzision wurde ein Risiko für lokoregionäre Rezidive von bis zu 67% dokumentiert.3 Eine chirurgische Totalexzision mit 1cm Sicherheitsabstand oder eine mikrografisch kontrollierte Totalexzision bringen eine Reduktion des Lokalrezidivrisikos.14 Eine Metastasierung wurde in bis zu 12% der Fälle beschrieben.3 Unser Nachsorgeschema beinhaltet: 6-monatliche klinische Kontrollen sowie Ultraschall des Exzisionsgebietes und der Lymphknoten für insgesamt 5 Jahre.
Zusammengefasst stellen die kutanen Sarkome eine seltene Krankheitsgruppe mesenchymaler Tumoren dar.2,3,5 Nach histologischer Diagnosestellung erfolgt die Therapie primär chirurgisch.2,5,10 Kutane Sarkome neigen in gewissen Fällen zu Lokalrezidiven, das Metastasierungsrisiko hingegen ist als niedrig bis intermediär einzustufen.2,3,5 Einheitliche Empfehlungen hinsichtlich Nachsorge sind nicht etabliert, weshalb wir in diesem Artikel unsere klinikinternen interdisziplinären Empfehlungen darstellen.
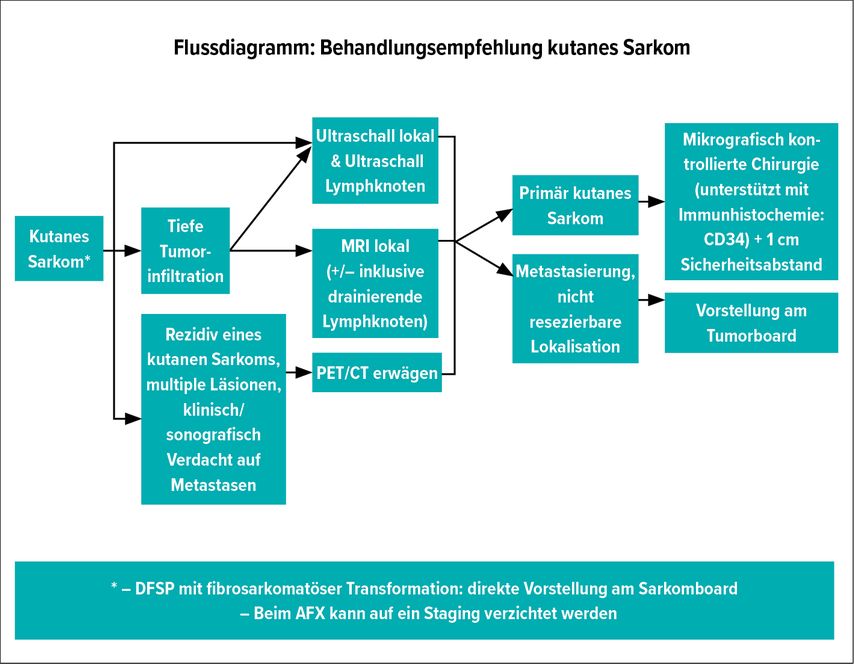
Empfehlung zur Behandlung kutaner Sarkome
Die Empfehlungen in der aktuellen Literatur basieren auf einer niedrigen Evidenzlage sowie auf Expertenmeinungen und unterschieden sich hinsichtlich der chirurgischen Verfahren, der Staginguntersuchungen und Nachsorge ja nach Art der kutanen Sarkome. Da die kutanen Sarkome im Allgemeinen eine ähnliche Prognose haben, wäre zur Vereinfachung eine einheitliche Behandlung sinnvoll, weshalb wir folgende Empfehlungen abgeben.
Diagnostik
Nach histologischer und immunhistochemischer Diagnosesicherung empfiehlt sich beim PDS eine NGS zur Bestimmung der Mutationslast und beim DFSP eine FISH-Analyse zur Untersuchung einer möglichen COL1A1-PDGFB-Translokation.7,10 Trotz des niedrigen bis intermediären Metastasierungspotenzials ist es sinnvoll, eine Staginguntersuchung zur Einschätzung der Prognose durchzuführen. Beim AFX kann auf diese verzichtet werden, da bisher keine Metastasierung beschrieben wurde.1 Als Untersuchung kann eine Sonografie im Bereich des Primarius und der Lymphknoten erfolgen. Bei klinischen und/oder histologischen Hinweisen auf eine tiefe Tumorinfiltration kann zusätzlich eine Magnetresonanztomografie (MRI) lokal und im Bereich der drainierenden Lymphknoten erfolgen. Im Fall eines rezidivierenden kutanen Sarkoms oder multipler disseminierter Läsionen oder bei Verdacht auf Metastasen ist eine Positronen-Emissions-Tomografie-Computertomografie (PET-CT) sinnvoll. Bisher wurde keine standardisierte Stadieneinteilung für kutane Sarkome etabliert. Generell gilt: Stadium I für lokal begrenzte Sarkome, Stadium II bei Lymphknotenmetastasen und Stadium III bei Fernmetastasen.2,3,7 Aufgrund des niedrigen Metastasierungspotenzials beinhaltet die Klassifikation der kutanen Sarkome im Gegensatz zur Klassifikation der Weichteilsarkome, gemäss FNCLCC AJCC8*, keine histologische Graduierung und kein Stadium IV.2,3,7
Therapie
Für primär kutane Sarkome gilt als Therapie der Wahl die schnittrandkontrollierte Totalexzision mit Sicherheitsabstand.3,7,10 Die Auswahl des chirurgischen Verfahrens und die Wahl des Sicherheitsabstandes sollten bei allen kutanen Sarkomen eine schnittrandkontrollierte R0-Resektion und eine Reduktion des Lokalrezidivrisikos zum Ziel haben. Hierbei kann ein chirurgisches Verfahren mittels zweizeitigen Vorgehens empfohlen werden. Primär wäre eine mikrografisch kontrollierte Chirurgie (MGC; zweizeitiges Vorgehen mit vollständiger histologischer Randschnittkontrolle) unterstützt durch Immunhistochemie (CD34), gefolgt von einer Nachexzision mit 1cm Sicherheitsabstand, für eine lokale Krankheitskontrolle sinnvoll (SlowMohs; Tübinger Torte). Der Sicherheitsabstand sollte individuell gemäss anatomischer Lokalisation angepasst werden. Eine postoperative Radiotherapie ist nur im Falle einer R1- oder R2-Resektion indiziert.
Bei Verdacht auf Metastasen sowie bei nicht resezierbaren kutanen Sarkomen ist eine Vorstellung beim Tumorboard für einen individuellen Therapieentscheid als empfehlenswert zu erachten. Hier können beispielsweise eine Radiotherapie, eine zielgerichtete Therapie mit Imatinib beim DFSP oder eine «off-label»Therapie mit Anti-PD-1-Antikörpern beim PDS in Erwägung gezogen werden.9,10
Nachsorge
Hinsichtlich des Nachsorgeschemas bei kutanen Sarkomen gibt es kaum Evidenz. Das Ziel der Nachsorge sollte eine Früherkennung von lokoregionären Rezidiven und Metastasen sein. Als einheitliche Nachsorge der kutanen Sarkome können halbjährliche klinische Untersuchungen sowie Ultraschall der Lymphknoten und des Exzisionsgebietes für 5 Jahre empfohlen werden. Beim AFX kann auf Ultraschalluntersuchungen verzichtet werden und es genügen halbjährliche klinische Untersuchungen für 5 Jahre. Da die mittlere Zeit bis zum Auftreten eines Lokalrezidivs beim DFSP 68 Monate betragen kann, werden beim DFSP zusätzlich klinische Kontrollen in jährlichem Abstand für weitere 5 Jahre empfohlen.
Oben genannte Empfehlungen basieren auf der aktuellen Literatur, weichen aber in einigen Punkten davon ab. Um eine evidenzbasierte Empfehlung bezüglich der Behandlung der kutanen Sarkome abzugeben, sind weitere Studien zur Verbesserung der Datenlage nötig.
Fussnote:
* FNCLCC = Fédération Nationale des Centres de Lutte Contre Le Cancer; AJCC = American Joint Committee on Cancer. Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, Springer, 2017
Literatur:
1 Ak M et al.: Clinicopathological and genomic profiles of atypical fibroxanthoma and pleomorphic dermal sarcoma identify overlapping signatures with a high mutational burden. Genes (Basel) 2021; 12(7):974 2 Saiag Pet al.: Diagnosis and treatment of dermatofibrosarcoma protuberans. European consensus-based interdisciplinary guideline. Eur J Cancer 2015; 51: 2604-8 3 Kazlouskaya V et al.: Leiomyosarcoma of the skin: review of the literature with an emphasis on prognosis and management. Int J Dermatol 2020; 59: 165-72 4 Dupin N: Update on oncogenesis and therapy for Kaposi sarcoma. Curr Opin Oncol 2020; 32: 122-8 5 Soleymani T et al.: Atypical fibroxanthoma and pleomorphic dermal sarcoma: updates on classification and management. Dermatol Clin 2019; 37: 253-9 6 Davis JL et al.: A comparison of Mohs micrographic surgery and wide excision for the treatment of atypical fibroxanthoma. Dermatol Surg 1997; 23: 105-10 7 Helbig D et al.: S1-guideline atypical fibroxanthoma (AFX) and pleomorphic dermal sarcoma (PDS). J Dtsch Dermatol Ges 2022; 20: 235-43 8 Persa OD et al.: Extended surgical safety margins and ulceration are associated with an improved prognosis in pleomorphic dermal sarcomas. J Eur Acad Dermatol Venereol 2019; 33: 1577-80 9 Klein S et al.: First report on two cases of pleomorphic dermal sarcoma successfully treated with immune checkpoint inhibitors. Oncoimmunology 2019; 8: e1665977 10 Barysch MJ et al.: Dermatofibrosarcoma protuberans in childhood treated with slow Mohs micrographic surgery. Pediatr Dermatol 2013; 30: 462-8 11 Hao X, Billings SD et al.: Dermatofibrosarcoma protuberans: update on the diagnosis and treatment. J Clin Med 2020; 9(6):1752 12 Foroozan M et al.: Efficacy of Mohs micrographic surgery for the treatment of dermatofibrosarcoma protuberans: systematic review. Arch Dermatol 2012; 148: 1055-63 13 Rouhani P et al.: Cutaneous soft tissue sarcoma incidence patterns in the U.S.: an analysis of 12,114 cases. Cancer 2008; 113: 616-27 14 Wong GN et al.: Cutaneous leiomyosarcoma: dermal and subcutaneous. Australas J Dermatol 2020; 61: 243-49
Das könnte Sie auch interessieren:
The use of ultrasonography to guide aesthetic filler injections
The use of aesthetic filler injections has been steadily increasing in recent years. Correspondingly, there has also been an increase in reported complications. Among these, vascular ...
«Low-level light»-Therapie bei Akne mit kombiniertem Rot- und Blaulicht
Bei vielen Patienten rufen die konventionellen Aknetherapeutika entweder starke Nebenwirkungen hervor oder die Wirkergebnisse sind nicht zufriedenstellend. Gerade Frauen mit Akne tarda ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...