Das weite klinische Spektrum der Psoriasis pustulosa
Autor:
Prof. Dr. med. Alexander Navarini
Chefarzt Dermatologie und Allergologie
Universitätsspital Basel
Herausgeber Leading Opinion Dermatologie & Plastische Chirurgie
E-Mail: Alexander.Navarini@usb.ch
Das enorm polymorphe Bild dieser Hautkrankheit kann die Diagnose erschweren, als Hilfestellung wurden 2017 erstmals klare phänotypische Kriterien definiert. Der folgende umfassende und sehr praxisnahe Überblick zu den drei pustulösen Psoriasisformen beinhaltet neben klinischen Beschreibungen auch aktuelle Daten zur Epidemiologie und stellt erste Ergebnisse neuer Behandlungen vor.
Keypoints
-
Die ERASPEN-Kriterien unterstützen Ärzt:innen bei der Differenzierung verschiedener Formen der pustulösen Psoriasis.
-
Prospektive Daten sind nun erforderlich, um zu bestimmen, ob auch weitere seltenere Formen anerkannt werden sollten.
-
Die Erforschung der Pathogenese hat zur Entwicklung neuer Behandlungen geführt, wie etwa der IL-36-Antagonisten Spesolimab und Imsidolimab.
-
Die Standard Operating Procedures (SOP) des Universitätsspitals Basel sind frei verfügbar: www.dermacompass.net.
Diese neuen Kriterien für die drei Formen der pustulösen Psoriasis, nämlich PPP (pustulöse palmoplantare Psoriasis), GPP (generalisierte pustulöse Psoriasis) und ACH (Acrodermatitis continua suppurativa), sind indirekt auf die Entdeckung des IL36RN-Gens als therapeutische Zielstruktur zurückzuführen. Denn die vor zehn Jahren begonnenen genetischen Untersuchungen erforderten erstmals klare phänotypische Definitionen, womit die damaligen Lehrbücher nicht dienen konnten. 2017 hatte ich mit Kolleginnen und Kollegen für die PPP erstmals «ganz einfache» ERASPEN-Konsensuskriterien erarbeitet.1 Es handelt sich demnach um primäre, persistente (>3 Monate), sterile, makroskopisch sichtbare epidermale Pusteln auf den Hand- und/oder Fussflächen, die mit oder ohne Psoriasis vulgaris vorliegen können.
Von isolierten Pusteln zu Eiterseen
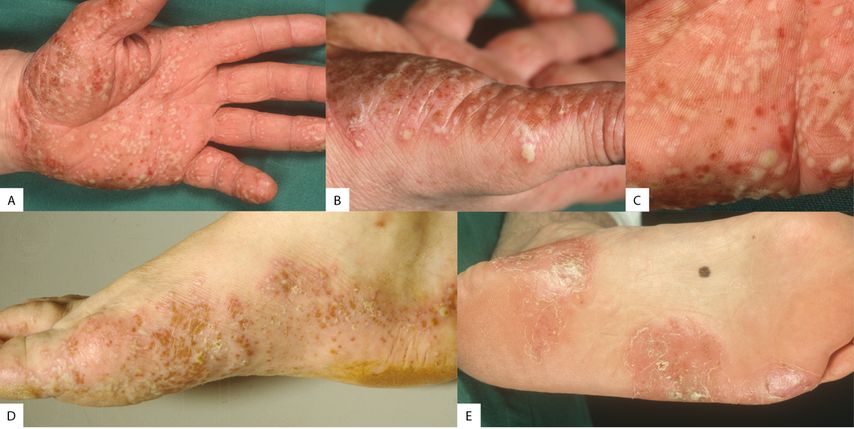
Klinisch imponiert häufig ein bilaterales, symmetrisches Bild, typischerweise sind thenare und hypothenare Regionen sowie zentrale Handflächen und Fusssohlen betroffen – bei Letzteren vorzugsweise die nichtgewichttragenden Bereiche. Die Hautveränderungen treten hauptsächlich auf der Leistenhaut auf, aber eben nicht nur: In grösseren Kohorten sind häufig eine Transgredienz beziehungsweise isolierte Pusteln zu beobachten.
Die PPP beginnt mit kleinen, erythematösen Maculae mit winzigen Pusteln im Zentrum, nachfolgend werden die Pusteln grösser und formen schlussendlich die «lakes of pus», also Eiterseen. Bei Abheilung der Pusteln bleiben braune Maculae oder erodierte Bereiche, Krusten oder Hyperkeratose zurück; bei Befall eines grossen Areals hinterlassen die Pusteln eine rote, glänzende Fläche, ebenfalls mit Kruste oder Hyperkeratose. Auch Nagelveränderungen sind nicht selten.
In asiatischen Ländern und bei Frauen deutlich häufiger
Beim «dyshidrosiformen Typ» der PPP befinden sich neben den klassischen Pusteln kleine Vesikel in der Haut. Diese Form scheint in Japan wohl deutlich häufiger zu sein und ebenfalls in Japan werden zwei weitere Subtypen der PPP beschrieben, Typ (A)ndrews, beginnend mit Vesikeln, gefolgt von vesikulären Pusteln, und Typ (B)arber, der unmittelbar mit Pusteln beginnt.2 Beide Typen sind klar mit dem Rauchen assoziiert und müssen von der PPP unterschieden werden: IL36RN-Mutationen sind hier selten, während bei der generalisierten PPP diese Mutationen einen wichtigen Risikofaktor darstellen.
Abb. 1: Überblick über die verschiedenen Typen: A) der klassische Phänotyp; B) Transgredienz über die Wallace-Linie, Übergang von Leisten- zur Felderhaut; C) scharf abgegrenzte, subkorneale beziehungsweise ältere Pusteln sowie konfluierende, Eiterseen bildende Pusteln; D) auch am Fuss kann die Krankheit stark ausgeprägt sein; E) mit klar demarkierten Zonen auf den nicht gewichttragenden Bereichen
Neue epidemiologische Daten bestätigen die deutlich höhere Prävalenz der PPP in asiatischen Ländern im Vergleich zu Europa (1:1000 versus 1:10000). Weitere relevante Zahlen: Prädominant sind Frauen betroffen (74%), 60% der Patientinnen und Patienten zeigen Pusteln sowohl auf Handflächen als auch auf Fusssohlen, und bei 10% liegt eine Nagelbeteiligung vor; in 40% der Fälle treten immer wieder Schübe auf, bei 60% ist die Krankheit so gut wie chronisch.3,4
Schmerzen sind bei das wichtigste Symptom der PPP: 20% der Betroffenen berichten über Schwierigkeiten bei der Nutzung von Händen beziehungsweise Füssen, was auch von arbeitsrechtlicher Relevanz sein kann. 13% weisen eine Arthralgie auf, bei 15% liegt eine Koinzidenz mit Plaque-Psoriasis vor, und von diesen 15% leiden wiederum 20–25% an Psoriasisarthritis (PsA). Daher ein Cave: Bei PPP-Patient:innen ist immer die gesamte psoriatische Anamnese durchzuführen.
Viele Trigger, noch mehr Differenzialdiagnosen
Zu den Triggern der PPP zählt vor allem das Rauchen, da hierzu eindeutige epidemiologische Daten und auch Laborstudien vorliegen: Beispielsweise führt ein Zigarettenrauchextrakt (+IL-17) auf Epithelzellen zur Freisetzung des für die Pustelbildung zuständigen Zytokins IL-36G.5 Ob das tatsächlich so stimmt oder nicht, ist bisher offen. Denn tatsächlich ist die Therapie der PPP mit IL-36-Blockern bisher nicht von durchschlagendem Erfolg gekrönt.5 Ob Vaping ebenfalls als möglicher Trigger infrage kommt, ist derzeit unklar; als Trigger gelten aber Stress, Infektionen sowie Medikamente wie Lithium oder ein paradoxer Effekt von TNF-α-Antagonisten und anderen Biologika.
Ein kurzer Überblick über die lange Liste der Differenzialdiagnosen: Diese umfassen palmoplantare Psoriasis (ohne Pusteln), Tinea pedis oder manuum; das dyshidrotische Ekzem mit Vesikeln als primäre Effloreszenzen, die sich nach Superinfektion pustulös umwandeln können; sowie Kontaktdermatitis, Skabies bei Kleinkindern, Herpes oder Epidermolysis bullosa simplex.
GPP: letale Organbeteiligung möglich
Nächstes Thema ist die GPP, die ebenfalls laut ERASPEN-Konsensuskriterien definiert wurde: primäre, sterile, makroskopisch sichtbare Pusteln auf nichtakraler Haut.1 Die Ausnahme sind Fälle, in denen die Pustelbildung auf die psoriatischen Plaques beschränkt ist, was als «Psoriasis cum pustulatione» bezeichnet wird. Die GPP kann «interessanterweise» mit oder ohne systemische Inflammation beziehungsweise mit oder ohne Psoriasis vulgaris auftreten und verläuft entweder intermittierend (mindestens 2 Episoden) oder anhaltend (>3 Monate), was differenzialdiagnostisch von Bedeutung ist.
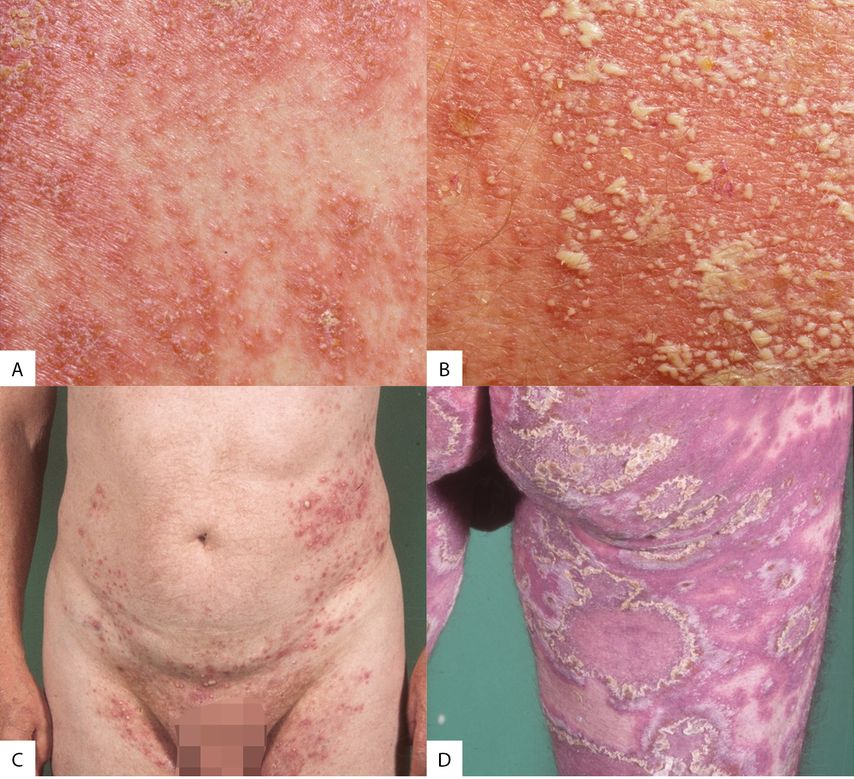
Klinisch sind nichtfollikuläre Pusteln auf erythematöser Haut zu sehen, die Schübe können abrupt auftreten und dauern rund zehn Tage bis vier Wochen an. Systemische Entzündungssymptome (Fieber, Malaise, Schmerzen, erhöhtes CRP) sind möglich, ebenso die Organbeteiligung bis hin zum Tod aufgrund von Versagen von Leber, Niere oder respiratorischem beziehungsweise kardiovaskulärem System. Die Mortalität liegt in Kohortenstudien bei rund 2%, wobei die Betroffenen typischerweise nicht im Schub sterben, sondern an Organstörungen. Auch hier kann eine Plaque-Psoriasis auftreten, und mindestens 50% der Betroffenen haben Mutationen im IL36RN-Gen.
Die epidemiologischen Daten zeigen den Unterschied zur PPP: Die Prävalenz der GPP liegt in Frankreich bei 1:1 Million, in Japan und Brasilien bei 1/100000, sie ist also insgesamt viel seltener.1,4,6 Auch hier sind Frauen mit 55–67% (etwas) häufiger betroffen. Im Gegensatz zur PPP liegt keine Assoziation mit Rauchen vor, der BMI ist zwar laut ein oder zwei Kohortenstudien erhöht, wobei diese Daten allerdings mit einer gewissen Zurückhaltung zu sehen sind: Das sind US-amerikanische Untersuchungen, bei uns in Europa sind die meisten Betroffenen aber normalgewichtig. Als Trigger gelten auch hier Stress, Infekte, Medikamente und Schwangerschaft.Bei 30% der Betroffenen tritt die Krankheit bereits im ersten Lebensjahr auf, hierbei handelt es sich häufig um die genetische Form. Grundsätzlich gilt: Je mehr IL36RN-Mutationen, desto früher ist der Beginn und desto häufiger sind die Schübe. Drei Viertel haben eine systemische Entzündung, und glücklicherweise nur selten kann es aufgrund von respiratorischem oder kardiovaskulärem Versagen zum Tod kommen. Ein Viertel hat Plaque-Psoriasis, diese tritt eher bei der sporadischen und seltener bei der genetischen Form auf.
Kein unimorphes Krankheitsbild
Die Pusteln befinden sich meistens an Stamm (91%), Extremitäten (83%) und Beugen (43%), in den Polygonen der Felderhaut; sie sind nicht follikulär gebunden und die Farbentwicklung verläuft über weisszu gelb, dann zu braun.
Der Subtyp des Erythema anulare centrifugum ist nicht so selten, mit Pusteln am Rand. Cave: Bei gleichzeitigem Vorliegen einer Plaque-Psoriasishandelt es sich um die bereits oben erwähnte Psoriasis cum pustulatione, eine sehr entzündliche Psoriasis mit ein paar Pusteln am Rand der Plaques – es muss nicht immer gleich eine pustulöse Psoriasis sein. Und: Auch eine GPP mit Zungenbeteiligung wurde kürzlich bestätigt.7,8
Abb. 2: Die Bilder zeigen die verschiedenen Ausprägungen der GPP: A) den klassischen Phänotyp auf erythematösem Grund; B) mit Eiterseen; C) sehr leicht ausgeprägt, fast kein Erythem und D) sehr schwer ausgeprägt
Die wichtigste Differenzialdiagnose der GPP ist das AGEP, die «akute generalisierte exanthematische Pustulose», eine schwere Arzneimittelreaktion. Cave: Eine AGEP ist häufiger als eine GPP, nicht jede AGEP ist daher eine GPP und unverzüglich mit Biologika zu behandeln (bei AGEP ist es therapeutisch ausreichend, das auslösende Medikament abzusetzen). Weitere Differenzialdiagnosen sind Impetigo bullosa, disseminierte Follikulitis, die amikrobielle Pustulose Oberlin (SLE); weiter das Sweet-Syndrom (akute febrile neutrophile Dermatose), Candidiasis und Erythema multiforme oder Virusinfekte, die alle pustulös auftreten können.
Spesolimab: Effektivität unabhängig vom Mutationsstatus
Zur Therapie: Der Antikörper Spesolimab richtet sich gegen den IL-36-Signalweg. In einem randomisiert-kontrollierten Trial war bei 54% von insgesamt 53 Patient:innen nach einer Woche das komplette Verschwinden aller Pusteln zu beobachten, und zwar unabhängig von einer IL36RN-Mutation. Zu den unerwünschten Nebenwirkungen zählten Infekte und systemische Arzneimittelnebenwirkungen (DRESS, medikamentösinduzierte Hepatitis).9
Abschliessend sollte man auch hier die ERASPEN-Konsensuskriterien für die «Akrodermatitis continua suppurativa Hallopeau in den Blick nehmen:1 primäre, persistente (>3 Monate), sterile, makroskopisch visible Pusteln des Nagelapparats, die mit oder ohne Psoriasis vulgaris auftreten können. Im Vordergrund stehen die Symptome Juckreiz und Schmerz, an den betroffenen distalen Phalangen kommt es zum Verlust der Papillenleisten und zur Entwicklung atropher Areale und Nagelverlust bis hin zum Knochenschwund der Phalanx.10 Die Prävalenz dieses Krankheitsbildes ist unbekannt, sie liegt wahrscheinlich zwischen der PPP und GPP. Das maximale Alter bei Beginn beträgt 58 Jahre, eine weibliche Prädominanz ist hier nicht vorhanden, Raucher sind nicht vermehrt betroffen. Häufig ist die Akrodermatitis mit Plaque-Psoriasis assoziiert, spezifische Trigger sind nicht bekannt. Abschliessend noch ein letztes Cave: Bei dieser Hautkrankheit kann eine periphere Arthritis auftreten.
Quelle:
Navarini A: „Klinisches Spektrum der pustulösen Psoriasis“, am Swiss Derma Day 2024, Luzern
Literatur:
1 Navarini AA et al.: JEADV 2017;31:1792-1799 2 Murakami M et al.: J Dermatol Sci 2020;98:13-193 3 Noe MH et al.: JAMA Dermatology 2022;158:68-72 4 Mostafa A et al.: manuscript in preparation 5 Kobayashi K et al.: J Invest Dermatol 2021;141:1533-1541.e4 6 Kharawala S et al.: Exp Rev Clin Immunol 2020;16:239-252 7 Choon SE et al.: Exp Dermatol 2023;32:1263-1271 8 Liang J et al.: Hum Gen 2017;136(2):241-252 9 Bachelez H et al.: NEJM 2021;385:2431-2440 10 Twelves S et al.: JACI 2019;143:1021-1026
Das könnte Sie auch interessieren:
Tierbisse bei Reisenden in tropischen und subtropischen Ländern
Brehms Tierleben einmal anders: wieso Spinnenbisse nicht so häufig sind wie angenommen, wie Feuerameisen ihren doppelzangigen Angriff führen und warum einfach der gesunde ...
Aktuelle Studien der Dermatoonkologie
In dieser Übersicht werden die laufenden klinischen Studien der Dermatoonkologie am Universitätsspital Zürich zusammengefasst und neu entwickelte Therapieansätze besprochen.
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...