Optimierte Therapie bei fistulierendem Crohn 2023
Autorin:
OÄ Dr. Reingard Platzer
Innere Medizin für Gastroenterologie und Hepatologie
Landesklinikum Wiener Neustadt
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der fistulierende Morbus Crohn gilt als einer der herausforderndsten Aspekte in der Behandlung von Patienten mit chronisch-entzündlichen Darmerkrankungen. Die Heterogenität der Patienten erfordert eine individualisierte Therapie. Neben einer effektiven antiinflammatorischen Medikation ist eine interdisziplinäre Zusammenarbeit essenziell. 1999 wurde mit Infliximab die Biologika-Ära bei Morbus Crohn eingeläutet, welches nach wie vor in den Leitlinien als Erstlinien-Therapie gilt.
Keypoints
-
Heterogenität der Patientenklientel, „Burden of Disease“ und hohe Entzündungslast mit potenziell irreversiblen Schäden erfordern einen interdisziplinären Behandlungsplan (idealerweise bei Diagnose der fistulierenden Erkrankung).
-
Die Therapieziele umfassen Kontrolle der Inflammation, Erhaltung der Sphinkterfunktion und Kontinenz, Rückgewinn der Lebensqualität und Vermeidung eines Stomas.
-
Zum Abheilen werden höhere Spiegel der TNF-alpha-Blocker benötigt, dies impliziert die entsprechende Dosisanpassung und Nutzen-Risiko-Abwägung einer Kombinationstherapie mit Thiopurinen.
-
Eine individualisierte Therapie, keinesfalls „one size fits all“, ist der Schlüssel zum Erfolg.
Allgemeines
Historisches
Fisteln beschäftigen die Menschheit schon lange Zeit –bereits in der Antike hat Hippokrates eine Seton-Anlage mit Rosshaar beschrieben (450 vor Christus). Nach der Erstbeschreibung der Ileitis terminalis 1932 wurde 1938 durch den amerikanischen Chirurgen Dr. Burrill Bernard Crohn das Auftreten von perianalen Fisteln bei Morbus Crohn beschrieben.1 Als Meilensteine der medikamentösen Behandlungsmöglichkeiten gelten die „New England Journal of Medicine“-Publikationen, welche 1980 die Effektivität der Thiopurine bei Fisteln und 1999 die Wirksamkeit von Infliximab als erstes Biologikum in der Crohntherapie beschrieben haben.2,3
Zahlen und Fakten
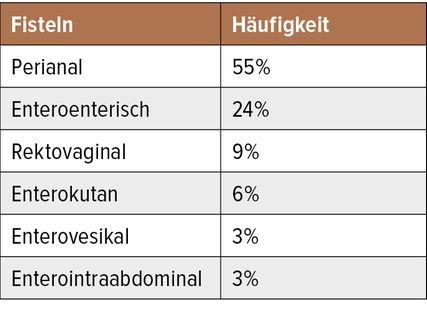
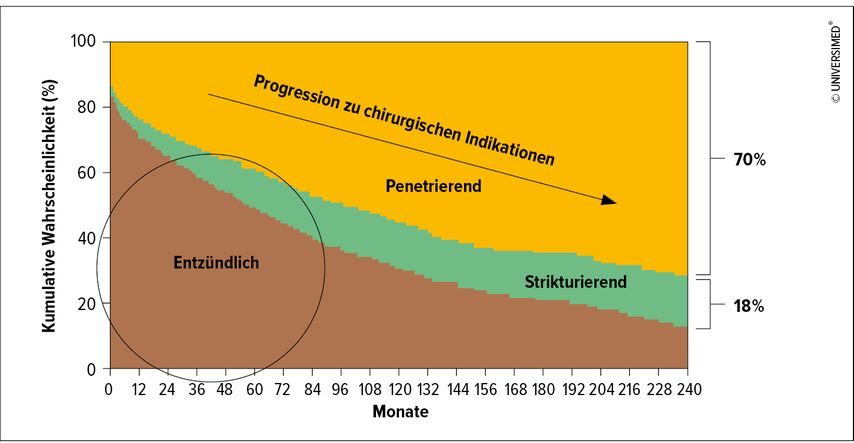
Mehr als jeder 3. Crohnpatient ist betroffen (Tab. 1). Der fistulierende/penetrierende Morbus Crohn gilt als negativer Prädiktor für den Krankheitsverlauf, mit der Krankheitsprogression steigt die Rate an chirurgischen Interventionen (Abb. 1). Um die 20% entwickeln eine perianale Crohnerkrankung binnen 10 Jahren, rund 10% bei der Erstdiagnose.4 Häufig besteht eine Korrelation mit dem luminalen Morbus Crohn, aber in 5% der Fälle präsentiert sich eine isolierte perianale Crohnerkrankung.5,6 Die Prävalenz von Analfisteln in Europa liegt bei 18,37 pro 100000. Interessanterweise zeigen Studien vor 2000 deutlich niedrigere Prävalenzen.7 Nach aktuellen Daten gelten 25% als Crohn-assoziierte Fisteln.8
Klassifikationen der perianalen Fisteln
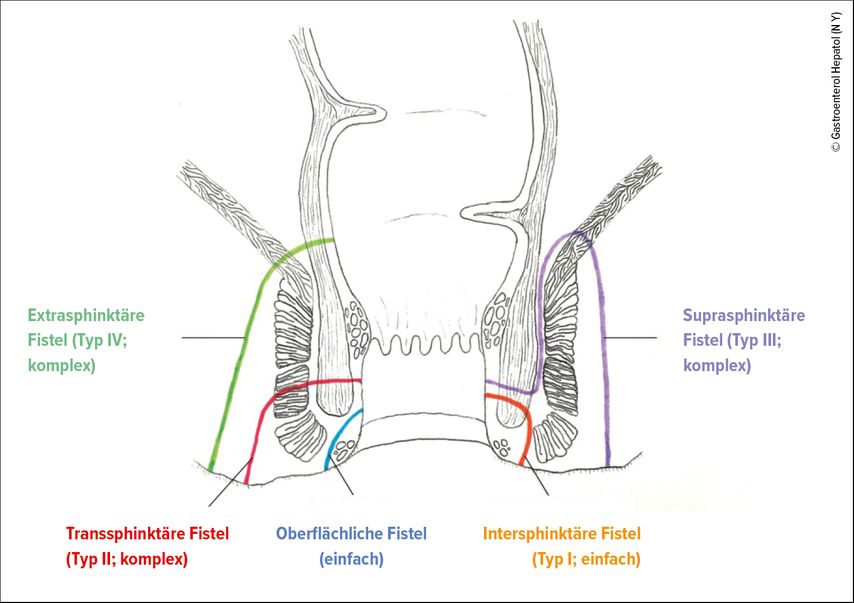
Seit fast 50 Jahren gibt es die Parks-Klassifikation9, welche hinsichtlich der Lage und des Verlaufs zum Analsphinkter (äußeren und inneren Schließmuskel) unterscheidet (Abb. 2):
-
Typ I: intersphinktäre Fistel
-
Typ II: transsphinktäre Fistel
-
Typ III: suprasphinktäre Fistel
-
Typ IV: extrasphinktäre Fistel
-
Typ V: subkutane/subanodermale/submuköse Fistel
Abb. 2: Die Parks-Klassifikation der perianalen Fisteln (mit freundlicher Genehmigung von Gastroenterol Hepatol (N Y), modifiziert nach Gold SL et al. 2018)37
Oberhalb der Linea dentata spricht man von hohen Fisteln, darunter von tiefen Fisteln. 2003 wurde die Klassifizierung in simple und komplexe Fisteln von der AGA (American Gastroenterological Association) definiert. Zu den komplexen Fisteln zählen Fisteln mit mehreren externen Fistelöffnungen, Organbeteiligung von Vagina/Harnblase sowie einer anorektalen Stenose, einer Proktitis oder eines Fistel-assoziierten Abszesses. 70–80% gelten als komplexe Fisteln.10
Nicht alles, was perianal schmerzt, ist eine Fistel! Es muss eine Reihe von Differenzialdiagnosen berücksichtigt werden wie Pyoderma gangraenosum, Akne inversa/Hidradenitis suppurativa, Psoriasis inversa, Herpes-, Streptokokken-Infektionen, Tuberkulose, Sarkoidose, M. Behçet, Pruritus ani, Karzinome,Lues, metastatischer Morbus Crohn, Perianalthrombose …
„Burden of disease“ durch perianales Fistelleiden
Perianale Fisteln können einen störenden Effekt auf Körpergefühl und Sexualität ausüben. Eine rezente von der europäischen Patienten-Selbsthilfegruppe initiierte Umfrage in elf Sprachen zeigt mehr Beeinträchtigungdurch perianalen fistulierenden Morbus Crohn in sämtlichen Lebensbereichen (Sozial- und Arbeitsleben, Partnerschaft, Sexualität, Lebensqualität), verglichen mit Crohnpatienten ohne Fistelleiden.11
Komplikationen bei Fisteln
Was wir in der Behandlung von Crohnpatienten vermeiden wollen, sind (nicht selten) nächtliche Besuche in der Notfallaufnahme mit einem akut schmerzenden Analabszess. Daher gilt es, möglichst früh im Krankheitsverlauf den Chirurgen miteinzubeziehen und bei Bedarf eine Fisteldrainage zu initiieren.
Perianale Fisteln können mit Schmerzen, Dyspareunie, unkontrolliertem Ausfluss von Flüssigkeit/Pus und Stuhl und Einschränkung der Lebensqualität einhergehen. Fistel-assoziierte Karzinome können bei langjähriger Fistelpräsenz auftreten und sind schwer zu diagnostizieren. Sie sind selten mit einer geringen Inzidenz (<1%), weisen allerdings eine schlechte Prognose auf. Als Risikofaktoren gelten: lange Krankheitsdauer, früher Erkrankungsbeginn, hohe Entzündungsaktivität, anorektale Stenose, Rauchen, HPV-Infektion.12–14
Fistelentstehung
Lange war es ein Rätsel, wie Fisteln entstehen. Mittlerweile weiß man, dass EMT („epithelial-to-mesenchymal transition“) die treibende Kraft in der Entstehung von Fistelgängen bei Crohnpatienten darstellt. Eine Reihe von proinflammatorischen Zytokinen wie TNF („tumor necrosis factor“), die Hochregulation der TGF-β-Produktion und eine erhöhte Aktivität der Matrix-Metalloproteinasen (MMP) sind an der Transformation der intestinalen Epithelzellen in Myofibroblasten-ähnliche Zellen beteiligt, was zu einer Fistelformation führt. IL-13 findet sich hochexprimiert in Fistelgängen. Dafür braucht es einen Defekt der Schleimhautbarriere (wie bei der transmuralen Entzündung des Morbus Crohn im Gegensatz zur Colitis ulcerosa, die mit einer oberflächlichen, mukosalen Entzündung einhergeht, wobei Fisteln sehr selten vorkommen).
Diagnostik
Zu den Eckpfeilern der Diagnostik zählen neben der klinischen Beurteilung die Endoskopie (Beurteilung der Entzündungsaktivität im Darm) und die Magnetresonanzuntersuchung (MR). Die Fistulografie ist aufgrund der Überlegenheit der MR und der Strahlenbelastung in den ECCO-Guidelines nicht mehr empfohlen. Die anale Endosonografie kann Informationen über beispielsweise Muskeldefekte des Sphinkterapparates bringen. Die Darmsonografie kann Aufschluss über die Darmwanddicke geben und Abszesse oder Fisteln erkennen. Die Computertomografie soll aufgrund der Strahlenbelastung Notfalluntersuchungen und bestimmten Fragestellungen vorbehalten sein, zum Beispiel bei enterovesikalen Fisteln ergänzend zu Cystoskopie und Cystografie.
Perianale Fisteln können der Crohnerstdiagnose um Jahre vorausgehen. Neben Anamnese, Calprotectin in der Stuhlbestimmung, endoskopischer und radiologischer Abklärung sei hier auch auf den Nutzen der Kapsel-Endoskopie hingewiesen: 24% bei unauffälliger Ileo-Coloskopie, CT/MR-Enterografie.9
Medikamentöse Therapieoptionen
Wegweisend für den Biologika-Einsatz war die 1999 publizierte randomisierte kontrollierte Infliximab-Landmark-Studie mit Ansprechen auf Fisteln als primärer Endpunkt.3 Nach wie vor wird Infliximab als First-Line-Therapie bei perianalen Fisteln empfohlen. Eine rezente Studie bestätigt die Überlegenheit von Infliximab verglichen mit Adalimumab in Hinblick auf Effektivität (Ansprechen nach 6 Monaten 64,9% versus 34,8%) und Persistenz. Eine bessere Response-Rate kann mit konkomitanten Immunmodulatoren erreicht werden.15 Zum Abheilen der perianalen Fisteln werden höhere Spiegel der TNF-alpha-Blocker Infliximab und Adalimumab benötigt.16 Das unterstreicht die Bedeutung einer Dosisanpassung und Nutzen-Risiko-Abwägung einer Kombinationstherapie mit Thiopurinen.
1980 konnte die Effektivität der Thiopurine als Monotherapie beim fistulierenden Morbus Crohn gezeigt werden.2 Heute dienen die Thiopurine (Azathioprin oder 6-Mercaptopurin) in Kombination mit TNF-alpha-Blockern zur Reduktion der Immunogenität und Erhöhung der Anti-TNF-Spiegel.17 Antibiotika wie Metronidazol oder Ciprofloxacin kombiniert mit Anti-TNF können kurzfristig höhere Response-Raten erzielen, zu bedenken sind potenziell unerwünschte Nebenwirkungen der Antibiose.18–20 Duale Biologika-Therapien stellen eine Option bei refraktärem fistulierendem Morbus Crohn dar.21
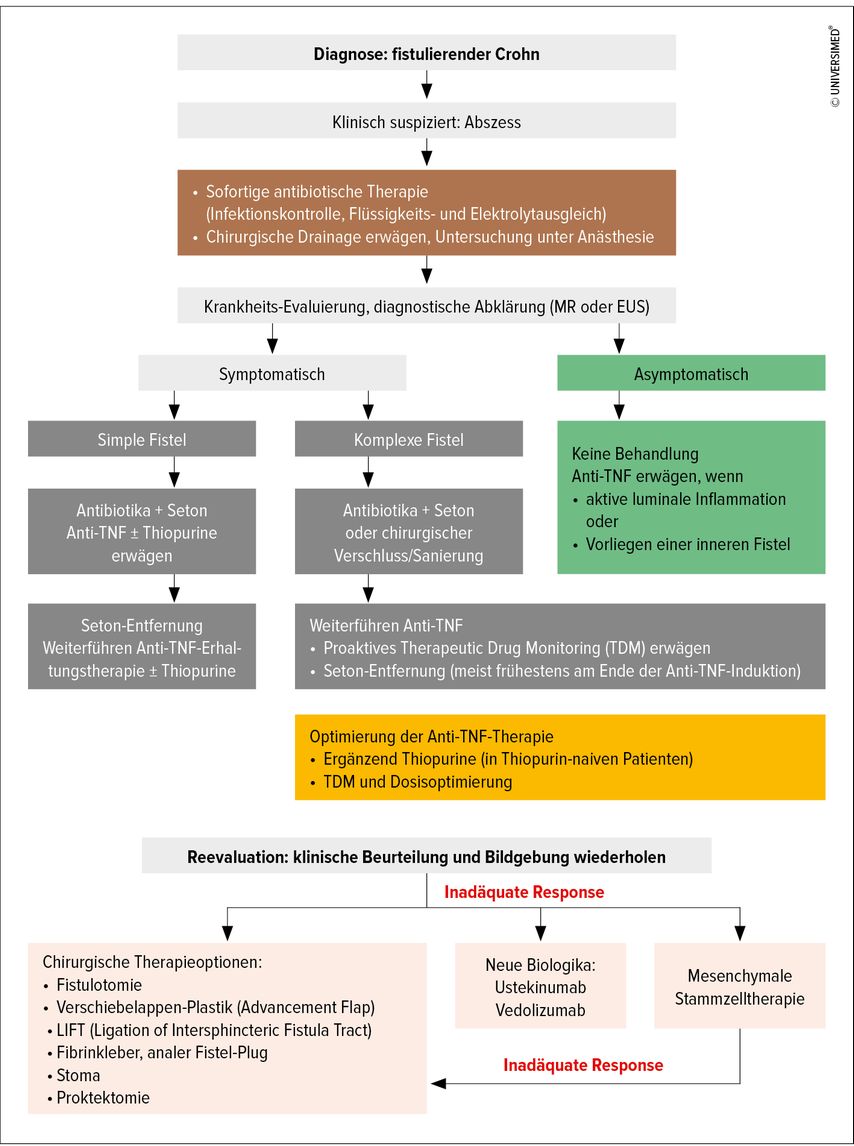
Abb. 3: Algorithmus der optimierten Therapie bei fistulierendem Crohn (modifiziert nach Wetwittayakhlang P et al. 2022)38
Optimiertes medikamentöses Management
Was gilt es zu beachten?
-
Optimales Timing der immunmodulierenden Therapie, Evaluierung einer Seton-Anlage vor Anti-TNF-Beginn
-
Real-World-Daten weisen auf eine Zeitverzögerung von bis zu 6 Monaten hin!22
-
Maintenance-Therapie bei fistulierendem Crohn!!!
-
Eine Reihe von Studien zeigt, dass das Absetzen der Anti-TNF-Therapie zu Relapse (perianal + luminal) bei rund der Hälfte der Patienten führt.23–25
-
Symptomatische enterale Fisteln: frühzeitige operative Sanierung evaluieren!
Risikofaktoren für Komplikationen wie Infektionen, Sepsis oder intraabdominelle Abszesse sowie Nichtansprechen einer medikamentösen Therapie sind: eine konkomitante Darmstenose, mehrere enterale Fisteln, enterovesikale Fisteln.
Bereits 2004 wurde in einer Studie aus dem AKH Wien ein Mangel an Effektivität der Infliximab-Therapie bei enteral fistulierendem Morbus Crohn beschrieben.26 Gemäß den ECCO-Richtlinien müssen asymptomatische Fisteln nicht umgehend operiert werden, allerdings der Effekt der Medikation engmaschig monitiert werden.27
Neuere medikamentöse Therapieoptionen
Biologika wie Ustekinumab (IL-12-/IL-23-Inhibitor) oder Vedolizumab (α4β7-Integrin-Antagonist) zeigen in den Subgruppen-Analysen einen Benefit28,29 und sind eine gute Option bei Anti-TNF-Therapieversagen oder Kontraindikation gegen TNF-alpha-Blocker.
Es sind auch rezent publizierte Fisteldaten zu den selektiven JAK-Inhibitoren Upadacitinib30 und Filgotinib31 verfügbar. Filgotinib ist derzeit für Morbus Crohn nicht zugelassen.
Antworten zu häufig gestellten Fragen
-
Seton-Liegedauer: ist unterschiedlich, meist rund ein halbes Jahr, zumindest für die Dauer der Biologika-Induktionstherapie, Seton-Einlage nicht als Einzelmaßnahme32,33
-
Fistelheilungsraten: betragen trotz moderner Therapiekonzepte (kombiniert medikamentös und chirurgisch) rund 50%34
-
Risikofaktoren für schlechte Wundheilung bei chirurgischen Eingriffen: luminale Crohnentzündungsaktivität, Rauchen
-
Voraussetzung für die seit 2018 zugelassene mesenchymale Stammzelltherapie (Darvadstrocel) bei komplexen Fisteln: nichtaktiver/geringaktiver luminaler Morbus Crohn
„Das A und O“ der Therapie bei fistulierendem Crohn
A: Awareness schaffen, aktiv danach fragen, Abszesse vermeiden, erkennen und behandeln! Bedenke: tabuisiertes Thema, hoher Leidensdruck, fast die Hälfte der Crohnpatienten betroffen!
O: Optimale Entzündungskontrolle, damit enterale Fisteln gar nicht entstehen und sämtliche Behandlungsansätze bei perianalen Fisteln wirken können!
Fazit
Multidisziplinäres Management (Gastroenterologie, Chirurgie, Radiologie, CED-Nurse, Stoma-Berater etc.), effektive frühzeitige Therapie und optimale Entzündungskontrolle sowie ein individualisierter Behandlungsplan sind der Schlüssel zum Erfolg.
Literatur:
1 Penner A, Crohn BB: Ann Surg 1938; 108(5): 867-73 2 Present DH et al.: N Engl J Med 1980; 302: 18 3 Present DH et al.: N Engl J Med 1999; 340(18): 1398-405 4 Tsai L et al.: IBD 2021; 19(10): 2031-45.e11 5 Gecse KB et al.: J Crohns Colitis 2016; 10(7): 758-66 6 Schwartz DA et al.:Inflamm Bowel Dis 2015; 21(4): 723-30 7 Sarveazad A et al.: Gastroenterol Hepatol Bed Bench 2022; 15(3): 190-3 8 Hokkanen S et al.: World J Clin Cases 2019; 7(14): 1795-1804 9 Adler SN et al.: World J Gastrointest Endosc 2012; 4(5): 185-8 10 Molendijk I et al.: Inflamm Bowel Dis 2014; 20(11): 2022-8 11 Spinelli A et al.: Crohns & Colitis 360 2023; 5(3): otad 36 12 Kotsafti A et al.: Cancers 2020; 12(7): 1748 13 Baars JE et al.: Scand J Gastroenterol 2011; 46(3): 319-25 14 Kienbauer M et al.: J Gastroenterol Hepatol Erkrank 2017; 15(3): 51-5 15 Maas L et al.: Dig Dis Sci 2023; 68: 357-69 16 Gu B et al.: World J Gastroenterol 2022;28(23): 2597-2608 17 Lee MJ et al.: Colorectal Dis 2018; 20(9): 797-803 18 Dewint P et al.: Gut 2014; 63(2): 292-9 19 West RL et al.: Aliment Pharmacol Ther 2004; 20(11-12): 1329-36 20 Lee MJ et al.: Clin Gastroenterol Hepatol 2018; 16(12): 1879-92 21 Yang E et al.: Aliment Pharmacol Ther 2020; 51(11): 1031-8 22 Lee MJ et al.: Colorectal Dis 2018; 20(9):797-803 23 Tandon P et al.: Dig Dis Sci 2019;64(11): 3066-77 24 Mak JWJ et al.: Aliment Pharmacol Ther 2019; 50(11-12): 1195-1203 25 Legué C et al.: Inflamm Bowel Dis 2018; 24(6): 1107-13 26 Miehsler W et al.: Inflamm Bowel Dis 2004; 53(4): 542-8 27 Bemelman WA et al.: J Crohns Colitis 2018; 12(1): 1-16 28 Godoy Brewer GM et al.: BMJ Open Gastroenterol 2021; 8: e000702 29 Ayoub F et al.: Intest Res 2022; 20(2):240-50 30 Colombel JF et al.: J Crohns Colitis 2023; 17(1): i485-6 31 Reinisch W et al.: J Crohns Colitis 2022; 16(1): i415 32 Bouguen G et al.: Clin Gastroenterol Hepatol 2013; 11(8): 975-81.e1-4 33 Wasmann KA et al.: JJ Crohns Colitis 2020; 14(8): 1049-56 34 Kotze PG et al.: Gut 2018; 67(6): 1181-94 35 Cosnes J et al.: Inflamm Bowel Dis 2002; 8(4): 244-50 36 Tjandra D et al.: Aliment Pharmacol Ther 2021; 53(10): 1064-79 37 Gold SL et al.: Gastroenterol Hepatol (N Y) 2018; 14(8): 470-81 38 Wetwittayakhlang P et al.: J Clin Med 2022; 11(11): 3045
Das könnte Sie auch interessieren:
Vorsorgekoloskopie und Polypektomienachsorge
In ihrem Vortrag zum Darmkrebs-Screening in Österreich an der SGG-Jahrestagung 2024 ermöglichte Univ.-Prof. Dr. med. Monika Ferlitsch, Wien, einen Blick über den Tellerrand. Sie zeigte ...
Update im therapeutischen Management der Helicobacter-pylori-Infektion
Die H.-pylori-Infektion ist entscheidender Ausgangspunkt für die Entwicklung eines Magenkarzinoms. Diese Entwicklung kann durch eine frühzeitige Eradikation von H.pylori verhindert ...
ECCO-Update 2025
Der Kongress der European Crohn’s and Colitis Organisation (ECCO) fand 2025 vom 19. bis 22. Februar in Berlin unter dem Motto «Nachhaltigkeit bei chronisch-entzündlichen Darmerkrankungen ...