Update im therapeutischen Management der Helicobacter-pylori-Infektion
Autor:
Prof. Dr. med. Dres. h.c. Peter Malfertheiner1,2
1Ehemaliger Direktor der Klinik für Gastroenterologie, Hepatologie und Infektiologie
Otto-von-Guericke Universität Magdeburg
2Medizinische Klinik II
LMU Klinikum, München
E-Mail: peter.malfertheiner@med.ovgu.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die H.-pylori-Infektion ist entscheidender Ausgangspunkt für die Entwicklung eines Magenkarzinoms. Diese Entwicklung kann durch eine frühzeitige Eradikation von H.pylori verhindert werden, weshalb weltweit sogenannte H.-pylori-«screen/test and treat»-Präventionsstrategien empfohlen werden. Ein Problem in der Behandlung stellt die Zunahme von Antibiotikaresistenzen dar, die auch vor H.pylori nicht Halt macht.
Aktuelle epidemiologische Daten zeigen, dass mehr als 40% der Weltbevölkerung von einer H.-pylori-Infektion betroffen sind. Entgegen der Erwartung einer Abnahme der H.-pylori-Infektion bei Kindern und Jugendlichen wird sie weiterhin häufig nachgewiesen; dies gilt im Besonderen für Kinder aus Herkunftsländern mit eingeschränkten Hygienestandards.1
Der Indikationsbereich zur Therapie der H.-pylori-Infektion hat einen entscheidenden Paradigmenwechsel erfahren, seitdem die H.-pylori-Gastritis im Kyoto Consensus als Infektionskrankheit definiert und als eigenständige nosologische Entität in die neueste «International Classification of Diseases» (ICD 11) aufgenommen wurde.2
Indikationen zur H.-pylori-Therapie
Bei Nachweis von H.pylori besteht immer eine Behandlungsindikation, auch im Falle einer zum Zeitpunkt fehlenden klinisch fassbaren Symptomatik. Die zugrunde liegende Rationale dafür ist, dass die H.-pylori-Gastritis mit strukturellen Veränderungen der Magenschleimhaut und Auswirkungen auf die Magenphysiologie einhergeht und den möglichen Ausgangspunkt für Komplikationen wie das peptische Ulkus und das Magenkarzinom darstellt.3
Es gibt eine Reihe klinischer Indikationen, bei denen der Nachweis von H.pylori unerlässlich und in der klinischen Praxis entsprechend etabliert ist (Abb. 1).
Prävention des Magenkarzinoms
Ein besonderer Schwerpunkt und Gegenstand weltweiter Bemühungen ist auf die H.-pylori-«screen and treat»-Strategie zur Prävention des Magenkarzinoms ausgerichtet.
Dem liegt die Kenntnis zugrunde, dass in 90% der Fälle die H.-pylori-Gastritis essenzieller Ausgangspunkt für die Entstehung des Magenkarzinoms ist. Eine Reihe weiterer Faktoren spielen zwar eine begünstigende Rolle in der Magenkarzinogenese, sind aber von nachgeordneter Bedeutung. Dabei zu benennen sind die erhöhte Virulenz einzelner H.-pylori-Stämme, prädisponierende familiäre genetische Faktoren und Umweltfaktoren einschliesslich Ernährungsgewohnheiten und Lebensstil. Das Magenkarzinomrisiko steigt mit zunehmendem Lebensalter.3–5
Die Progression der H.-pylori-Gastritis hin zur möglichen Entwicklung eines Magenkarzinoms erlaubt, den malignen Prozess durch H.-pylori-Eradikation zu stoppen. Diese Massnahme ist am effektivsten zu einem Zeitpunkt, bevor sich die H.-pylori-Gastritis in einem fortgeschrittenen Stadium der atrophischen Gastritis befindet.5–7
Bei Patienten mit bereits bestehender schwerer atrophischer Gastritis mit intestinaler Metaplasie bleibt auch nach erfolgreicher H.-pylori-Eradikation ein unterschiedlich hohes Restrisiko für die Entwicklung eines Magenkarzinoms bestehen und erfordert aus diesem Grunde eine regelmässige endoskopisch-histologische Nachsorge. Dies bleibt unabdingbar auch bei Patienten nach endoskopischer Resektion eines Magenfrühkarzinoms.3,5,8
H.-pylori-«screen/test and treat»-Präventionsstrategien müssen verschiedenen klinischen Aspekten und Szenarien Rechnung tragen. Bei Personen mit einer Magenkarzinomanamnese in der Familie besteht ein zusätzlich erhöhtes Risiko und eine Testung auf das Vorliegen von H.pylori wird dringend empfohlen. In internationalen Konsensusmeetings wird eine generelle Testung auf H.pylori auch bei asymptomatischen Individuen, die in Regionen mit hoher Magenkarzinominzidenz leben, empfohlen.3,5 Überlegungen, das Screening auf H.pylori in allgemeine Präventionsmassnahmen aufzunehmen, finden zunehmend Berücksichtigung. Eine mögliche und auch günstige Option zur Magenkarzinomvorsorge bietet sich durch Testung auf H.pylori im Rahmen der Vorsorge des kolorektalen Karzinoms.3
Verschiedene diagnostische Methoden werden für die H.-pylori-«screen and treat»-Präventionsstrategie in Betracht gezogen. Prinzipiell wird den nichtinvasiven direkten Nachweisverfahren (UBT-Atemtest, Stuhl-Antigen-Test ) der Vorzug gegenüber endoskopisch basierten Methoden gegeben. Serologische Tests können ebenfalls zum Einsatz kommen, sollten aber bei Nachweis von H.-pylori-Antikörpern vor einer Eradikationstherapie durch eines der vorgenannten direkten Nachweisverfahren hinsichtlich einer bestehenden H.-pylori-Infektion bestätigt werden. Die Endoskopie bleibt auch in der Prävention bei speziellen Risikokonstellationen asymptomatischer Patienten unabdingbar.3,5
Herausforderung Antibiotikaresistenz
In der Behandlung der H.-pylori-Infektion liegt die besondere Herausforderung in der sich seit vielen Jahren abzeichnenden ständigen Zunahme der Antibiotikaresistenz, die im besonderen Masse zwei der wirkungsstärksten Antibiotika, Clarithromycin und Levofloxacin, betrifft. 2017 hat die WHO in die Prioritätsliste von antibiotikaresistenten pathogenen Keimen auch Clarithromycin-resistente H.-pylori-Stämme aufgenommen.9 In einer Metaanalyse unter Einbeziehung von 248 Studien wurde weltweit eine primäre Clarithromycin- Resistenzrate von 27% ermittelt.10 In Europa wurden in 10-Jahres-Abständen Studien durchgeführt, die letzte im Jahr 2018 mit primären H.-pylori-Resistenzraten von 21,4% für Clarithromycin, 15,8% für Levofloxacin und 38,9% für Metronidazol.11 Weitere und vergleichbare Daten zur Antibiotikaresistenz stammen vom Europäischen Register für H.-pylori-Management (Hp-EuReg).12,13 Aus diesen Zahlen leitet sich die naheliegende Empfehlung ab, bei Verwendung von Antibiotika mit hoher Resistenzrate vor dem Einsatz von Therapieschemata, die Clarithromycin, Levofloxacin und Metronidazol enthalten, eine Antibiotikaresistenztestung (ART) vorzunehmen. Aufgrund niedriger Resistenzraten gilt diese Erfordernis für Amoxicillin nicht. Resistenzraten für Amoxicillin liegen in den meisten europäischen Ländern um 1%. In einer aktuellen Analyse der zeitlichen Entwicklung der Antibiotikaresistenz bei Kindern bleibt die Amoxicillinresistenz auch weltweit mit 4% konstant niedrig.14
Die ART kann an H.-pylori-Bakterienkulturen oder direkt mittels molekularer Tests an Magenproben erfolgen. Wenig gesicherte Erfahrung liegt bisher auch über molekulare Tests an Stuhlproben vor.15 Obwohl sich die ART künftig zu einer wichtigen Strategie in der Auswahl von Antibiotika zur H.-pylori-Eradikation entwickeln wird, bleibt sie vorerst in der klinischen Praxis wegen der aufwendigen und selten durchgeführten H.-pylori-Bakterienkulturen sowie der begrenzten Verfügbarkeit, Kosten und nicht zuletzt wegen abrechnungstechnischer Unzulänglichkeiten von molekularen Testtechnologien selten eingesetzt.
Eine besondere und zunehmende Beachtung im Zusammenhang mit der H.-pylori-Antibiotikaresistenz gilt der Etablierung der «Antibiotic Stewardship». Dies kann idealerweise durch Teambildung von Gastroenterologen, Mikrobiologen und klinischen Pharmakologen erfolgen. Aufgaben umfassen die Erstellung einer genauen Diagnose und die korrekte Anwendung der Antibiotika und Begleitmedikation. Die Auswahl der Antibiotika richtet sich nach Antibiotikaresistenzmustern sowie therapeutischen Erkenntnissen aus klinischen Studien mit Berücksichtigung der angemessenen Dosierung und des Verabreichungsmodus. Der allgemeine Gesundheitszustand des Patienten, einschliesslich der Anpassung der Antibiotika an Leber- und Nierenfunktion, sowie potenzielle Wechselwirkungen mit anderen Medikamenten sollten in das Behandlungskonzept miteinfliessen. Eine optimale Einnahmedauer trägt dazu bei, die Resistenzentwicklung zu begrenzen, die Nebenwirkungen zu minimieren und die Compliance der Patienten zu verbessern.15
Therapieempfehlungen in der Praxis
Stand heute wird die Bismuth-haltige Quadrupeltherapie als Erstlinientherapie zur H.-pylori-Eradikation im internationalen Konsensus empfohlen.3,16 Dazu nimmt man für 10 Tage einen Protonenpumpeninhibitor (PPI; z.B. Omeprazol) und ein Kombinationspräparat (Pylera®), das ein Bismuthsalz, Tetracyclin und Metronidazol enthält. Bei korrekter Einnahme liegt der Therapieerfolg bei 90%. Mancherorts sind die Komponenten der Bismuththerapie nur als Einzelsubstanzen erhältlich, was eine Verlängerung der Therapiedauer auf 14 Tage erfordert. Als alternative Erstlinientherapie wird nach wie vor auch die PPI-basierte Tripeltherapie mit den beiden Antibiotika Clarithromycin und Amoxicillin geführt, allerdings sollte man die Anwendung dieser Therapie von zwei Voraussetzungen abhängig machen, entweder a) man schliesst die Clarithromycinresistenz beim einzelnen Patienten aus oder b) man wählt den empirischen Ansatz mit Überwachung der Antibiotikaresistenz in einer regionalen Gemeinschaft, die für Clarithromycin eine Resistenzlage von 15% nicht überschreiten sollte.3 Eine Überwachung der Antibiotikaresistenzentwicklung sollte auf regionaler Ebene fortlaufend bestehen.
Bei der Verschreibung von H.-pylori-Behandlungsschemata ist es auch sinnvoll der Vorgeschichte hinsichtlich Einnahme von Makrolid-, Quinolon- und Nitroimidazolantibiotika Rechnung zu tragen. Bereits zuvor verschriebene Medikamente sollten nicht zum erneuten empirischen Einsatz kommen. Auch das Herkunftsland des Patienten ist aufgrund unterschiedlicher globaler H.-pylori-Prävalenz- und Antibiotikaresistenz-Daten im Hinblick auf die Wahl der Eradikationstherapie zu beachten.
Levofloxacin-basierte Tripeltherapien werden nach Fehlschlagen der Erstlinientherapien in Betracht gezogen, aber aufgrund steigender Resistenzdaten sind sie mit zusätzlichen Caveat versehen und sollten nach Möglichkeit erst nach erfolgter Resistenztestung eingesetzt werden.
Amoxicillin bleibt aufgrund der nahezu vernachlässigbar niedrigen Resistenzrate ein wesentliches Antibiotikum in Eradikationsschemata und fester Bestandteil in Tripeltherapien.
Die pharmakologischen und pharmakodynamischen Eigenschaften von Amoxicillin erfordern eine Anhebung des pH-Werts im Magen auf möglichst nahe pH6, um einen maximalen Eradikationseffekt von H.pylori zu erzielen. Wenn ein Anstieg des pH-Werts im Magen nahe oder über pH6 erreicht wird, befördert dies das Wachstum von H.pylori und macht den Keim in der Wachstumsphase vulnerabler; gleichzeitig wird durch den hohen pH-Wert die Bioverfügbarkeit und Wirksamkeit der Antibiotika im Magen erhöht. Dadurch wurde auch der Grundstein für die Entwicklung der dualen Therapien gelegt. Die hoch dosierte PPI-Therapie mit Amoxicillin ist nach wie vor eine effektive Therapie zur H.-pylori-Eradikation, auch wenn sie ihren Platz nicht in der Erstlinientherapie findet.3,4,16
Eine Weiterentwicklung der dualen PPI-Amoxicillin-Therapie ist die Kombination von P-CAB («potassium-competitive acid blockers») mit Amoxicillin. Die stärker ausgeprägte säuresupprimierende Wirkung dieser neuen Substanzklasse hat zu einem höheren Eradikationeffekt geführt.17,18 Bislang stehen P-CAB in Europa noch nicht zur allgemeinen Verfügung.
Der Einsatz von ausgewählten Probiotika erfolgt derzeit als Ergänzung zur antibiotikabasierten Standardtherapie und ist fallbezogen indiziert. Probiotika führen zu einer signifikanten Reduktion von insbesondere gastrointestinalen Nebenwirkungen infolge der H.-pylori-Standardtherapie und können dadurch aufgrund der möglichen verbesserten Compliance zu einem geringfügig verbesserten Eradikationseffekt beitragen.3,4 Das Potenzial der probiotischen Medizin, sich künftig als Therapie zur Heilung der H.-pylori-Infektion einzubringen, wird derzeit in Studien ausgelotet. Unter dem Motto «microbial fighters» als Gegenentwurf zu Antibiotika können selektive Probiotika auf vielfältige Funktionen wie Stärkung des Immunsystems, Bildung von kolonisierungshemmenden Faktoren und Bakteriocine zurückgreifen, um H.pylori in seinem Habitat, dem menschlichen Magen, den Kampf anzusagen.
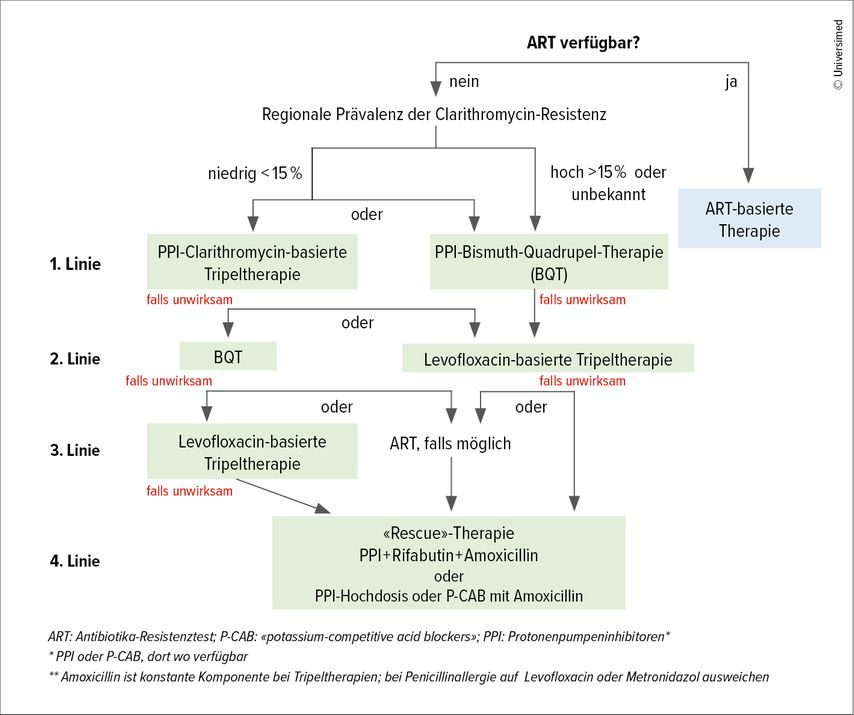
Es wird empfohlen, bei jedem Patienten nach H.-pylori-Eradikation eine Kontrolle des Therapierfolges 4 bis 8 Wochen nach Beendigung der Behandlung durchzuführen. Bevorzugt wird der nichtinvasive 13C-Harnstoff-Atemtest (alternativ Antigenbestimmung im Stuhl) durchgeführt, wobei beachtet werden muss, dass PPI mindestens 2 Wochen und Antibiotika 4 Wochen vor Durchführung des Tests abgesetzt werden müssen. Bei nicht erfolgreicher Erstlinientherapie wird ein Vorgehen wie im Algorithmus (Abb.2) dargestellt empfohlen.1
Literatur:
1 Chen YC et al.: Global prevalence of helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterol 2024; 166: 605-19 2 Sugano K et al.: Kyoto global consensus report on Helicobacter pylori gastritis. Gut 2015; 64: 1353-67 3 Malfertheiner P et al.; European Helicobacter and Microbiota Study group: Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut 2022; gutjnl-2022-327745 4 Malfertheiner P et al.: Helicobacter pylori infection. Nat Rev Dis Primers 2023; 9: 19 5 Liou JM et al.: Screening and eradication of Helicobacter pylori for gastric cancer prevention: the Taipei global consensus. Gut 2020; 69: 2093-112 6 Rugge M et al.: RE.GA.IN.: the Real-world Gastritis Initiative-updating the updates. Gut 2024; 73: 407-41 7 Ford AC et al.: Helicobacter pylori eradication therapy to prevent gastric cancer: systematic review and meta-analysis. Gut 2020; 69: 2113-21 8 Dinis-Ribeiro M et al.: The road to a world-unified approach to the management of patients with gastric intestinal metaplasia: a review of current guidelines. Gut 2024; 73: 1607-17 9 World Health Organization: List of bacteria for which new antibiotics are urgently needed. 2017. http://www.who.int/mediacentre/news/releases/2017/bacteriaantibiotics-needed ; zuletzt aufgerufen am 15.1.2025 10 Sholeh M et al.: The prevalence of clarithromycin-resistant Helicobacter pylori isolates: a systematic review and meta-analysis. Peer J 2023; 11: e15121 11 Megraud F et al.: Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut 2021; 70: 1815-22 12 Bujanda L et al.; The Hp-EuReg Investigators: Antibiotic resistance prevalence and trends in patients infected with Helicobacter pylori in the period 2013-2020: results of the European Registry on H. pylori Management (Hp-EuReg). Antibiotics 2021; 10: 1058 13 Bujanda L et al.: Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut 2021; 70: 1815-22 14 Salahi-Niri A et al.: Global prevalence of Helicobacter pylori antibiotic resistance among children in the world health organization regions between 2000 and 2023: a systematic review and meta-analysis. BMC Med 2024; 22: 598 15 Moss SF et al.: Evolving concepts in Helicobacter pylori management. Gastroenterol 2024; 166: 267-83 16 Chey WD et al.: ACG Clinical Guideline: Treatment of Helicobacter pylori infection. Am J Gastroenterol 2024; 119: 1730-53 17 Hu Y et al.: Effects of amoxicillin dosage on cure rate, gut microbiota, and antibiotic resistome in vonoprazan and amoxicillin dual therapy for Helicobacter pylori: a multicentre, open-label, non-inferiority randomised controlled trial. Lancet Microbe 2024; 100975 18 Jiang Y et al.: P-CAB versus PPI in the eradication of Helicobacter pylori: a systematic review and network meta-analysis. Therap Adv Gastroenterol 2024; 17: 17562848241241223
Das könnte Sie auch interessieren:
Neue Therapieoption für die eosinophile Ösophagitis
Am Jahreskongress der Schweizerischen Gesellschaft für Gastroenterologie (SGG) in Interlaken stellte Prof. Dr. med. Luc Biedermann, Leitender Arzt an der Klinik für Gastroenterologie und ...
Welche Substanzen könnten sich als Gamechanger erweisen?
Ein spannender Vortrag zum Thema «New drugs on the horizon» fand am letzten Tag der UEG (United European Gastroenterology) Week in Wien statt. Darin wurden der Stellenwert der bislang ...
Nobelpreisträger hält Keynote-Rede
1984 zeigten Barry Marshall und Robin Warren in einer bahnbrechenden Publikation in The Lancet, dass sich bei fast allen Patient:innen mit Gastritis, Magen- oder Duodenalulkus ein ...