Botulinumtoxin in der Neurorehabilitation
Autor:
Dr. Richard Friedrich Radlberger
Universitätsklinik für Neurologie
Neurologische Intensivmedizin und Neurorehabilitation der PMU Salzburg
E-Mail: r.radlberger@salk.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Seit der Entdeckung der Wirkungsweise des Botulinumtoxins wird dieses bei diversen medizinischen Indikationen erfolgreich eingesetzt, so auch im Bereich der Neurorehabilitation. Die optimale Dosisfindung ist trotz wachsender Evidenz immer noch stark von der ärztlichen Expertise, der Art der Erkrankung und den individuellen Bedürfnissen der Patienten abhängig.
Keypoints
-
Die Behandlungsintervalle liegen meist zwischen 10 und 16 Wochen (gelegentlich bis 6 Monate).
-
Die Hochdosisbehandlung mit IncobotulinumtoxinA ist bis 1200MU in Studien beschrieben. Sorgen bzgl. systemischer Nebenwirkungen oder Antikörperbildung konnten verworfen werden.
-
Das Injektionsschema ist individuell je nach Erkrankung sowie den Bedürfnissen der Patienten und (noch) stark auf der Experteneinschätzung basierend.
-
Für die korrekte Applikation wird die Injektion EMG- oder Ultraschall-gestützt empfohlen.
Seit dem ersten Einsatz in der Strabismusbehandlung Ende der 70er-Jahre des vergangenen Jahrhunderts ist Botulinumtoxin durch die breite Verwendung in der Schönheitsindustrie bekannt geworden. Da immer mehr Anwendungsgebiete in teils anders schwierig zu handhabenden Indikationen erfolgreich erprobt wurden, gewann es in den letzten Jahrzehnten aber auch in der Neurorehabilitation zunehmend an Bedeutung. In diesem Artikel sollen ein kurzer Abriss über das Medikament und Einblicke in den Einsatz im Bereich der Neurorehabilitation gegeben werden.
Steckbrief des Toxins: eine historische Entdeckung
Erstmalig erwähnt wurde der Effekt von Botulinumtoxin Anfang des 19. Jahrhunderts durch Justinus Kerner als „Fettgift“ in geselchten Würsten. Dabei beschrieb er den Symptomkomplex, den wir heute als Botulismus bezeichnen, wobei er weder auf die Entstehung des Toxins noch auf dessen Pathophysiologie einging. Dafür dachte er bereits an eine Verwendung des auslösenden Stoffes bei Überaktivität der Muskulatur und einer Hyperexzitabilität des sympathischen Nervensystems.1
Der verantwortliche Erreger wurde etwa 75 Jahre später von Emile van Ermengem als Bacillus botulinum entdeckt und benannt.2 Nach der Jahrhundertwende sollte er aufgrund seiner Spindelform den heute gebräuchlichen Namen Clostridium botulinum erhalten. Mitte des 20. Jahrhunderts gelang es Edward Schantz und seinem Team erstmalig, das Toxin in Reinform zu isolieren, zu kristallisieren und schließlich in größeren Mengen für Forschungszwecke zu synthetisieren.3
Nach einigen Tierversuchen in den 1970er-Jahren kam es schließlich zum ersten therapeutischen Einsatz bei Menschen mit Strabismus4 und 1989 zur Zulassung in den Indikationen Strabismus, Blepharospasmus und hemifazialer Spasmus. Inzwischen findet Botulinumtoxin in verschiedenen Indikationen und in beinahe jeder Fachdisziplin der Medizin Anwendung.
Toxinstruktur und Serotypen in der klinischen Anwendung
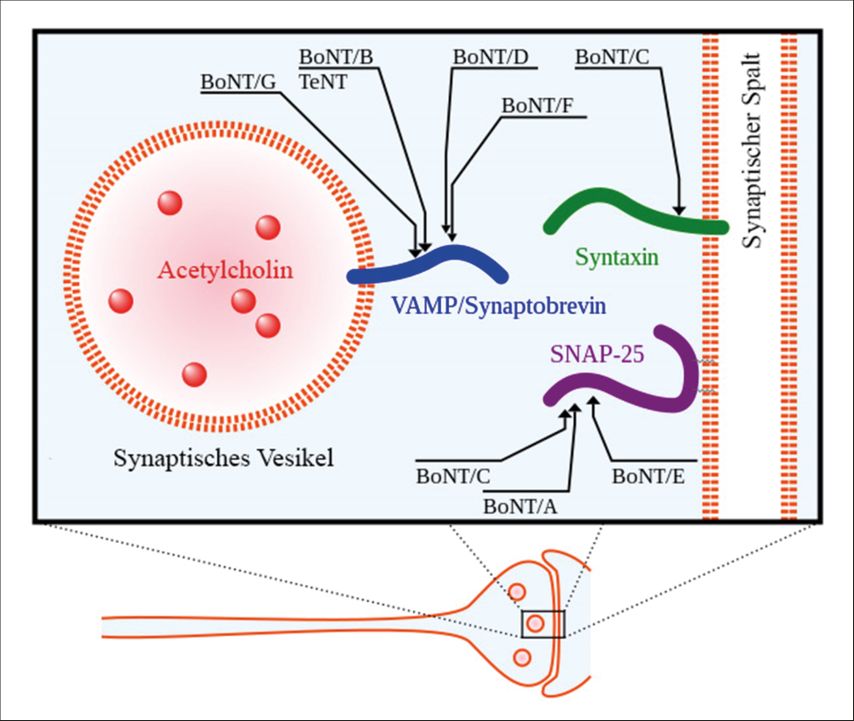
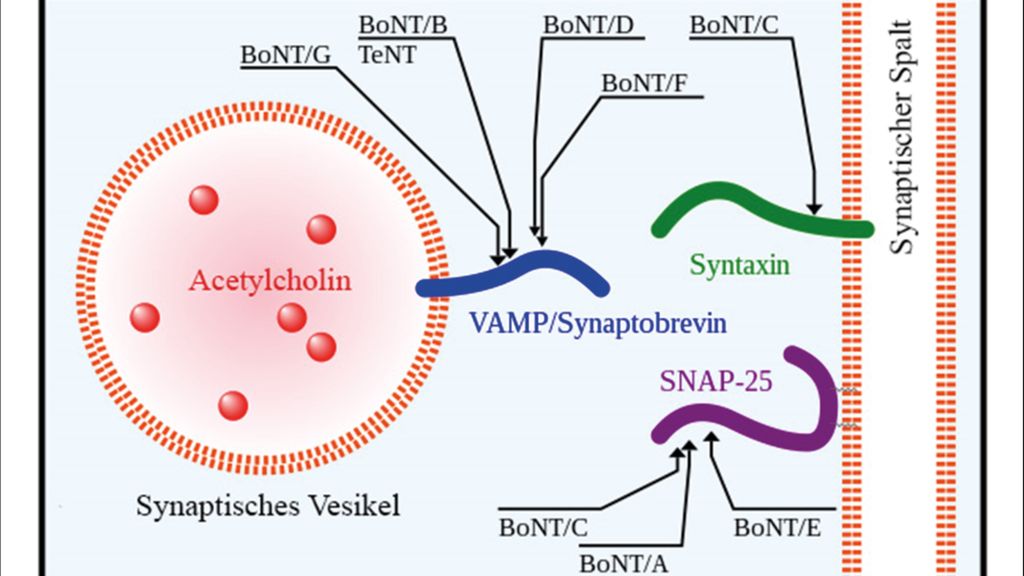
Das Toxin besteht aus zwei Untereinheiten. Die schwere Kette dient hierbei der Aufnahme in die Zelle und um die leichte Kette an den endoplasmatischen Bereich des synaptischen Spalts zu bringen.5 Dort abgegeben bindet diese je nach Serotyp an eines der SNARE-Proteine („soluble N-ethylmaleimide sensitive fusion protein attachment receptor proteins“), wie in Abbildung 1 ersichtlich, und verhindert durch Spaltung des Proteins die Bildung des SNARE-Komplexes, wodurch die Ausschüttung von Acetylcholin in den synaptischen Spalt unterbunden wird.6
Abb. 1: Ansatzpunkte der verschiedenen Serotypen (BoNT/A–G) an den SNARE-Proteinen. Hier abgebildet sind VAMP („vesicle-associated membrane protein“)/Synaptobrevin, Syntaxin und „synaptosomal-associated protein“ (SNAP) 25 (adaptiert mit einer Creative-Commons[CC]-Lizenz nach Y tambe – CC BY-SA – Version 4.0)
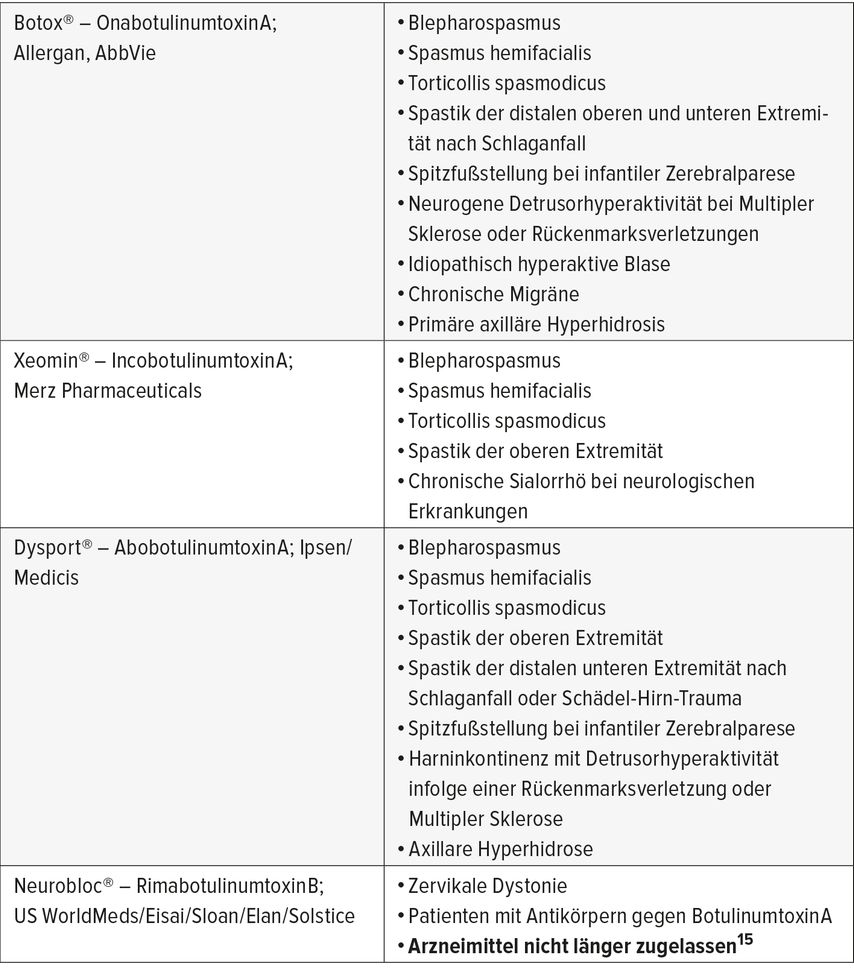
Von den insgesamt acht bekannten Serotypen werden in der Klinik lediglich das ToxinA, Botox® („OnabotulinumtoxinA“), Allergan, AbbVie, Xeomin® („IncobotulinumtoxinA“), Merz Pharmaceuticals, Dysport® („AbobotulinumtoxinA“), Ipsen/Medicis, respektive ToxinB und Neurobloc® („RimabotulinumtoxinB“), US WorldMeds/Eisai/Sloan/Elan/Solstice, verwendet (Tab. 1). Diese unterscheiden sich zum Beispiel in der Immunogenität und der zu verwendenden Dosierung gemessen an der biologisch aktiven Einheit (Mouse Unit – MU). Dabei gibt es über etwaige Äquivalenzdosen keine guten Daten. Als Richtwert wird in manchen Lehrbüchern ein Umrechnungsfaktor von 1:1:3 bis 1:1:5 von Botox®:Xeomin®:Dysport® angegeben.7 Als pragmatischer Ansatz kann auch ein Faktor 1:1:2,5 entsprechend den verfügbaren Durchstechflaschen erwogen werden.
Tab. 1: In Österreich zugelassene Indikationen per Toxin (nach Hufschmidt A et al., 2022)7 und in Österreich nicht länger zugelassene Arzneimittel (siehe dazu Agency EM, 2023)15
Einsatzgebiete in der Neurorehabilitation
In der Neurologie sind Bewegungsstörungen wie ein Blepharospasmus, verschiedene Formen der Dystonie oder auch Tremores eines der Haupteinsatzgebiete. In der Neurorehabilitation stehen wiederum die Behandlung von Plus- oder positiven Phänomenen der Spastik und die Therapie der Hypersalivation im Vordergrund.
Behandlung des spastischen Syndroms
Die Ätiologie einer Spastik kann divers sein, und so ist es auch in der Behandlung mittels Botulinumtoxin. Besonderes Augenmerk sollte hierbei auf die körperliche Untersuchung im Rahmen der initialen Vorstellung und der ersten Kontrolltermine gelegt werden. Sowohl die Einschätzung des Musters der von der Spastik betroffenen Muskulatur als auch die Dosisfindung sind trotz wachsender Evidenz weiterhin die Kunst in der Behandlung mit Botulinumtoxin. Dies gilt ebenso für die Anpassung des Schemas insbesondere am Beginn der Therapie.
In unserer Klinik haben wir beispielsweise die Erfahrung gemacht, dass bei einer Tonuserhöhung aufgrund einer traumatischen Läsion des Rückenmarks oftmals eine höhere Dosis je Muskel und Gesamtdosis je Injektionstermin benötigt wird als bei einer Tonuserhöhung auf Basis etwa einer Multiplen Sklerose. Auch das Therapieziel sollte immer an die individuellen Bedürfnisse der betroffenen Person adaptiert werden. Für einen Menschen nach einem Schlaganfall, welcher die verbliebene Halte- und Greiffunktion der paretischen Hand zum Ankleiden benötigt, macht es einen großen Unterschied, ob diese Restfunktion durch eine „zu hohe“ Dosis, wenn auch nur passager, verloren geht. Diesbezüglich verwenden wir, wie auch bei der Behandlung einer aktionsinduzierten Dystonie, eher eine niedrigere Dosis bei der Erstinjektion. Analog dem Motto „Start low, go slow“ kann bei Bedarf im weiteren Verlauf schrittweise die Dosis gesteigert werden.
Bei entsprechend beträchtlicher Schädigung wie einem malignen Mediasyndrom oder einem schweren Schädel-Hirn-Trauma ohne residuelle Restfunktion der betroffenen Extremität stehen oft Reduktion der spastikassoziierten Schmerzen, Kontrakturprophylaxe oder Vereinfachung der Körperhygiene im Fokus.
Durch Lockerung der betreffenden Muskulatur sollte etwa die Zugänglichkeit bei Adduktion der Arme im Bereich der Achsel, bei Flexion der Finger im Bereich der Handfläche oder bei Adduktion der Beine im Intimbereich erleichtert werden. In diesen Fällen kann auch gleich initial eine Dosis im oberen empfohlenen Bereich (siehe diverse anatomische Atlanten zur Botulinumtoxininjektion) angedacht werden.
Initiale Sorgen über systemische Nebenwirkungen oder Antikörperbildung konnten durch die Arbeitskreise um Dressler8 und Wissel9, welche das Sicherheitsprofil von Injektionen in hohen Dosen bis 1200MU IncobotulinumtoxinA beschrieben, zerstreut werden. Zu erwarten ist das Erreichen der Wirkung innerhalb der ersten ein bis zwei Wochen nach Injektion, welche bei Ansprechen meist im Intervall zwischen 10 und 16 Wochen aufgrund des Abbaus des Toxins wiederholt werden muss.
Neben der Mustererkennung und der Dosisfindung sollte auch die korrekte Applikation in den Zielmuskel beachtet werden. Hierfür können die tradierten anatomischen Orientierungspunkte herangezogen werden. Seitens verschiedener Arbeitsgruppen und Expertengremien wird mittlerweile eine Injektion unter Zuhilfenahme einer geführten Injektionstechnik empfohlen. Zur Verfügung stehen einerseits eine Unterstützung bei der Identifikation der Zielstruktur mittels Elektromyografie (EMG), welche, exemplarisch genannt, bei Dystonie kleinster Muskeln, wie bei Affektion der oromandibulären Muskulatur, den direkten Nachweis der pathologischen Muskelkontraktion und somit die korrekte Auffindung der betroffenen Muskulatur bestätigen kann. Andererseits haben wir die Ultraschall-gezielte Injektion, welche es erlaubt, nicht nur den Muskel zu identifizieren, sondern auch andere Strukturen, wie etwa Gefäße, um bei Injektionen insbesondere in tiefer liegenden Arealen Komplikationen zu vermeiden.
Behandlung der Sialorrhö
Acetylcholin vermittelt, wie oben beschrieben, die neuromuskuläre Überleitung, hat aber auch als Transmitter des Parasympathikus eine stimulierende Wirkung auf die Sekretion der Speicheldrüsen.10 Bei Injektion in die großen Mundspeicheldrüsen kann dies zur Behandlung eines relativen Speichelüberflusses, geschuldet einer Überproduktion oder – in der Neurorehabilitation häufiger – einem fehlenden Abschlucken, genutzt werden. Ätiologisch denken wir hier an Erkrankungen wie den Morbus Parkinson, die Motoneuronerkrankungen oder den Schlaganfall, bei welchen sich als Symptom etwa ein Speichelausfluss zeigt.
Die Injektion erfolgt dabei in die beiden paarig angelegten Glandulae (Gl.) parotideae und Gl. submandibulares. Insbesondere bei den Gl. submandibulares ist es trotz etablierter anatomischer Marken empfohlen, zur Differenzierung des Drüsengewebes von den umliegenden Muskeln Ultraschall-gestützt zu injizieren, um eine iatrogene Schwäche der Kau- und Schluckmuskulatur zu vermeiden.11 Die Gl. sublinguales sind in ihrer Bedeutung für das Speichelvolumen vernachlässigbar und werden daher üblicherweise nicht injiziert. IncobotulinumtoxinA wurde im Rahmen der Zulassungsstudie12 bei Injektion von jeweils 30MU in jede Gl. parotis und jeweils 20MU in jede Gl. submandibularis, entsprechend kumulativ 100MU, erfolgreich getestet. Die Zahl der Injektionsstellen hängt üblicherweise von der Experteneinschätzung und der Größe der Drüse bei Aufsuchen mittels Ultraschall ab.
Verglichen mit etablierten medikamentösen Therapien über Tropfen, Tabletten oder Transdermalpflaster ist hier die alleinige lokale Wirkung vorteilhaft, da bei korrekter Applikation keine systemische Wirkung respektive Nebenwirkung zu erwarten ist. Weiters ist bei gutem Ansprechen die nächste Behandlung meist erst in etwa drei bis sechs Monaten wieder notwendig und ist im Gegensatz zur Bestrahlung reversibel.
Ausblick: verstärkter Einsatz auch in der Schmerztherapie
In den letzten Jahren wurde zunehmend auch ein Einsatz von Botulinumtoxin in der Schmerztherapie erprobt. Hierfür besteht eine Zulassung für OnabotulinumtoxinA in der Migränebehandlung. Untersucht wird aktuell der Einsatz im Bereich der chronischen neuropathischen Schmerzen, wie etwa einer Trigeminus- oder Okzipitalisneuralgie, bei einer postherpetischen, postoperativen oder auch diabetogenen Neuralgie nebst einigen anderen Schmerzsyndromen.13
Hierbei erfolgt die Injektion meist subkutan oder intradermal in niedriger Dosis um den Bereich von Triggerpunkten, so vorhanden, oder ähnlich einem Schachbrettmuster verteilt im betroffenen Areal. Andere Arbeitsgruppen untersuchen die Injektion um die Nerven selbst.14 Beide Ansätze zeigen in ersten Studien bisher gute Ergebnisse, sodass aus heutiger Sicht die Injektion von Botulinumtoxin in den nächsten Jahren als Ergänzung zum bestehenden therapeutischen Angebot erwartet werden darf.
Literatur:
1 Kerner J: Das Fettgift, oder die Fettsäure, und ihre Wirkungen auf den thierischen Organismus: Ein Beytrag zur Untersuchung des in verdorbenen Würsten giftig wirkenden Stoffes. Stuttgart und Tübingen: Cotta, 1822 2 Van Ermengem E: Ueber einen neuen anaeroben Bacillus und seine Beziehungen zum Botulismus. Leipzig: Veit, 1897 3 Jabbari B: History of botulinum toxin treatment in movement disorders. Tremor Other Hyperkinet Mov (N Y) 2016; 6: 394 4 Scott AB: Botulinum toxin injection into extraocular muscles as an alternative to strabismus surgery. J Pediatr Ophthalmol Strabismus 1980; 17: 21-5 5 Pickett A: Dysport®: pharmacological properties and factors that influence toxin action. Toxicon 2009; 54(5): 683-9 6 Rossetto O et al.: Botulinum neurotoxins. Toxicon 2013; 67: 31-6 7 Hufschmidt A et al. (Hrsg.): Neurologie compact. 9., vollständig überarbeitete Auflage. Stuttgart: Thieme, 2022 8 Dressler D et al.: Safety aspects of incobotulinumtoxinA high-dose therapy. J Neural Transm 2015; 122(2): 327-33 9 Wissel J et al.: Safety and efficacy of incobotulinumtoxinA doses up to 800U in limb spasticity: the TOWER study. Neurology 2017; 88: 1321-8 10 Pape HC et al.: Physiologie (Silbernagl). 9. Auflage. Stuttgart: Thieme, 2014 11 Jost WH et al.: Therapie der Sialorrhoe mit Botulinumtoxin – ein Update. Fortschr Neurol Psychiatr 2022; 90(5): 222-32 12 Jost WH et al.: SIAXI: placebo-controlled, randomized, double-blind study of incobotulinumtoxinA for sialorrhea. Neurology 2019; 92(17): e1982-e1991 13 Park J et al.: Botulinum toxin for the treatment of neuropathic pain. Toxins (Basel) 2017; 9(9): 260 14 Moon YE et al.: Ultrasound-guided nerve block with botulinum toxin type A for intractable neuropathic pain. Toxins (Basel) 2016; 8(1): 18 15 Agency EM: Verfügbar unter: https://www.ema.europa.eu/en/medicines/human/EPAR/neurobloc (letzter Zugriff: 25.7.2023)
Das könnte Sie auch interessieren:
Alzheimer: Was gibt es Neues in der Biomarker-Entwicklung?
Schätzungen zufolge leben in Österreich 115000 bis 130000 Menschen mit einer Form der Demenz. Eine Zahl, die sich bis zum Jahr 2050 verdoppeln wird.1 Antikörper-Wirkstoffe könnten in der ...
Kappa-FLC zur Prognoseabschätzung
Der Kappa-freie-Leichtketten-Index korreliert nicht nur mit der kurzfristigen Krankheitsaktivität bei Multipler Sklerose, sodass er auch als Marker zur Langzeitprognose der ...
Fachperson für neurophysiologische Diagnostik – Zukunftsperspektiven eines (noch) unterschätzten Berufes
Die Aufgaben der Fachperson für neurophysiologische Diagnostik (FND) haben sich in den letzten Jahren verändert. Dies geht zum einen mit den erweiterten Diagnostikmöglichkeiten und zum ...