Periphere Nervenchirurgie: Warum ist der Faktor Zeit so wichtig?
Autoren:
Dr. Veith L. Moser1,2
PD Dr. Stefan Salminger, PhD1
Dr. Andreas Gohritz3
PD Dr. Gerd Bodner2
PD Prim. Dr. Thomas Hausner1
1 Lorenz-Böhler-Unfallkrankenhaus Wien
2 Wiener Nervenschmerzzentrum
3 Plastische, Rekonstruktive und Ästhetische Chirurgie, Handchirurgie
Universitätsspital Basel
Korrespondierender Autor:
Dr. Veith L. Moser
E-Mail: vm@medspa.cc
Die verzögerte oder falsche Behandlung peripherer Nervenverletzungen kann zu bleibenden Beeinträchtigungen bis hin zum Funktionsverlust führen. Daher ist die interdisziplinäre Zusammenarbeit gemeinsam mit neuen technologischen Entwicklungen in der Bildgebung wegweisend für eine rasche und präzise Diagnosestellung und Voraussetzung für chirurgische Behandlungsmöglichkeiten.
Keypoints
-
Die moderne periphere Nervenchirurgie umfasst sowohl die Versorgung traumatischer Verletzungen als auch die Behandlung von Kompressionssyndromen und neuropathischen Schmerzen.
-
Der Behandlungserfolg hängt wesentlich von einer engen interdisziplinären Zusammenarbeit ab – der Faktor Zeit ist für den Therapieerfolg entscheidend.
-
Voraussetzung für ein gutes funktionelles Ergebnis ist eine rasche und gezielte Diagnose. Je eher die Behandlung begonnen wird, desto besser sind die Erfolgsaussichten.
-
Die Weiterentwicklung bildgebender Diagnostik erlaubt früh exakte Aussagen über den Istzustand von Nerven. So kann oft eher entschieden werden, ob operativ vorgegangen werden sollte.
-
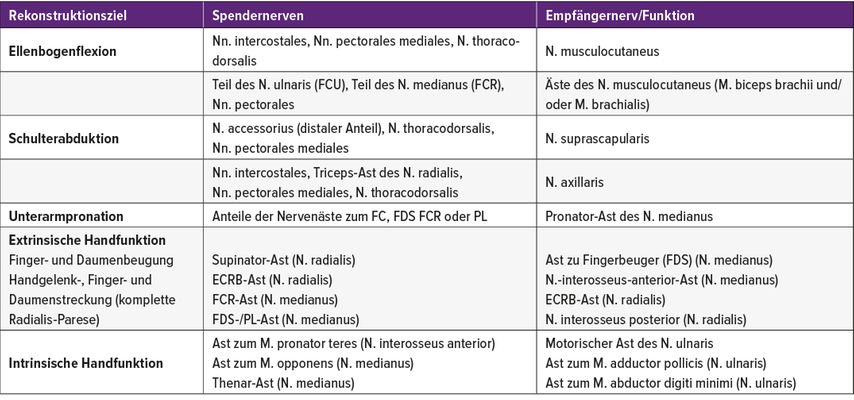
Neuartige Nerventransfers bieten die Möglichkeit, durch einen Kurzschluss zwischen intaktem verzichtbarem Spender- und gelähmtem Empfängernerv die Regenerationsstrecke und -zeit zu verkürzen und so den zeitabhängigen Abbau motorischer Endplatten zu vermindern.
-
Bei chronischen Neuropathien kann eine zeitnahe chirurgische Behandlung das Risiko für schwere funktionelle und psychosoziale Beeinträchtigungen vermindern. In der Neuromchirurgie werden ablative und neue rekonstruktive Techniken unterschieden.
Anatomische Grundlagen
Hinsichtlich der Grundstruktur eines Nervs spielen folgende Einheiten eine wesentliche Rolle: das externe Epineurium, das interne Epineurium und Endoneurium sowie das Perineurium. Die Axone bilden zusammen mit den Schwannzellen die Grundeinheit des peripheren Nervensystems. Grundsätzlich wird zwischen myelinisierten und nichtmyelinisierten Axonen unterschieden. Periphere Nervenstämme werden in bestimmten Abständen von Blutgefäßen versorgt. Diese ziehen dann durch eine feine Bindegewebsschicht (das Mesoneurium), die den Nervenstamm lose an das umliegende Gewebe anbindet. Jenes Mesoneurium ermöglicht es dem Nerv auch, während normaler Bewegungen zwischen den Gewebsschichten zu gleiten. Seitliche Abzweigungen der Blutgefäße verlaufen weiter vom Epineurium zum Perineurium, wo sie einen längsorientierten Plexus bilden.
Innerhalb eines gemischten sensomotorischen Nervs sind die sensiblen und motorischen Nervenfasern in bestimmten Faszikeln beziehungsweise Faszikelgruppen angeordnet. Die einzelnen Faszikel sind häufig innerhalb des Nervs plexusartig miteinander verbunden. Axone wechseln also im Verlauf des Nervs von einem Faszikel zum anderen. Die Häufigkeit dieser Wechsel liegt proximal höher und nimmt in distaler Richtung ab. Für den Chirurgen ist es deshalb sehr wichtig, auch die genaue interne Anatomie (Topografie) der Nervenbahnen in den verschiedenen Abschnitten zu kennen.
Traumatische Nervenverletzungen
Verletzungen peripherer Nerven treten zwar nur bei etwa 3% aller Traumapatienten auf, können bei verzögerter, falscher oder ausbleibender Behandlung aber zu lebenslangen Einschränkungen bis hin zum kompletten Funktionsverlust z.B. einer Gliedmaße führen. Der Nervenschaden und seine Konsequenzen hängen von Ausmaß, Art und Lokalisation der Verletzung sowie dem Alter des Patienten ab.
Nervenverletzungen werden in drei Schweregrade (nach Seddon) eingeteilt: Neurapraxie, Axonotmesis und Neurotmesis: Während es sich bei Neurapraxie nur um einen funktionellen Reizleitungsschaden mit Rückbildung von Sensibilitätsstörungen und motorischen Ausfällen innerhalb von Tagen bis Wochen handelt, kommt es bei Axonotmesis und Neurotmesis zu strukturellen Veränderungen. Bei der Axonotmesis bleiben die Bindegewebe bzw. die Nervenhüllstrukturen als Leitschiene für die Regeneration erhalten, die Axone allerdings haben keine Kontinuität mehr. Hier ist trotz Axonverlust eine zufriedenstellende Regeneration möglich. Allerdings kann eine starke intraneurale Fibrose auch zu einer Blockade der Axonregeneration und dadurch zum Ausbleiben der Regeneration führen. Bei der Neurotmesis sind nicht nur das Axon (Axonotmesis), sondern auch Myelinscheide und Peri- und Epineurium mehr oder weniger durchtrennt. Es findet keine spontane funktionelle Wiederherstellung statt, dieser Typ ist ausschließlich mit einer Bildung von Narbengewebe verbunden, sodass regeneratives Wachstum von Axonen ohne Operation erfolglos bleibt. In vielen Fällen entwickelt sich stattdessen ein Neurom am proximalen Nervenende oder auch ein Neuroma in continuitatem, das häufig im Zusammenhang mit spontanen neuropathischen Schmerzsymptomen auftritt.
Welche Auswirkungen hat ein Zeitverlust?
Die negativen Auswirkungen einer anhaltenden Nervenschädigung betreffen den Muskel, das periphere wie auch das zentrale Nervensystem:
Erhält ein Muskel keine nervale Stimulation mehr, ist mit einem Abbau von ca.1% seiner motorischen Endplatten zu rechnen. Nach einer Rekonstruktion addiert sich die Dauer, die der Nerv benötigt, um den Muskel wieder zu erreichen und zu reinnervieren. Summieren sich also der Zeitverlust bis zur Rekonstruktion und die anzunehmende Regenerationszeit (d.h. wie lange der Nerv benötigt, um von der Nahtstelle bis zum Muskel auszuwachsen) auf über 1,5 Jahre, ist eine Funktionswiederkehr sehr unwahrscheinlich, da mindestens 30% aller motorischen Endorgane reinnerviert sein müssen, um eine adäquate Funktion zu generieren. Zusätzlich kommt es zu reinnervationshemmenden Veränderungen des Perimysiums bzw. zu fettiger Degeneration.
Die Durchtrennung eines Axons kann das Absterben des Neurons innerhalb eines kritischen Zeitfensters nach der Verletzung induzieren, diese geschieht in unterschiedlicher Weise bei sensorischen und motorischen Neuronen. Eine frühzeitige Reparatur des Nervs scheint diesen Verlust von Neuronen zumindest reduzieren zu können. Wird die Regeneration von Axonen jedoch verzögert, hat dies einen Einfluss auf Schwannzellen im distalen Nervenende, die zunehmend die Fähigkeit verlieren, die verschiedenen Zelladhäsionsmoleküle und Wachstumsfaktoren zu exprimieren, die nötig sind, um eine funktionale Wiederherstellung zu unterstützen. Nach einer anhaltenden Denervierung des distalen Nervensegments reagieren Schwannzellen nicht mehr auf auswachsende Axone.
Anhaltende Denervierung führt auch zu ZNS-Veränderungen (z. B. Remapping von Kortexarealen), diese Plastizität hat daher maßgeblichen Einfluss auf die Regeneration sowie das Endergebnis nach Rekonstruktionen von Nervenverletzungen und ist zunehmend im wissenschaftlichen Fokus, z.B. hinsichtlich spezialisierter Konzepte zur Rehabilitation.
Weitere negative Effekte sind z.B. der Verlust sensibler Hautorgane und die Folgen chronischer neuropathischer Schmerzen, auf die später noch näher eingegangen wird.
Zweifelsfrei ist die Reparatur von Verletzungen des Neurotmesis-Typs die größte Herausforderung im Bereich der peripheren Nervenrekonstruktion.
Exakte Diagnosestellung ermöglicht eine frühzeitige Therapie
Das interdisziplinäre Zusammenspiel von Neurologen, Radiologen und Nervenchirurgen ist hierbei der Grundstein für eine erfolgreiche Erholung der beschädigten Nervenstrukturen, um die beste Wiedererlangung der Funktion zu erreichen. Die rasche Diagnose und richtige Therapie sind essenziell für den Erfolg der Nervenrekonstruktion. Sie basiert auf einer genauen Anamnese (bei Bedarf Rücksprache mit dem Erstbehandler) sowie einer eingehenden klinischen Untersuchung der sensiblen Dermatome sowie der motorischen Nervenfunktionen.
Die Prüfung der Berührungs-, Schmerz- und Temperaturempfindung schließt Verfahren wie die Zwei-Punkte-Diskrimination und den Semmes-Weinstein-Monofilament-Test zur genaueren Quantifizierung ein. Auch Veränderungen der Hauttrophik (Ausprägung der Leisten, Schweißsekretion, Behaarung etc.) können auf eine sensible Nervenschädigung hinweisen, dies hat allerdings bei frischen Verletzungen keine Aussagekraft. Die Lokalisation der Schädigung wird durch das sogenannte Hoffmann-Tinel-Zeichen bestimmt, das entsteht, wenn der verletzte Nerv in seinem Verlauf beklopft wird und dies unangenehme elektrisierende Missempfindungen auslöst, die in sein Versorgungsareal ausstrahlen.
Dieses Zeichen wird allerdings erst einige Wochen nach der Nervendurchtrennung auslösbar. Bei Verdacht auf ein Neurom sollte auch eine Probeblockade der Nervenleitung proximal des Hauptschmerzpunktes durchgeführt werden, die den Effekt einer Operation simuliert.
Hochauflösender Nervenultraschall – ideal zur Nervendiagnostik
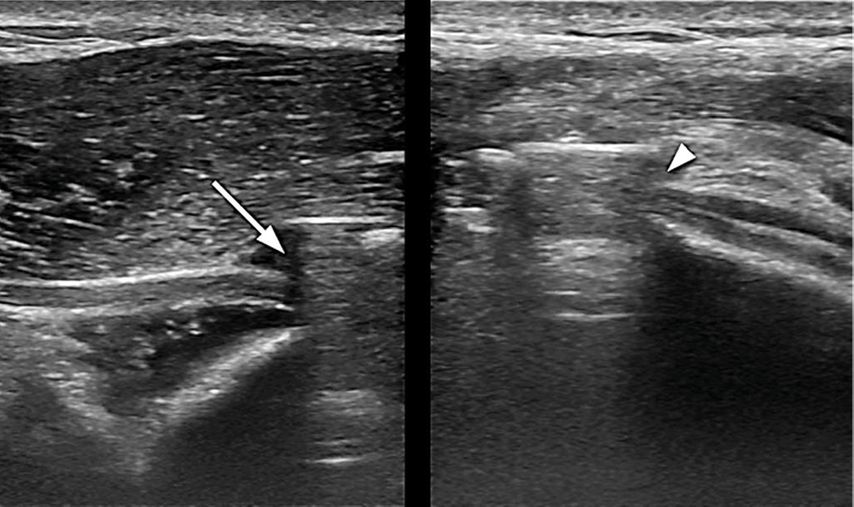
In den letzten Jahren hat sich als wichtiges diagnostisches Instrument der hochauflösende Nervenultraschall herauskristallisiert. In ähnlicher Weise bietet ebenso die MR-Neurografie völlig neue Möglichkeiten der frühzeitigen Diagnostik, sie steht aber nur selten zur Verfügung. Elektrophysiologische Untersuchungen können zusätzliche Hinweise geben, sie spielen aber vor allem im spätprimären und sekundären Abschnitt eine sehr wichtige Rolle, in der Akutphase (den ersten Wochen) ist wenig Information zu erwarten. Initial kann die Elektrodiagnostik eine vorhandene Neurapraxie (spontan und komplett reversibel) nicht verlässlich von einer strukturellen Nervenschädigung wie der Neurotmesis oder Axonotmesis unterscheiden. Im Gegensatz dazu kann der hochauflösende Ultraschall hier meist präzise Aussagen über die Struktur und Pathologie des Nervs treffen. Aufgrund der hohen Auflösung moderner Ultraschallsonden können sogar die Kontinuität und Qualität einzelner Nervenfaszikel zuverlässlich beurteilt werden (Abb. 1-3).
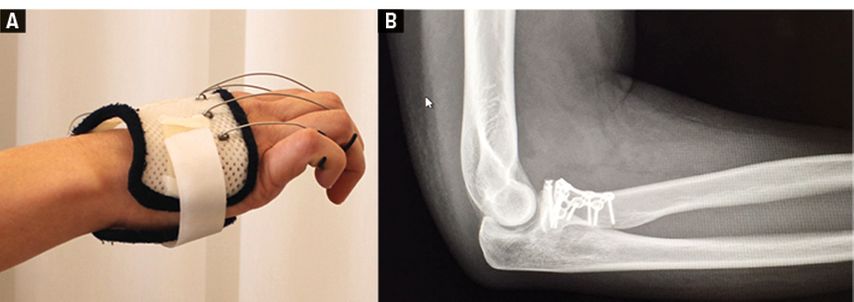
Abb. 1A und 1B: Unmittelbar postoperativ komplette Radialis-Parese nach Osteosynthese bei mehrfragmentärer Caput-radii-Fraktur
Abb. 2: Im hochauflösenden Nervenultraschall deutlich sichtbarer Abbruch der N.-radialis-Struktur; der Pfeil zeigt auf den Nerv unter der Platte, die Pfeilspitze markiert, wo der Nerv unter der Platte hervortritt
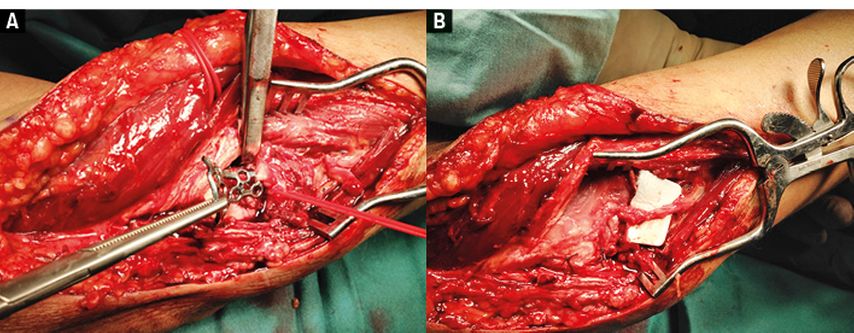
Abb. 3A und 3B: Intraoperativer Situs 2 Wochen später (A) mit sichtbarer Läsion des Nervus radialis unter der angebrachten Platte und (B) nach mikrochirurgischer Rekonstruktion mittels autologer Nerventransplantation (N.-suralis-Interposition), die zur kompletten Erholung von Handgelenks-, Finger- und Daumenstreckung führte
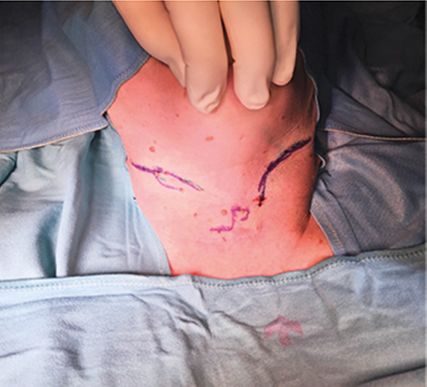
Abb. 4: Ultraschall-kontrollierte Markierung des Verlauf des Nervus transversus colli auf der Haut bei Patientin nach Trachektomie mit chronischen Nerventraktionsschmerzen bei Reklination des Halses und beim Schlucken – komplette Schmerzfreiheit nach Neuromresektion und intramuskulärer Relokation der Nervenstümpfe
Als besonderer Vorteil kann der betreffende Nerv ultraschallkontrolliert mit minimalen Mengen an Lokalanästhesie und sehr differenziert probeweise blockiert werden. Der genaue Verlauf kann auch auf der Haut markiert werden, was dem Operateur das Auffinden von Läsionen und Neuromen wesentlich erleichtert und die Operationszeit verringert (Abb. 4).
Primäre Therapie bei Nervenverletzung möglichst rasch und präzise stellen
Die primäre Rekonstruktion richtet sich nach Art und Ausmaß eines Nervenschadens. Bei sichtbaren morphologischen Schäden am Nerv, aber erhaltener Kontinuität (In-continuitatem-Läsion) ist je nach Ausmaß der Veränderung eine Epineurotomie oder die sparsame, aber suffiziente Anfrischung bis ins sichtbar vitale Nervengewebe indiziert. Kommt es zu einer Durchtrennung einzelner Faszikel oder des gesamten Nervs, ist die spannungsfreie Wiederherstellung der Kontinuität durch mikrochirurgische epineurale Nähte das Ziel. Dies kann entweder im Sinne einer Direktnaht oder bei Substanzverlust mittels Nerventransplantaten erfolgen. Körpereigene Spendernerven stellen weiterhin den Goldstandard in der Rekonstruktion von Nervendefekten dar, sind jedoch ein limitiertes Gut.
Bei kurzstreckigen Defekten an Fingernerven oder einem sensiblen Hautnerv kann die Rekonstruktion auch mittels autologer Vene erfolgen. Ebenso existiert eine Vielzahl an synthetischen Nervenersatzmaterialien, die eine Rekonstruktion ohne Hebedefekt versprechen. Selbst der Einsatz von allogenen Nerventransplantaten aus menschlichen Organspendern ist heute möglich.
Sekundäre Therapie bei Nervenverletzung – wann und was?
Nicht immer kann eine primäre Nervenrekonstruktion erfolgen. Zum Beispiel bleiben im Rahmen eines Polytraumas oder bei schweren Begleitverletzungen sehr oft Nervenverletzungen primär unversorgt. Ein weiteres Problem kann auch sein, dass die Nervenläsion primär nicht erkannt worden ist oder dass weder das technologische noch das chirurgische Know-how vorhanden ist.
Als weiterer Grund kann natürlich auch angesehen werden, dass die primäre Rekonstruktion zum Beispiel aufgrund von ausgedehnten Quetschverletzungen oder zu großen Weichteilschäden nicht von Erfolg gekrönt gewesen wäre.
Als Methoden für die Sekundäroperationen kommen in geeigneten Fällen para- und epineurale Neurolysen zur Anwendung, um funktionsbehinderndes Narbengewebe zu entfernen. Interfaszikuläre Neurolysen führen häufig zu neuerlichen Vernarbungen und werden daher kaum mehr angewandt. Stattdessen wird in ausgeprägten Fällen nicht nur das vernarbte Umgebungsgewebe, sondern auch der vernarbte Faszikel entfernt und eine Rekonstruktion mittels autologer Nerveninterponate durchgeführt.
An möglichen Nerventransplantaten stehen hier entbehrliche sensible Hautnerven zur Verfügung, z.B. Endäste des Nervus interossius anterior und posterior (vom Handgelenk), der Nervus cutaneus antebrachii medialis und lateralis am beugeseitigen Ober- und Unterarm oder für langstreckige Defekte der Nervus suralis vom Unterschenkel. Der schon angesprochene Einsatz von allogenen Nerventransplantaten (z.B. dezellularisierte Leichennerven von menschlichen Organspendern) ist theoretisch möglich, um eine weitere Spendermorbidität (mit erneutem Neuromrisiko) zu vermeiden. Die Kosten sind allerdings sehr hoch, sodass der autologen Nerventransplantation meist der Vorzug gegeben wird.
Innovative Nerventransfers
Einen steigenden Stellenwert in der sekundären Therapie haben auch die verschiedenen Formen des Nerventransfers (Nervenumlagerungen), die in den letzten 20 Jahren zunehmend in die Standardtherapie der Nervenchirurgie aufgenommen worden sind. Das Prinzip ist, durch extra-anatomischen „Kurzschluss“ (zwischen einem unverletzten motorischen oder sensiblen Spendernerv) eine geschädigte Nervenstrecke zu umgehen. Optimalerweise liegt der Spender näher am Zielorgan, sodass die proximale Nervenläsion in eine weiter distale verwandelt wird, um die Regenerationsstrecke und -zeit zu verkürzen und die Erfolgsaussichten der Rekonstruktion zu erhöhen. Nerventranspositionen wurden v.a. bei weit proximal gelegenen Läsionen der Stammnerven an der oberen Extremität angewendet. Typisches Beispiel ist die proximale Ulnarisläsion, bei der durch anatomische Rekonstruktion beim Erwachsenen realistisch keine Wiederherstellung der intrinsischen Handmuskulatur erwartet werden kann, weil aufgrund der langen Strecke bis zum Eintreffen der Axone die motorischen Endplatten verschwunden und die Muskeln nicht mehr reinnervierbar sind. Hier kann der Transfer des Endastes des Nervus interosseus anterior (versorgt den Musculus pronator teres) auf den motorischen Ramus profundus nervi ulnaris die Regenerationsstrecke von beispielsweise 60cm (Regenerationszeit 600 Tage) auf 5cm (Regenerationszeit 50 Tage) verringern und die Erfolgsaussichten wesentlich erhöhen (Tab.1). Nerventransfers sind ein äußerst innovatives Verfahren mit vielfältigen Anwendungsmöglichkeiten:
-
an der unteren Extremität (z.B. motorische Fasern des N. tibialis auf den N. peronaeus zur Wiederherstellung der Fußhebung)
-
bei Lähmungen von Hirnnerven (Fasern des N. hypoglossus oder N. massetericus auf den N. facialis)
-
bei Rückenmarkverletzungen (Wiederherstellung der Arm- und Handfunktion bei Tetraplegie)
-
Wiederherstellung sensibler Qualitäten, reichend vom Schutz vor Verletzung, Infekt und Organverlust (z.B. Cornea, Hand, Fußsohle) bis hin zu erogener Empfindsamkeit (z.B. Brust, Genitalbereich).
Liegt jedoch die Verletzung länger als ein Jahr zurück (je nach Strecke zwischen Spendernerv und Endorgan) oder sind bereits Zeichen der Muskelatrophie vorhanden, ist es meist nicht mehr sinnvoll, einen Nerventransfer durchzuführen.
In diesen Fällen verbleiben jedoch nach wie vor der Sehnentransfer (motorische Ersatzoperation) von gesunden Muskelsehneneinheiten auf die ausgefallenen Muskeleinheiten und eine freie funktionelle Muskelverpflanzung die einzigen Möglichkeiten für die Rekonstruktion.
Bewährte und neue Ansätze in der chirurgischen Neuromtherapie
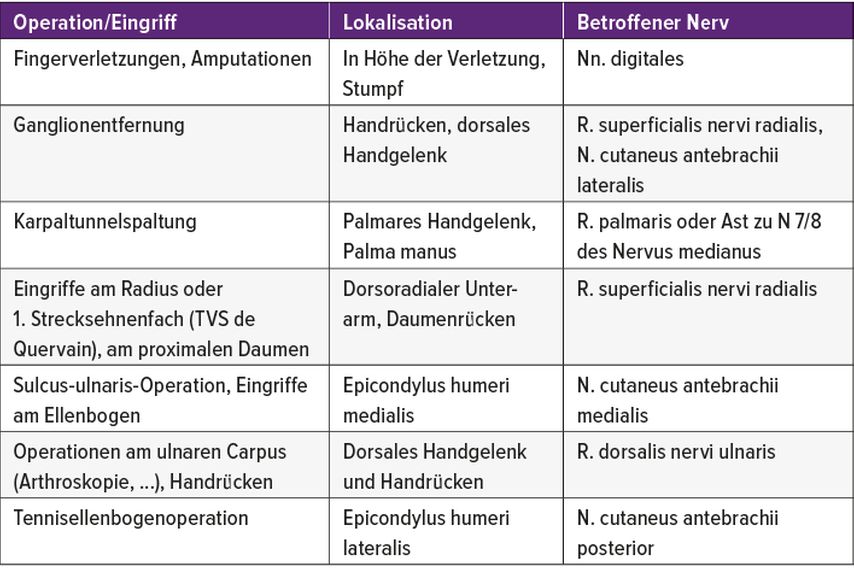
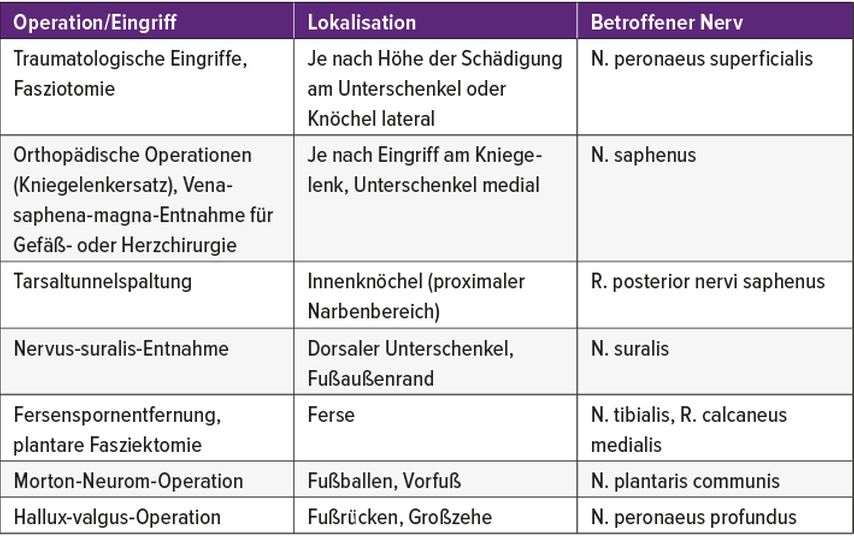
Bei jedem chirurgischen oder interventionellen Eingriff kann es zu Nervenschädigungen kommen, etwa durch eine Durchtrennung von Hautnerven beim Zugang, eine intraoperative akzidentielle Nervenschädigung oder eine ungünstige postoperative Vernarbung mit nachfolgenden Traktionsschmerzen. Besonders häufig sind Eingriffe an der oberen und unteren Extremität (Tab. 2 und 3). Entsprechend gehören Verletzungen von Nerven mit nachfolgenden chronischen Schmerzen als potenzielle Operationskomplikationen natürlich zur routinemäßigen präoperativen Aufklärung. Die auswachsenden Axone finden nicht immer ihr eigentliches Ziel, sondern können auch fibrotische Nervenfaserknäuel (Neurome) bilden. Diese können schmerzlos, kaum störend oder aber extrem schmerzhaft sein.
Tab. 2: Typische Ursachen/Lokalisationen von iatrogenen Nervenverletzungen und Neuromen an der oberen Extremität
Tab. 3: Typische Ursachen/Lokalisationen von iatrogenen Nervenverletzungen und Neuromen an der unteren Extremität
Neuromschmerzen lassen sich mittels genauer Anamnese und Untersuchung (inklusive Testblockade mit Lokalanästhesie) vom postoperativen Wundschmerz unterscheiden. Das Auftreten solcher neuropathischen Schmerzen sollte die entsprechende Kaskade der Diagnostik in Gang setzen, um möglichst zeitnah eine suffiziente Behandlung einzuleiten. Zunächst erfolgen konservative Maßnahmen, angefangen bei ergotherapeutischer Desensibilisierung und Spiegeltherapie bis hin zu professioneller Schmerztherapie durch erfahrene Neurologen oder Schmerztherapeuten bzw. Anästhesisten.
In der Literatur gibt es verschiedenste Möglichkeiten, Neurome chirurgisch zu behandeln. Grundsätzlich unterscheidet man zwischen kritischen Nerven mit unverzichtbarer, z.B. motorischer Funktion, die erhalten oder rekonstruiert werden sollten, und nicht kritischen Nerven, deren rein sensible Funktion zugunsten einer Schmerzreduktion aufgegeben werden kann.
Bei Neuromen motorischer Nerven ist eine autologe Nervenrekonstruktion gerechtfertigt, in manchen Fällen reicht auch nur ein partieller Ersatz einzelner funktionsloser Faszikel („split repair“) im Anschluss an eine interfaszikuläre Neurolyse. Bei Kontinuitätsneuromen mit aufgehobener Funktion und fehlender Regeneration erfolgen die Resektion des Neuroms und die Kontinuitätswiederherstellung mit autologen Nerveninterponaten.
Bei „nicht kritischen“ (verzichtbaren), also z.B. rein sensiblen Hautnerven wird in der Regel das schmerzhafte Neurom entfernt und der proximale Nervenstumpf entweder direkt in einen Muskel, in eine Vene oder zum Beispiel an der Hand oder am Fuß in einen Knochen verlagert. Jede Nervenrückkürzung führt allerdings immer zu einer neuerlichen Neurombildung (Rezidiv). Je nachdem, wo das neuerliche Neurom zu liegen kommt, möglichst außerhalb von mechanischen Belastungszonen, ist mit einer Besserung der Schmerzsituation zu rechnen. Eine komplette Schmerzfreiheit ist aber aufgrund der erneuten Neurombildung unwahrscheinlich.
Mit rekonstruktiven Techniken dem Nerv ein neues Zielorgan geben
Aktuelle Untersuchungen haben gezeigt, dass durch rekonstruktive Operationsverfahren Neurombildung verhindert und bessere Ergebnisse erzielt werden können. Dafür ist es allerdings notwendig, dem Nerv wieder ein Zielorgan, also ein „neues Zuhause“, anzubieten, um ihm die Möglichkeit zurückzugeben, wieder seine ursprüngliche Funktion auszuüben. So ist es auch möglich, Deafferenzierungsschmerzen vorzubeugen beziehungsweise sinnvoll zu behandeln.
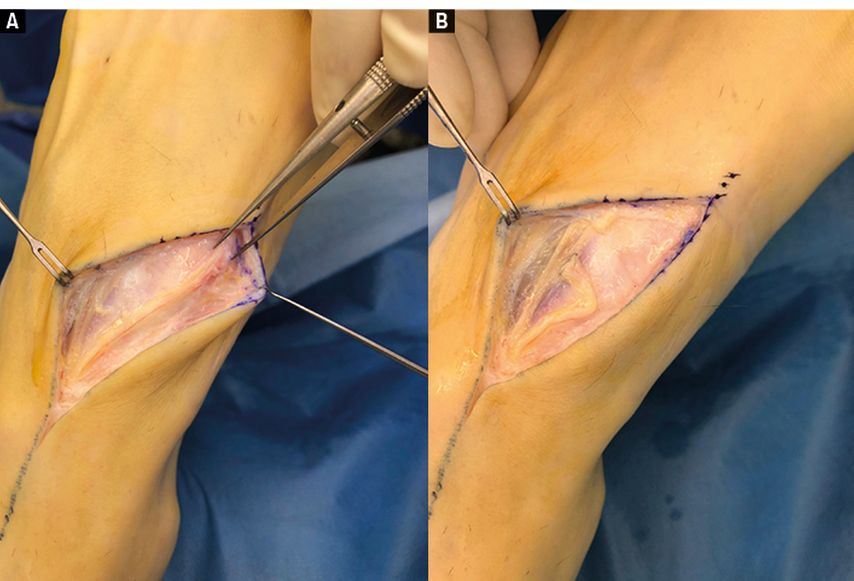
Eine seit Längerem bewährte Möglichkeit ist hier die End-zu-Seit-Neurorhaphie, beschrieben von Aszmann und Mitarbeitern. Hier regenerieren die Axone aus dem Nervenstumpf in einen Nachbarnerv und finden so wieder ein Zielorgan (Abb. 5). Dieses Verfahren bietet sich vor allen an den (distalen) Extremitätenabschnitten an, wo schmerzhafte Neurone – etwa der Digitalnerven nach Fingeramputationen – mittels End-zu-Seit-Naht an den benachbarten Fingernerv koaptiert werden. Die Durchführung des Eingriffes ist relativ einfach und überschaubar, die Inzisionen sind kurz und die Präparation ist einfach und in unmittelbarer Nachbarschaft. Nach Schaffung eines epineuralen Fensters am Empfängernerv erfolgt die mikrochirurgische Koaptation. Postoperativ werden durch eine intensive physikalische Neurorehabilitation die Heilung bzw. Umleitung und Desensibilisierung unterstützt.
Abb. 5A und 5B:Chirurgische Behandlung starker Schmerzen (VAS 7–8/10) am Fußrücken bei einem 18-jährigen Patienten infolge orthopädischer Exostosenabtragung. (A) Im hochauflösenden Nervenultraschall wurde ein Neuroma in continuitatem des Nervus dorsalis intermedius (N. peronaeus superficialis) festgestellt, dessen genauer Verlauf ultraschallgestützt auf der Haut markiert wurde. (B) Der Ultraschallbefund konnte intraoperativ bestätigt und das Problem mit einer End-zu-Seit-Neurorhaphie gelöst werden.
Innovative Methoden aus der bionischen Prothesensteuerung
Ein neues vielversprechendes Konzept ist die gezielte Muskelreinnervierung, englisch „targeted muscle reinnervation“ (TMR). Hier erfolgen die Umlagerung und End-zu-End-Koaptation des proximalen Nervenstumpfes auf einen noch intakten Muskelast. Die Technik stammt eigentlich aus der bionischen Prothetik, um die Signale amputierter Nerven mittels Reinnervation eines Muskels für die bionische Prothese biologisch zugänglich zu machen und gleichzeitig zu verstärken. Als Nebeneffekt wurden exzellente Ergebnisse hinsichtlich niedriger Neuromraten und stark reduzierter Stumpf- und Phantomschmerzen beobachtet – sowohl bei primärer (vorbeugender) TMR bei frischen Amputationsverletzungen als auch bei sekundärer TMR bei bereits existenten schmerzhaften Neuromen.
Ein ebenso ursprünglich zur Steuerung von bionischen Prothesen entwickeltes Verfahren ist die Einlage des proximalen Nervenstumpfes in ein denerviertes Muskelstück, man spricht von „regenerative peripheral nerve interfaces“ (RPNI). Auch diese Technik eignet sich zur Neuromprophylaxe und Therapie existierender Neurome.
Diskussion
Die Behandlung von Läsionen peripherer Nerven ist eine komplexe, aber auch spannende und fordernde Aufgabe, welche ein funktionierendes interdisziplinäres Umfeld erfordern. Der Faktor Zeit („Je schneller, desto besser!“) spielt hier eine früher oft unterschätzte Rolle. Um das Zeitintervall zwischen Läsion und Therapie möglichst kurz zu halten, ist eine rasche und zielgerichtete Diagnosestellung notwendig. Diese hat in den letzten Jahren eine gravierende Veränderung durch neue technologische Entwicklungen, vor allen Dingen des hochauflösenden Ultraschalls, erfahren. Mit dieser Bildgebung, die selbst Hautnerven mit 1–2 Millimeter Durchmesser bis in die Faszikelstruktur darstellen kann, gelingen eine sehr frühe differenzierte Beurteilung und Behandlung der Pathologie. Neben der subtilen Kenntnis der Anatomie und der verschiedenen Pathomechanismen und der daraus resultierenden Nervenläsionen ist die interdisziplinäre Zusammenarbeit zwischen Neurologie, Radiologie und Chirurgie ein entscheidender Fortschritt.
Nach schweren Nervenläsionen stellt sich auch nach Rekonstruktionen meist keine komplette Restitution ein. Dennoch ist oft eine eindeutige Funktionsverbesserung erzielbar, die der Patient auch als solche empfindet. Wir gehen nach unseren Erfahrungen davon aus, dass in deutlich mehr als zwei Dritteln der Fälle durch rechtzeitige Rekonstruktionsmaßnahmen eine funktionell wertvolle Verbesserung für den Patienten erreicht werden kann.
Die Unterstützung durch neurologische und radiologische Facharztkollegen ist für uns Chirurgen, die nur selten selbst diagnostische Untersuchungen durchführen können, von entscheidender Bedeutung. Durch die Ergebnisse von hochauflösenden Ultraschalluntersuchungen, die es heute auch erlauben, die innere Architektur der Nerven genauestens zu beurteilen, können Indikationen für die Operation früher gestellt werden. Durch elektrophysiologische Untersuchungen und die Diagnostik auf der Ebene der Muskulatur sowie die spezialisierte Interpretation dieser Befunde kann im Verlauf eine Dynamik zum Guten oder zum Schlechten erkannt werden und somit die Tendenz in Richtung Operation oder auch dagegen erkannt werden.
Jede Verzögerung einer Wiederherstellung der Nerven- und damit der motorischen oder sensiblen Funktion führt zu negativen Veränderungen des Neurons selbst, seiner Zielorgane und des zentralen Nervensystems. Je früher eine notwendige Rekonstruktion durchgeführt werden kann, desto besser ist die Prognose für das postoperative funktionelle Ergebnis. Zusätzlich lässt sich dadurch auch der Leidensweg bzw. auch der Funktionsausfall für den Patienten verkürzen.
Ein spezielles Problem sind chronische neuropathische Schmerzsyndrome, die für die Betroffenen oft sehr behindernd und psychosozial belastend, teilweise sogar invalidisierend sein können.
Das Problem bei iatrogenen Nervenverletzungen und Neuromen ist jedoch, dass erfahrungsgemäß zwischen dem operativen Eingriff und der nachfolgenden Symptomatik der kausale Zusammenhang oft nicht erkannt und die Läsion erst erheblich verzögert behandelt wird. Wie schon erwähnt, ist allerdings genau dieser Zeitfaktor oft entscheidend, weil chronische neuropathische Schmerzen als schwer behandelbar gelten und oft nur mäßige Erfolge erreicht werden. Die Ursache liegt in den komplexen pathophysiologischen Mechanismen nach Nervenverletzung, die auf peripherer, spinaler und zentraler Ebene auftreten und sich im Verlauf mit zunehmender Chronifizierung verändern. Dies gilt sowohl für konservative rehabilitative Maßnahmen als auch medikamentöse Therapien oder nachfolgende Operationen. Das somato-sensorische System reagiert nach einer Nervenverletzung auf sinnvolle sensorische Reize mit einer schnelleren Regeneration, wodurch sich das Risiko für ein Schmerzsyndrom erheblich vermindert.
Lange bestehende Neuropathien gelten auch schmerzmedizinisch als schwierig behandelbar. Ein hoher Analgetikabedarf kann bis hin zur Abhängigkeitsstörung führen, obwohl eine Schmerzverbesserung durch medikamentöse Therapie in nur 30–40% erreicht wird. Beim Auftreten von Neuromen unterziehen sich viele Betroffene einer chirurgischen Neuromexzision (66%), mit einer Beschwerdebesserung von jedoch nur 77%. Die Rezidivrate ist hoch, die Reoperationsrate liegt bei bis zu 27% – mit abnehmendem Erfolg, je häufiger operiert wird.
Sowohl bei Nervenverletzungen als auch bei neuropathischen Schmerzsyndromen gilt es also, die Behandlung und die Funktionswiederkehr zu beschleunigen und Funktionsausfall sowie Schmerzdauer zu minimieren. Der verantwortungsvolle Chirurg zeichnet sich dadurch aus, dass er mit eventuell auftretenden Komplikationen richtig umgehen kann. Er sollte Komplikationen rasch erkennen und die adäquate Therapie einleiten, um dadurch die besten Chancen auf eine baldige und möglichst vollständige Regeneration herzustellen. Er ist hierbei aber auch auf eine gute fachübergreifende Kooperation angewiesen.
Schlussfolgerungen
-
Die periphere Nervenchirurgie ist ein Spezialgebiet, in dem die vertrauensvolle Kommunikation und enge Kooperation des Chirurgen mit Fachkollegen aus Neurologie und Radiologie stetig an Wichtigkeit gewinnen.
-
Ein erfolgreiches Therapiekonzept erfordert einen großen klinischen und Erfahrungsschatz, um schnell und gezielt die richtige Diagnose zu finden und gegebenenfalls die Indikation zur operativen Therapie zu stellen.
-
Vor allem mit der Weiterentwicklung der hochauflösenden Ultraschallgeräte steht ein neues Diagnoseverfahren zur Verfügung, das neben den seit langer Zeit etablierten neurophysiologischen Tests einen richtungsweisenden Einfluss auf die Therapie von Nervenläsionen ausüben kann.
-
Bei Nervenrekonstruktion haben neben der mikrochirurgischen Naht und Defektüberbrückung mittels autologer Transplantate innovative Techniken des Nerventransfers an Bedeutung gewonnen. Durch den extraanatomischen Kurzschluss zwischen Spender- und Empfängernerv lässt sich Regenerationsstrecke sparen und damit Zeit gewinnen, sodass sich die Aussicht auf eine Wiederkehr nützlicher Funktionen erhöht.
-
Bei neuropathischen Schmerzsyndromen sollten vor allem in der Neuromtherapie auch neuartige rekonstruktive Ansätze berücksichtigt werden. Diese versuchen den nach der Neuromexzision unvermeidlich auswachsenden Nervenfasern ein neues Zielorgan anzubieten. So kann in vielen Fällen die Ausbildung von schmerzhaften Neuromen verringert und auch die chronische Schmerzsituation vieler Patienten verbessert werden.
Literatur:
● Challoner T et al.: The surgical management of traumatic neuromas. J Musculoskelet Surg Res 2019; 3: 22-9 ● Decrouy-Duruz V et al.: Evaluation of surgical treatment for neuropathic pain from neuroma in patients with injured peripheral nerves. J Neurosurg 2018; 128: 1235-40 ● Eberlin KR et al.: Surgical algorithm for neuroma management: A changing treatment paradigm. PRS Global Open 2018, 16; 6: e1952 ● Guse DM et al.: Outcomes of the surgical treatment of peripheral neuromas of the hand and forearm: a 25-year comparative outcome study. Ann Plast Surg 2013; 7: 654-8 ● Harhaus L et al.: Neurome. In: Antoniadis G, Harhaus L, Assmus A: Chirurgie peripherer Nerven kompakt. Springer 2021, 257-64 ● Ives GC et al.: Current state of the surgical treatment of terminal neuromas. Neurosurg 2017; 83 (3): 354-64 ● Kent ML et al.: Perioperative pain management strategies for amputation: a topical review. Pain Med 2017; 18: 504-19 ● Kern U et al.: Phantom limb pain in daily practice - still a lot of work to do! Pain Med 2012; 13: 1611-26 ● Kuiken TA et al.: Targeted muscle reinnervation for the upper and lower extremity. Tech Orthop 2017; 32: 109-16 ● Navarro X et al.: Neural plasticity after peripheral nerve injury and regeneration. Prog Neurobiol 2007; 82: 163-201 ● Poppler LH et al.: Surgical interventions for the treatment of painful neuroma: a comparative meta-analysis. Pain 2018; 159: 214-23 ● Riegler G et al.: Ultrasound anatomic demonstration of the infrapatellar nerve branches. Arthroscopy 2018; 34: 2874-883 ● Salminger S et al.: Immediate and secondary reconstruction of iatrogenic nerve lesions. Chir Prax 2014; 78: 625-37 ● Seddon HJ: A classification of nerve injuries. Br Med J 1942; 2: 237-9 ● Souza JM et al.: Targeted muscle reinnervation: a novel approach to postamputation neuroma pain. Clin Orthop Relat Res 2014; 472: 2984-90 ● Stokvis A et al.: Insufficient pain relief after surgical neuroma treatment: prognostic factors and central sensitisation. J Plast Reconstr Aesthet Surg 2010; 63: 1538-43 ● Vlot M et al.: Symptomatic neuroma following initial amputation for traumatic digital amputation. J Hand Surg 2018; 43: 86-e1
Das könnte Sie auch interessieren:
Alzheimer: Was gibt es Neues in der Biomarker-Entwicklung?
Schätzungen zufolge leben in Österreich 115000 bis 130000 Menschen mit einer Form der Demenz. Eine Zahl, die sich bis zum Jahr 2050 verdoppeln wird.1 Antikörper-Wirkstoffe könnten in der ...
Kappa-FLC zur Prognoseabschätzung
Der Kappa-freie-Leichtketten-Index korreliert nicht nur mit der kurzfristigen Krankheitsaktivität bei Multipler Sklerose, sodass er auch als Marker zur Langzeitprognose der ...
Fachperson für neurophysiologische Diagnostik – Zukunftsperspektiven eines (noch) unterschätzten Berufes
Die Aufgaben der Fachperson für neurophysiologische Diagnostik (FND) haben sich in den letzten Jahren verändert. Dies geht zum einen mit den erweiterten Diagnostikmöglichkeiten und zum ...